Разработка и идентификация романа субпопуляции человеческого нейтрофилами производного Giant фагоцитов<em> In Vitro</em
Summary
Здесь мы опишем способ получения и идентификации новых характеризующийся субпопуляции нейтрофильных происхождения гигантских фагоцитов. Эти клетки развиваются в культуре из свежих нейтрофилов крови человека, и характеризуются фагоцитоза, аутофагии, очень большого размера, и увеличенный срок службы. Этот метод имеет важное значение для дальнейшего изучения этого уникального нейтрофильной происхождения субпопуляции.
Abstract
Нейтрофилы (ПМН) лучше всего известны своими фагоцитарной функции от вторжения патогенных микроорганизмов и микроорганизмов. Они имеют самый короткий период полураспада среди лейкоцитов, а также в их неактивированной состоянии конститутивно стремится к апоптозу. Когда нанят для воспаленных участков для разрешения воспаления, они производят множество цитотоксических молекул с мощным антимикробным убийства. Тем не менее, когда эти мощные цитотоксические молекулы высвобождаются в неконтролируемым образом они могут привести к повреждению окружающих тканей. В последние годы, однако, нейтрофилы универсальность все чаще подтверждается, демонстрируя пластичность и иммунорегуляторных функций. Недавно мы идентифицировали новую нейтрофильной происхождения субпопуляции, развивающий спонтанно в стандартных условиях культивирования без добавления факторов цитокины / роста, таких как гранулоцитарный колониестимулирующий фактор (GM-CSF) / интерлейкин (IL) -4. Их фагоцитарной способности нейтрофилов остатков в значительной степени способствовать повышению ихразмер безмерно; поэтому они были названы гигантские фагоциты (Сф). В отличие от нейтрофилов, Сф давно жили в культуре. Они выражают кластер дифференцировки (CD) нейтрофильных маркеры CD66b / CD63 / CD15 / CD11b / миелопероксидазы (MPO) / эластазы нейтрофилов (NE), и лишены моноцитов маркеров линии преемственности CD14 / CD16 / CD163 и дендритных маркеры CD1c / CD141 , Они также принимают вверх латекс и зимозан, и реагировать на окислительный взрыв стимуляции с опсонизированным-зимозан и РМА. Сф также выражают поглотитель рецепторов CD68 / CD36, и в отличие от нейтрофилов, усваивают окисленных липопротеинов низкой плотности (oxLDL). Кроме того, в отличие от свежих нейтрофилы, моноциты или культивированного, они реагируют на поглощение oxLDL за счет увеличения активных форм кислорода (ROS) производства. Кроме того, эти фагоцитов содержат ассоциированный с микротрубочками белок-1 легкой цепи 3B (LC3B) вакуоли с покрытием, что указывает на активацию аутофагии. Использование специфических ингибиторов, очевидно, что как фагоцитоз и аутофагия являются prerequisiTES для их развития и, вероятно, НАДФН-оксидазы зависимой ROS. Мы опишем здесь способ получения этой новой субпопуляции долгоживущих, нейтрофильных происхождения фагоцитирующих клеток в культуре, их идентификации и их известных в настоящее время характеристик. Этот протокол имеет важное значение для получения и характеризующий Сф с целью дальнейшего изучения их значение и функции.
Introduction
Полиморфноядерные нейтрофилы (ПМН) составляют самую большую популяцию лейкоцитов в крови, выступающей в качестве первой линии обороны против вторжения патогенных микроорганизмов, производя широкий спектр цитотоксических молекул. Традиционная точка зрения уже давно, что профессиональных фагоцитов крови, циркулирующей непродолжительным, которые являются первыми, чтобы прибыть в острых воспалительных очагов бороться с инфекциями и помощь в зазоре патогенов и вредных частиц. 1 В их неактивированной состоянии, нейтрофилы конститутивно приверженность к апоптозу. При миграции из крови в местах воспаления, нейтрофилы подвергаются активации для разрешения воспаления. Они фагоцитируют и убить вторжения микроорганизмов, производя множество цитотоксических молекул в качестве активных форм кислорода (ROS), литические ферменты, такие как эластазы нейтрофилов (NE) и катепсинов с мощной бактерицидной активностью. Для того, чтобы улавливать патогенами, нейтрофилы также выделяют внеклеточные ловушки (сетки), Которые состоят из ядерного хроматина нитей, содержащих антибактериальные пептиды и различные литические ферменты. Тем не менее, неконтролируемый выброс этих цитотоксических молекул из нейтрофилов может также увековечить воспалительные реакции и вызывают повреждение окружающих тканей. 2 Таким образом, эффективный клиренс апоптотических нейтрофилов макрофагами (М ^) и дендритные клетки (DC) имеет решающее значение для устранения воспаления. 3, 4, 5, 6
В последние годы, однако, становится все более очевидным, что нейтрофилы являются весьма разносторонние клетки, функции которых выходят далеко за пределы фагоцитоза и патогена убийства. 6, 7 Соблюдая гигиену грунтование или активацию нейтрофилов пластичностью постепенно завоевывает все внимание. Например, бактерии и микобактерии оспаривались нейтрофилы показаносекретируют интерлейкин (IL) -10 и контролировать воспалительную реакцию, что указывает на наличие иммуно-регуляторных реакций. 8 постмитотическими нейтрофилы показано транс-дифференцироваться в М ^-подобных клеток, или постоянного тока , таких как клетки при переваривании и представляя антиген фрагментов при обработке цитокинов и факторов роста, 9, 10 , таким образом, служит решающую роль в интеграции врожденной и адаптивной ответы. 3, 6 Активация факторов роста способствовали при полном охвате апоптотических нейтрофилов или остатков клеток, тем самым, облегчая очистку мусора в местах воспаления и разрешение воспаления, 3, 9 в частности , когда система зазора М ^ / DC является недостаточным или перегружены, 11, 12 предлагая потенциал "саморегулирование", чтобы помочь восстановитьрешить воспалительную реакцию. Это, так как апоптоз является формой регулируемой собственной смерти, которое может ингибировать внеклеточный высвобождение цитотоксических соединений, и тем самым предотвратить повреждение окружающих тканей. 6
Увеличивал выживаемость является еще одним признаком активации нейтрофилов и была продемонстрирована путем обработки различными принимающими получены факторы, такие как гранулоцитарный колониестимулирующий фактор (G-CSF), гранулоцитарно-макрофагальный колониестимулирующий фактор (GM-CSF), воспалительных цитокинов, таких как интерферон ( ИФН) -γ, фактора некроза опухоли (ФНО) и / или патогена, полученных продуктов, таким образом, позволяя нейтрофилы модулировать их реакцию выживания. 6 На самом деле, выживание нейтрофилов является необходимым условием для его пластичности и было связано с его способностью выполнять фагоцитоз. 6, 13 Соответственно, было также показано , что ассоциируют с фенотипическими и функциональными изменениями , которые висимостьDed на повышающей регуляции экспрессии генов, индуцируя синтез новых белков, участвующих в нейтрофильных расширении продолжительность жизни, и уменьшалась апоптоза. 10
В отличие от нейтрофилов, которые недолго и конститутивно апоптозу в культуре, или цитокины / факторы роста активированные нейтрофилы, описанные выше, которые продлевал срок службы, в последнее время мы идентифицировали новую, небольшой субпопуляции нейтрофилов, которая развивается спонтанно в продолжительном стандартной культуре условия из свежеизолированных нейтрофилов крови человека без добавления извне цитокины или факторы роста. 14 Эти нейтрофильных полученные клетки, которые не были описаны ранее в литературе были названы гигантские фагоциты (Сф). Сф продлили продолжительность жизни в культуре, они полностью разработаны в течение 5-7 дней, и характеризуются уникальными морфологическими признаками, экспрессии фенотипического и функций. Они значительно увеличены за счет autophagoЦитоз мертвых остатков нейтрофильных, вакуолизированных, и содержат фаголизосомах. Сф выражают специфический маркер гранул нейтрофилов – кластер дифференцировки (CD) 66b, азурофильных гранулы маркеров – CD63 и миелопероксидазы (МРО) и дополнительные нейтрофилы маркеры , такие как CD11b, NE, CD15, НАДФН – оксидазы субъединиц gp91- phox и p22- phox и аутофагия маркер -LC3BII. 14, 15 Функционально, они активно принимают меры латексные шарики и частицы зимозаном, а также генерировать ROS в ответ на зимозаном и форбол 12-миристат 13-ацетата (РМА) стимуляции. Интересно, что в отличие от свежих нейтрофилы, Сф также интенсивно выражают мусорщик рецепторов CD68 и CD36, натяжные окисляется липопротеинов низкой плотности (oxLDL), а также генерировать ROS в ответ на стимуляцию oxLDL. Кроме того, Сф лишены моноцитарных маркеров CD14 линии дифференцировки, CD16 и CD163 или дендритные маркеры CD1c и CD141. Кроме того, PHAgocytosis и аутофагии и, вероятно, функциональная NADPH оксидазы являются необходимыми условиями для их развития. Это с тех пор, фагоцитоза-ингибитор cytochalsin В, ингибиторы автофагии 3-метиладенин (3-МА) и bafilomycin (BafA1) и ингибитор оксидазы NADPH – дифенилен иодония (DPI) – предотвратить их развитие. Кроме того, моноциты / нейтрофилы сокультурах, а также воздействие прерывистой гипоксии препятствует их развитию, в то время как нейтрофилы адаптация к устойчивой гипоксии была очевидна. 14,15 Их развитие в Рекомендованное культуры показана на рисунке 1 протокол .The в настоящем документе описывается шаг за шагом подготовки от G ^ свежевыделенные циркулирующих нейтрофилов крови человека, их развитие, идентификацию и некоторые основные характеристики. Этот протокол может быть использован для дальнейшего исследования и выявить широкий спектр и роль этих недавно описал и интригующим нейтрофилы происхождения Сф для того, чтобы characterizе их значение и их потенциальные функции.
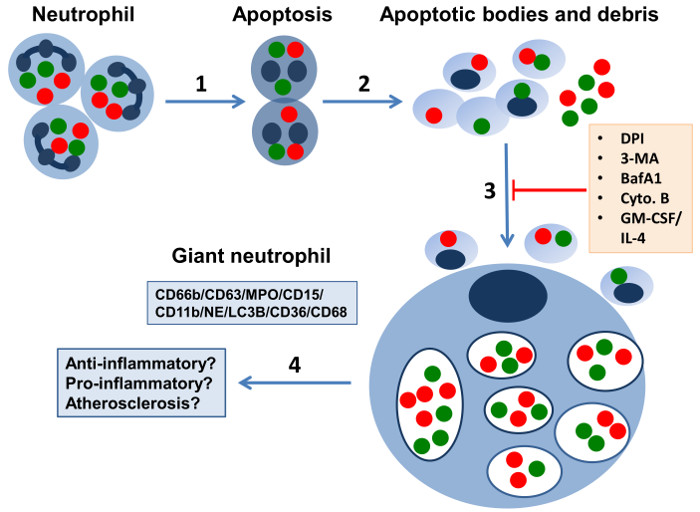
Рисунок 1: Схематическое изображение развития гигантских клеток в 7 -й день нейтрофильных культур. Предполагается , что на участках воспаления (1) нейтрофилы подвергаются апоптотической гибели клеток, и (2) релиз мембраной окружении фрагментов , содержащих ядерный мусор, гранулы (зеленые и красные точки) и другие субклеточные компоненты , которые запускают механизмы аутофагии. (3) Гигантские фагоциты (Сф) развиваются в долгосрочных нейтрофильных культур , лишенных цитокинов или факторов роста усваивая апоптотических телец и нейтрофилов мусора, сохраняя при этом функциональный NADPH oxidase.They характеризуются различными нейтрофильного CD66b + / CD63 + / MPO + / CD15 + / CD11b + / NE маркеры, большие фагосомы ограждающих гранул и остатков клеток и мусорщик рецепторов CD36 и CD68. гигабайт1; в основном мононуклеарные клетки, способные к интернализации также различные частицы и окисленного LDL и генерировать ROS. Мембраны вакуолей заполнения Сф содержат LC3B (отмечены темно-синим цветом), маркера autophagosomal мембраны, что предполагает строгую ассоциацию между аутофагии и формирования гигантского фагоцитов. Сф не развиваются в среде, содержащей GM-CSF / IL-4. Кроме того, ингибиторы, такие как ингибитор NADPH-оксидазы – дифенилен иодония (DPI), ингибиторы автофагии 3-метиладенин (3-МА) и bafilomycin (BafA1) и ингибитор фагоцитоз цитохалазином (. Цито B) отменить их образование. (4) Потенциальные функции Сф в естественных условиях может включать в себя анти- или провоспалительные свойства и участие в атеросклеротических процессах (эта цифра основана на наших выводах 14, 15 и был изменен с сопровождающим редакционную BЭртон 20). Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
Protocol
Representative Results
Discussion
Гигантские фагоциты (Сф) представляют собой новое определение субпопуляции нейтрофильных клеток, полученных, выражающих основные и специфические нейтрофильные маркеры, такие как CD66b / CD15 / CD63 / MPO / NE. Этот тип нейтрофильного происхождения фагоцитов не было описано в литературе ранее. В отличие от нейтрофилов, которые недолговечны и апоптозу, Сф являются аннексина-V-отрицательных и отобразить увеличенный срок службы. Тем не менее, как и нейтрофилы, Сф также усваивают частицы и производят NADPH-оксидаза-зависимого ROS в ответ на эти частицы и РМА. Тем не менее, их способности усваивать OxLDL и, следовательно, производить ROS уникальные особенности G ^. 14
Показано, целый ряд факторов, чтобы повлиять на их развитие в культуре. Отсутствие внешних цитокинов или факторов роста в среде для роста имеет важное значение (в частности, GM-CSF, / ИЛ-4). Тем не менее, нейтрофилы миграция в IL-8 оказался дискриминационный фактор между теми, что устрскрывшийся в G ^ и те, которые не сделали. Кроме того , интернализация мусора , возникающего из апоптотических нейтрофилов, экспрессия аутофагии белков (LC3B) и функциональной НАДФН – оксидазы, были показано, что крайне важно для их развития, так как их ингибирование предотвращено образование Сф (рисунок 1). По-видимому, развитие этих гигантских клеток, возникающих из нейтрофилов отличается от того, характеризующего образованию гигантских клеток в моноциты / макрофаги линии. Последняя форма мульти-зарождаются гигантские клетки , связанные с различными хроническими воспалительными заболеваниями, 20, 21 , тогда как нейтрофильный Сф , описанные здесь развиваются через autophagocytosis, на поглощение клеточные остатки и остаются в основном моно-зарождаться на протяжении всего их развития, 14 (редко , однако, иногда второй ядро может наблюдаться). Кроме того, ряд управлений установили их происхождение нейтрофильный: (1) expression специфических маркеров neutropilic и отсутствие дендритных и моноцитарного линии дифференцировки маркеров, (2) их тормозится развитие в моноцитах / ПМН сокультурах, (3) их различные образцы движения в культуре из макрофагов (о чем свидетельствует ячейки изображения и времени живой -lapse микроскопия), 14 (4) свет их присоединение к пластиковой посуде и (5) их развитие из чистого CD15 + / CD14 – ПМН , приобретенных с помощью проточной цитометрии.
Некоторые из функций , определенных в лабораторных условиях может дать нам подсказки относительно их потенциальных функций в естественных условиях. Например, способности G ^ потреблять большое количество нейтрофильных гранул и мусора, наличие крупных вакуолей, а выражение LC3B – аутофагия белка , который способствует уменьшению воспаления через регуляторных взаимодействий с врожденными путей иммунной сигнализации, 22 – все из которых поддержка поглощающие способности. Как таковойЭти данные также показывают, что Сф может функционировать при воспалительных участках, где система М ^ / DC является недостаточным или перегружены, и, таким образом, внести свой вклад в разрешение воспаления. Это понятие может быть подтверждается тем фактом, что в смешанных культурах моноцитов / нейтрофильных развитие Сф затруднено. 14 Кроме того , учитывая , что Сф выразить oxLDL мусорщик рецепторов (CD36, CD68), усваивают oxLDL, и производят ROS в ответ на это, может свидетельствовать о том , что они участвуют в атеросклеротических процессах для разрешения воспаления. Так как Сф разработаны только из нейтрофилов, которые мигрировали в сторону IL-8 и трансмиграции нейтрофилов через эндотелиальные монослои к IL-8 представляет собой набор нейтрофилов на острых воспалительных очагов, эта находка также может поддерживать противовоспалительными функции. И наоборот, производительность G ^ в некоторых воспалительных состояний может позволить им выполнять зернистых составляющие и ROS, таким образом, способствуя впоследовательны воспаление и повреждение тканей. 20 Тем не менее, в целом, их аутофагической способности показывают , что Сф, вероятно , участвуют в снижении воспалительной реакции , а не увековечить его.
Интересно, мы недавно выявили наличие в G ^ атеросклеротических бляшек человека. (в процессе подготовки). Тем не менее, большое количество вопросов еще предстоит разгадать. Например, являются ли Сф про- или противовоспалительным? Каковы факторы, определяющие их формирование и функции в пробирке или в естественных условиях? Какие конкретные субпопуляции нейтрофилов является их клеток-предшественников, что способствует их развитию в G ^? Являются ли они связаны с определенными патологиями и какие? Коллективно, создает интересные вопросы относительно их происхождения и потенциальных функций.
Однако критические шаги и подводных камней в рамках протокола следует иметь в виду. Важным шагом в развитии Сф Iс культивированием чистые нейтрофилы в среде, лишенной цитокинов, факторов роста или антибиотиков. Другим важным шагом является исключаем, что Сф развиваются из загрязняющими моноцитов и выяснить происхождение нейтрофильный G ^. Таким образом, после разделения крови по ступенчатом градиенте, нейтрофилы дополнительно подвергали дополнительной стадии очистки с помощью проточной цитометрии с использованием гранулоцитарного стробирования и CD15 + / CD14 – маркеры. Разработанный Сф полученный из нейтрофилы, которые были дополнительно очищены с помощью проточной цитометрии с разделением не отличались от тех, которые не были подвергнуты этой стадии очистки. Таким образом, большинство экспериментов проводились без проточной цитометрии стадии очистки из-за дополнительной потери клеток. Следует отметить, что в некоторых редких случаях были отмечены некоторые эозинофилов в культуре. Их размер остается неизменным на протяжении всего периода культивирования. Следует также отметить, что, хотя существует целый ряд методовдля разделения нейтрофилов из крови человека, описанный здесь метод является единственным методом, мы использовали, и поэтому мы не можем сравнивать развитие Сф другими доступными методами для разделения нейтрофилов.
Основным ловушкой при исследовании Сф является результатом неспособности получить достаточное количество чистой популяции Сф подходит для различных биохимических анализов. Это в принципе невозможно в условиях проводились наши эксперименты. Во-первых, выход G ^ является низкой. От 1,0 × 10 6 ПМН засевали приблизительно 100 – 200 Сф развиваться после семи дней в культуре, в зависимости от донора крови. Во-вторых, это в основном трудно в данный момент, чтобы отделить развитую Сф в культуре от остающегося нейтрофильной мусора в чашке. Эти ограничения сделали практически невозможным анализировать клетки с помощью биохимических и молекулярных методов биологии. Таким образом, этот протокол ориентирован на описание идентификации и функции Сф с помощью светаи конфокальной микроскопии. Их морфологическое преобразование из нейтрофилов в G ^ в культуре также следуют клетки живого изображения и времени покадровой микроскопии. 14 По- видимому, гораздо большие объемы крови могут быть необходимы для осуществления биохимических или молекулярных методов биологии и преодолеть низкий выход , полученный и отделения жизнеспособного Сф от мусора нейтрофилов в блюдо.
Таким образом, мы недавно описал впервые развитие в культуре G ^, субпопуляции долгоживущих фагоцитов нейтрофильного происхождения. Таким образом, это единственный метод, доступный в настоящее время для получения Сф в культуре, хотя два основных ограничения, упомянутые выше, должны быть преодолены (низкий выход G ^, полученного в культуре и неспособность отделить развитую Сф от нейтрофильной мусора в культуре блюдо). Тем не менее, их подготовка и идентификация, представленные в этом протоколе, является эссенциял для ученых, заинтересованных в воспалительных реакциях и нейтрофилов биологии и пластичности, в целях дальнейшего изучения потенциального значения и функции G ^.
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
Авторы благодарят доктора Эдит Süß-Toby за неоценимую помощь в конфокальной микроскопии исследований. Это исследование было поддержано Министерством иммиграции абсорбции и Комитета по планированию и бюджетированию Совета по высшему образованию в рамках программы Kamea (LD и AP). Мы также с благодарностью отмечаем поддержку научный сотрудник от Lady Davis Foundation пост-докторские на проведение исследовательских работ (OR).
Materials
| Sterile scalp vein set (21GX3/4) | Bio Diagnostics Ltd. | # 20080312 | A strile needle for venipancture |
| VACUETTE HOLDEX Single-Use Holder PP | Greiner Bio-One | # 450263 | For securing during venipuncture |
| VACUETTE Tube K3E K3EDTA (16×100/9 ml) | Greiner Bio-One | # 455036 | Sterile tube for blood collection |
| Nunclon MultiDish (24 wellx1ml) | Thermo Scientific | # 142475 | |
| Polypropylene conical centrifuge tube (50 ml) | Greiner Bio-One | # E14103PJ | |
| Transwell-24 well (transmigration assay) | Corning | # CA-3415 | Polycarbonate membrane, 6.5 mm diameter, 3 μm pores) |
| RPMI-1640 medium | BioIndustries | # 01-100-1A | Do not add antibiotics |
| EA.hy926 (ATCC CRL2922) | BioIndustries | # CRL-2922 | |
| ATCC-formulated Dulbecco’s Modified Eagle’s Medium | BioIndustries | # 302002 | complete growth medium |
| Polysucrose – Histopaque1119 | Sigma-Aldrich | # 1119-1 | Tissue culture grade |
| Polysucrose – Histopaque1077 | Sigma-Aldrich | # 1077-1 | Tissue culture grade |
| Phosphate buffered saline (PBS) – ion free | BioIndustries | # 02-023-1A | Cell biology and molecular biology grade |
| Heat inactivated Fetal calf serum (HI-FCS) | BioIndustries | # 04-121-1B | Cell biology grade or tissue culture grade, low LPS |
| NaCl | Sigma | # S3014 | Molecular biology grade, suitable for cell culture |
| Paraformaldehyde, 16% | Electron Microscopy Sciences | # 15710 | Cell bology grade or tissue culture grade (only 16% PFA) |
| Triton X-100 | Sigma-Aldrich | # 9002-93-1 | Molecular biology grade |
| Normal Goat Serum | BioIndustries | # 04-009-1 | Cell biology and molecular biology grade |
| Trypan blue | BioIndustries | # 031021B | Tissue culture grade |
| May-Grünwald | Sigma-Aldrich | # MG500 | Cell biology grade-(procedure No GS-10) |
| Giemsa stain Kit | Sigma | # 48900 | Cell biololgy grade-(procedure No GS-10) |
| Fibronectin | BioIndustries | # 03090105 | |
| Human Interleukin-8 (CXCL8) | PeproTech | # 200-08-5 | |
| Anti-CD14 (clone 5A3B11B5) | Santa Cruz Biotechnologies | # sc-58951 | Mouse IgG2b; expressed by monocytes |
| Anti-CD63 (clone MX-49.129.5) | Santa Cruz Biotechnologies | # sc-5275 | Mouse IgG1; expressed by neutrophils |
| Anti-CD66b (clone 80H3) | AbD Serotec | # MCA216 | Mouse IgG1; expressed by neutrophils |
| Anti-CD1c (BDCA-1) (clone AD5-8E7) | MACS Miltenyi Biotec | # 130-090-695 | Mouse IgG2a; expressed by dendritic cells |
| Anti-CD15 (clone MY-1) | Abcam | # ab754 | Mouse IgM; expressed by neutrophils |
| Anti-Cytochrome b-245 Light Chain (p22-phox) (clone 44.1) | BioLegend | # 650001 | Mouse IgG2a; to recognize neutrophil NADPH oxidase complex |
| Anti-CD68 | Protein Tech | # 16192-1-AP | Rabbit IgG; to recognize oxLDL scavenger receptor |
| Anti-LC3B | Sigma | # L7543 | Rabbit IgG |
| Anti-Myeloperoxidase | Abcam | # ab45977 | Rabbit IgG |
| Anti-Neutrophil elastase | Calbiochem | # 481001 | Rabbit IgG |
| Anti-NOX2 (gp91-phox) | Abcam | # ab131083 | Rabbit IgG |
| Anti-CD36 (SR-B3) | Novus Biologicals | # NB400-144 | Rabbit IgG |
| Purified Mouse IgG1, κ Isotype Control (clone MG1-45) | BioLegend | # 401401 | Antibody used as isotype control |
| Purified Mouse IgG2a, κ Isotype Control (clone MOPC-173) | BioLegend | # 400263 | Antibody used as isotype control |
| Normal rabbit IgG | Santa Cruz Biotechnologies | # sc-2027 | Antibody used as isotype control |
| CF488A Goat Anti-Rabbit IgG (H+L) | Biotium | # 20012 | Anti-Rabbit IgG with the green fluorescent dye CF488A |
| CF647 Goat Anti-Rabbit IgG (H+L) | Biotium | # 20043 | Anti-Rabbit IgG with the red fluorescent dye CF647 |
| CF488A Goat Anti-Mouse IgG (H+L) | Biotium | # 20010 | Anti-Mouse IgG with the green fluorescent dye CF488A |
| CF647 Goat Anti-Mouse IgG (H+L) | Biotium | # 20040 | Anti-Mouse IgG with the red fluorescent dye CF647 |
| Fluorescent Mounting Medium with DAPI | Vectashield H-1000; Vector Lab Inc. | # E19-18 | Nuclear staining |
| Confocal laser scanning microscope (LSM 700) | Carl Zeiss | Ser.# 3523000380 | Plan Apo x40 immersion oil objective |
| Zeiss CLSM software (ZEN 2010) | Carl Zeiss MicroImaging GmbH | version 6.0 | For colocalization analysis |
| ImageJ software | Wayne Rasband, NIH, USA | version 1.49k | For determination of cell areas and fluorescence intensity |
| Light microscope (Axiovert 25) | Carl Zeiss | Ser.# 201060153 | Examination of cells in culture |
| Centrifuge (Megafuge 1.0 R) | Heraeus Instruments | # D-37520 | Cells separation from blood; cytospins preparation |
| Inverted fluorescent microscope (Zeiss Axio Observer Z.1) | Carl Zeiss | Ser.# 3834001470 | Demonstration of giant phagocytes development |
| Temperature-controlled incubation system (Cube&Box) | Life Imaging Services | Temperature control system for microscopes | |
| High resolution digital CCD camera (AxioCam HRm) | Carl Zeiss | Ser.# 117090279 | For capturing high-contrast image data from an examined cell objects |
Riferimenti
- Borregaard, N. Neutrophils, from marrow to microbes. Immunity. 33, 657-670 (2010).
- Silva, M. T., Correia-Neves, M. Neutrophils and macrophages: the main partners of phagocyte cell systems. Front. Immunol. 3, 174 (2012).
- Cowburn, A. S., Condliffe, A. M., Farahi, N., Summers, C., Chilvers, E. R. Advances in neutrophil biology: clinical implications. Chest. 134, 606-612 (2008).
- Duffin, R., Leitch, A. E., Fox, S., Haslett, C., Rossi, A. G. Targeting granulocyte apoptosis: mechanisms, models, and therapies. Immunol. Rev. 236, 28-40 (2010).
- Silva, M. T. Macrophage phagocytosis of neutrophils at inflammatory/infectious foci: a cooperative mechanism in the control of infection and infectious inflammation. J. Leukoc. Biol. 89, 675-683 (2011).
- Witko-Sarsat, V., Pederzoli-Ribeil, M., Hirsch, E., Sozzani, S., Cassatella, M. A. Regulating neutrophil apoptosis: new players enter the game. Trends Immunol. 32, 117-124 (2011).
- Cassatella, M. A., Locati, M., Mantovani, A. Never underestimate the power of a neutrophil. Immunity. 31, 698-700 (2009).
- Zhang, X., Majlessi, L., Deriaud, E., Leclerc, C., Lo-Man, R. Coactivation of Syk kinase and MyD88 adaptor protein pathways by bacteria promotes regulatory properties of neutrophils. Immunity. 31, 761-771 (2009).
- Araki, H., et al. Reprogramming of human postmitotic neutrophils into macrophages by growth factors. Blood. 103, 2973-2980 (2004).
- Iking-Konert, C., et al. Up-regulation of the dendritic cell marker CD83 on polymorphonuclear neutrophils (PMN): divergent expression in acute bacterial infections and chronic inflammatory disease. Clin. Exp. Immunol. 130, 501-508 (2002).
- Rydell-Tormanen, K., Uller, L., Erjefalt, J. S. Neutrophil cannibalism–a back up when the macrophage clearance system is insufficient. Resp. Res. 7, 143 (2006).
- Esmann, L., et al. Phagocytosis of apoptotic cells by neutrophil granulocytes: diminished proinflammatory neutrophil functions in the presence of apoptotic cells. J. Immunol. 184, 391-400 (2010).
- Nordenfelt, P., Tapper, H. Phagosome dynamics during phagocytosis by neutrophils. J. Leukoc. Biol. 90, 271-284 (2011).
- Dyugovskaya, L., Berger, S., Polyakov, A., Lavie, L. The development of giant phagocytes in long-term neutrophil cultures. J. Leukoc. Biol. 96, 511-521 (2014).
- Dyugovskaya, L., Berger, S., Polyakov, A., Lavie, P., Lavie, L. Intermittent Hypoxia Affects the Spontaneous Differentiation In Vitro of Human Neutrophils into Long-Lived Giant Phatocytes. Oxid. Med. Cell. Longev. , 9636937 (2016).
- Mihalache, C. C., et al. Inflammation-associated autophagy-related programmed necrotic death of human neutrophils characterized by organelle fusion events. J. Immunol. 186, 6532-6542 (2011).
- Manders, E. M. M., Verbeek, F. J., Aten, J. A. Measurement of Colocalization of Objects in Dual-Color Confocal Images. J. Microsc. 169, 375-382 (1993).
- Matsushima, H., et al. Neutrophil differentiation into a unique hybrid population exhibiting dual phenotype and functionality of neutrophils and dendritic cells. Blood. 121, 1677-1689 (2013).
- Oehler, L., et al. Neutrophil granulocyte-committed cells can be driven to acquire dendritic cell characteristics. J. Exp. Med. 187, 1019-1028 (1998).
- Berton, G. Editorial: Gigantism: a new way to prolong neutrophil life. J. Leukoc. Biol. 96, 505-506 (2014).
- Milde, R., et al. Multinucleated Giant Cells Are Specialized for Complement-Mediated Phagocytosis and Large Target Destruction. Cell. Rep. 13, 1937-1948 (2015).
- Deretic, V., Saitoh, T., Akira, S. Autophagy in infection, inflammation and immunity. Nat. Rev. Immunol. 13, 722-737 (2013).

