Studie des endoplasmatischen Reticulum und Mitochondria Wechselwirkungen durch<em> In Situ</em> Nähe Ligatur Assay in fixierten Zellen
Summary
Hier beschreiben wir ein Verfahren zur Visualisierung und mit hoher Empfindlichkeit die endogenen Wechselwirkungen zwischen dem endoplasmatischen Retikulum und Mitochondrien in fixierten Zellen zu quantifizieren. Das Protokoll verfügt über eine optimierte In – situ – Proximity Ligation Assay Inositol – 1,4,5-triphosphat Rezeptor / Glucose-regulierte Protein 75 / spannungsabhängige Anionenkanals / Cyclophilin D – Komplex an der Mitochondrien-assoziierte Membran Schnittstelle Targeting.
Abstract
Structural interactions between the endoplasmic reticular (ER) and mitochondrial membranes, in domains known as mitochondria-associated membranes (MAM), are crucial hubs for cellular signaling and cell fate. Particularly, these inter-organelle contact sites allow the transfer of calcium from the ER to mitochondria through the voltage-dependent anion channel (VDAC)/glucose-regulated protein 75 (GRP75)/inositol 1,4,5-triphosphate receptor (IP3R) calcium channeling complex. While this subcellular compartment is under intense investigation in both physiological and pathological conditions, no simple and sensitive method exists to quantify the endogenous amount of ER-mitochondria contact in cells. Similarly, MAMs are highly dynamic structures, and there is no suitable approach to follow modifications of ER-mitochondria interactions without protein overexpression. Here, we report an optimized protocol based on the use of an in situ proximity ligation assay to visualize and quantify endogenous ER-mitochondria interactions in fixed cells by using the close proximity between proteins of the outer mitochondrial membrane (VDAC1) and of the ER membrane (IP3R1) at the MAM interface. Similar in situ proximity ligation experiments can also be performed with the GRP75/IP3R1 and cyclophilin D/IP3R1 pairs of antibodies. This assay provides several advantages over other imaging procedures, as it is highly specific, sensitive, and suitable to multiple-condition testing. Therefore, the use of this in situ proximity ligation assay should be helpful to better understand the physiological regulations of ER-mitochondria interactions, as well as their role in pathological contexts.
Introduction
Mitochondrien und endoplasmatisches Retikulum (ER) nicht unabhängig sind Organellen in der Zelle, aber sie interagieren strukturell und funktionell an Kontaktstellen definiert als Mitochondrien-assoziierte endoplasmatischen Retikulum Membranen (MAM). Tatsächlich entsprechen MAMs zu Regionen, in denen die Membranen des ER und Mitochondrien eng angelagert werden, so dass Wechselwirkungen zwischen Proteinen von beiden Seiten. Dennoch verschmelzen die Membranen dieser Organellen nicht innerhalb dieser Regionen, so behalten sie ihre separate Einheiten. Die MAMs spielen eine entscheidende Rolle bei der Calcium (Ca 2+) und Phospholipid Transfer von ER zu den Mitochondrien, den Energiestoffwechsel und das Überleben der Zellen 1-3 zu beeinträchtigen.
Die Assoziation zwischen dem ER und Mitochondrien wurde zuerst in den 1970er Jahren mit der Elektronenmikroskopie sichtbar gemacht. Seitdem Transmissionselektronenmikroskopie 4,5, Elektronentomographie 6,7 oder Immuno-Lokalisierung von ER und Mitochondrien-spezifischen Fluorophores / fluoreszierende Proteine 8 wurden klassisch zu studieren ER-Mitochondrien – Wechselwirkungen. Ein weiteres nützliches Werkzeug für die Analyse von MAM auf der Verwendung von subzellulären Fraktionierung basiert. Es erlaubt die Isolierung von MAM Fraktionen durch Differential Ultrazentrifugation gekoppelt mit einem Percollgradienten 9. Allerdings enthält das Endprodukt angereichert MAM Fraktionen, anstatt reinen Fraktionen. Insgesamt sind diese Strategien nicht besonders empfindlich und / oder quantitative, und sie sind nicht leicht zugänglich für große Screening. Alternativ haben genetische Ansätze unter Verwendung von arzneimittel induzierbaren fluoreszierendes inter-Organell Linkern entstanden, aber sie haben nicht die Analyse von Organell Wechselwirkungen an den endogenen Expressionsniveaus von 10 Proteinen ermöglichen.
Basierend auf Szabadkai Entdeckung des IP3R / Grp75 / VDAC Komplex im MAM 11 entwickelten wir eine quantitative Methode ER-Mitochondrien – Interaktionen zu analysieren. Wir haben die in situ Nähe ligatiauf Assay Wechselwirkungen zwischen VDAC1 und IP3R1 zwei Organell-Oberflächenproteine im Ca 2+ -channeling Komplex an der Grenzfläche MAM in fixierten Zellen 12 beteiligt zu detektieren und zu quantifizieren. Kurz gesagt, sondiert wir VDAC1 an der äußeren mitochondrialen Membran (Maus – anti-VDAC1 primärer Antikörper) und IP3R1 an der ER – Membran (Kaninchen – anti-IP3R1 primärer Antikörper) (Abbildung 1, Tafel A). Dann wird gemäß dem Test haben wir sowohl anti-Maus- und anti-Kaninchen-IgG (Maus und Kaninchen Proximity Ligation Assay-Sonden), die an komplementäre Oligonukleotid Erweiterungen konjugiert sind. Wenn die beiden Proteine gezielt in einem Abstand von weniger als 40 nm sind, können die Oligonukleotide mit den anschließend zugegeben Verbinder Oligos hybridisieren die Bildung einer kreisförmigen DNA – Templat (1, Feld B) zu ermöglichen. Diese kreisförmige DNA – Molekül ligiert und amplifiziert, eine einzelsträngige DNA – Produkt kovalent an einer der Näherungssensoren zu schaffen (Abbildung 1, Tafel c) </strong>. Da der Abstand zwischen dem ER und Mitochondrien im MAM – Schnittstelle im Bereich von 10 nm bis 25 nm 6, Proximity Ligation und Amplifikation kann durchgeführt werden, aufgrund der Hybridisierung von Texasrot-markierten Oligonukleotidsonden zum anschließenden Nachweis führen (Abbildung 1, Tafel d ). Jeder fluoreszierenden Punkt repräsentiert Wechselwirkungen zwischen VDAC1 / IP3R1, so dass die Quantifizierung der di – situ – ER-Mitochondrien – Wechselwirkungen in einzelnen Zellen.
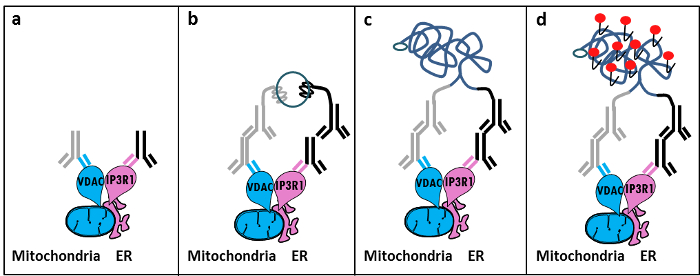
Abbildung 1: Schematische Darstellung der Detektion von endoplasmatischen Retikulum-Mitochondrien Wechselwirkungen von In Situ Proximity Ligation Assay. a) Antikörpers Eine Maus primären gegen VDAC1 und ein Kaninchen primären Antikörper gerichtet gegen IP3R1 an ihre Epitope in der Nähe an der Schnittstelle MAM binden kann, b) die Zugabe eines Paares von Annäherungs Ligierung Sondengegen Maus und Kaninchen-IgG. Diese Sonden wurden DNA-Stränge befestigt, die Vorlagen für die Unterbindung des Steckers Oligos bilden können. c) Die kreisförmige DNA – Strang nach Ligatur gebildet wird, kann verstärkt und d) durch Mikroskopie als fluoreszierender Punkt unter Verwendung Texas rot-markierten Oligonukleotiden sichtbar gemacht werden. Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.
Ähnliche in situ Proximity Ligation Assay Experimente können mit dem Grp75 / IP3R1 Paar von Antikörpern sowie Cyclophilin D (CypD) / IP3R1 Antikörper durchgeführt werden, wenn man bedenkt , dass CypD wurde an der MAM Schnittstelle mit dem IP3R / Grp75 / VDAC – Komplex interagieren gezeigt 14.12.
Protocol
Representative Results
Discussion
Collectively, our studies indicate that the in situ proximity ligation assay is truly a relevant strategy to follow and quantify endogenous ER-mitochondria interactions in fixed cells, without the need for using organelle-specific fluorophores or fluorescent proteins. The specific use of VDAC1/IP3R1 antibodies has been adapted to study ER-mitochondria interactions in HuH7 cells. However, alternative isoforms of VDAC and IP3R may be used, depending on the cell type. In this case, antibodies need to be validated b…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
Wir danken allen Menschen in unserem Labor, die das Protokoll beigetragen zu optimieren und zu validieren. Diese Arbeit wurde von INSERM und der nationalen Forschungsagentur (ANR-09-JCJC-0116 UND ANR-11-BSV1-033-02) unterstützt. ET wurde während ihrer Promotion durch ein Forschungsstipendium aus dem Französisch Ministerium für Hochschulbildung und Forschung unterstützt.
Materials
| Formaldehyde | Sigma | F-8775 | |
| Glycine | Sigma | G-8898 | |
| Triton | Sigma | T8532 | |
| 35mm Glass bottom culture dishes | MatTeK corporation | P35G-0-14-C | |
| Blocking solution | Sigma | DUO-92004 or DUO-92002 | provided in the Duolink PLA probes, Sigma |
| VDAC1 antibody | Abcam | ab14734 | |
| IP3R1-H80 antibody | Santa Cruz | sc28614 | |
| CypD antibody | Abcam | ab110324 | |
| Grp75 antibody | Santa Cruz | sc13967 | |
| TBS 10X | euromedex | ET220 | Dilute to obtain 1X |
| Tween 100X | euromedex | 2001-B | dilute in TBS to obtain 0,01% |
| PLA Probes Mouse MINUS | Sigma | DUO-92004 | Duolink, Sigma |
| PLA Probes Rabbit PLUS | Sigma | DUO-92002 | Duolink, Sigma |
| Duolink detection reagents red | Sigma | DUO-92008 | Duolink, Sigma |
| Ligation solution | Sigma | DUO-92008 | Part of the Duolink detection reagents red, Sigma |
| Ligase | Sigma | DUO-92008 | Part of the Duolink detection reagents red, Sigma |
| Amplification solution | Sigma | DUO-92008 | Part of the Duolink detection reagents red, Sigma |
| Polymerase | Sigma | DUO-92008 | Part of the Duolink detection reagents red, Sigma |
| Duolink Mounting Medium | Sigma | DUO80102 | Duolink, Sigma |
| Softwares: | |||
| Blob-finder software | BlobFinder is a freely distributed software that can perform calculations on cells from fluorescence microscopy images. This software can be downloaded for free from The Centre for Image Analysis at Uppsala University who have developed the software and the work was supported by the EU FP6 Project ENLIGHT and Olink Bioscience. http://www.cb.uu.se/~amin/BlobFinder/index_files/Page430.htm | ||
| ImageJ software | Can be downloaded for free from: http://rsb.info.nih.gov/ij/download.html |
Riferimenti
- Bravo-Sagua, R., et al. Organelle communication: signaling crossroads between homeostasis and disease. The international journal of biochemistry & cell biology. 50, 55-59 (2014).
- Giorgi, C., et al. Mitochondria-associated membranes: composition, molecular mechanisms, and physiopathological implications. Antioxidants & redox signaling. 22, 995-1019 (2015).
- Phillips, M. J., Voeltz, G. K. Structure and function of ER membrane contact sites with other organelles. Nature reviews. Molecular cell biology. 17, 69-82 (2016).
- Cosson, P., et al. The RTM resistance to potyviruses in Arabidopsis thaliana: natural variation of the RTM genes and evidence for the implication of additional genes. PLoS One. 7, 39169 (2012).
- Mannella, C. A. Structure and dynamics of the mitochondrial inner membrane cristae. Biochim Biophys Acta. 1763, 542-548 (2006).
- Csordas, G., et al. Structural and functional features and significance of the physical linkage between ER and mitochondria. The Journal of cell biology. 174, 915-921 (2006).
- Mannella, C. A., Buttle, K., Rath, B. K., Marko, M. Electron microscopic tomography of rat-liver mitochondria and their interaction with the endoplasmic reticulum. Biofactors. 8, 225-228 (1998).
- Rizzuto, R., et al. Close contacts with the endoplasmic reticulum as determinants of mitochondrial Ca2+ responses. Science. 280, 1763-1766 (1998).
- Wieckowski, M. R., Giorgi, C., Lebiedzinska, M., Duszynski, J., Pinton, P. Isolation of mitochondria-associated membranes and mitochondria from animal tissues and cells. Nat Protoc. 4, 1582-1590 (2009).
- Csordas, G., et al. Imaging interorganelle contacts and local calcium dynamics at the ER-mitochondrial interface. Mol Cell. 39, 121-132 (2010).
- Szabadkai, G., et al. Chaperone-mediated coupling of endoplasmic reticulum and mitochondrial Ca2+ channels. J Cell Biol. 175, 901-911 (2006).
- Tubbs, E., et al. Mitochondria-associated endoplasmic reticulum membrane (MAM) integrity is required for insulin signaling and is implicated in hepatic insulin resistance. Diabetes. 63, 3279-3294 (2014).
- Paillard, M., et al. Depressing Mitochondria-Reticulum Interactions Protects Cardiomyocytes From Lethal Hypoxia-Reoxygenation Injury. Circulation. 128, 1555-1565 (2013).
- Rieusset, J., et al. Disruption of calcium transfer from ER to mitochondria links alterations of mitochondria-associated ER membrane integrity to hepatic insulin resistance. Diabetologia. 59, 614-623 (2016).
- Allalou, A., Wahlby, C. BlobFinder, a tool for fluorescence microscopy image cytometry. Computer methods and programs in biomedicine. 94, 58-65 (2009).
- Theurey, P., et al. Mitochondria-associated endoplasmic reticulum membranes allow adaptation of mitochondrial metabolism to glucose availability in the liver. Journal of molecular cell biology. , (2016).
- de Brito, O. M., Scorrano, L. Mitofusin 2 tethers endoplasmic reticulum to mitochondria. Nature. 456, 605-610 (2008).
- Soderberg, O., et al. Direct observation of individual endogenous protein complexes in situ by proximity ligation. Nature methods. 3, 995-1000 (2006).
- De Pinto, V., Messina, A., Lane, D. J., Lawen, A. Voltage-dependent anion-selective channel (VDAC) in the plasma membrane. FEBS letters. 584, 1793-1799 (2010).
- Kaul, S. C., Taira, K., Pereira-Smith, O. M., Wadhwa, R. Mortalin: present and prospective. Experimental gerontology. 37, 1157-1164 (2002).

