Inducerbart T7-RNA-polymeras-medierat multigenexpressionssystem, pMGX
Summary
Denna studie beskriver metoder för det T7-medierade samuttrycket av multipla gener från en enda plasmid i Escherichia coli med användning av pMGX-plasmidsystemet.
Abstract
Samuttryck av multipla proteiner är allt viktigare för syntetisk biologi, studier av protein-proteinkomplex och karaktärisering och utnyttjande av biosyntetiska vägar. I detta manuskript beskrivs användningen av ett högeffektivt system för konstruktion av multigene syntetiska operoner under kontroll av ett inducerbart T7-RNA-polymeras. Detta system medger att många gener kan uttryckas samtidigt från en plasmid. Här är en uppsättning av fyra besläktade vektorer, pMGX-A, pMGX-hisA, pMGX-K och pMGX-hisK, med antingen ampicillin eller kanamycinresistens-selekterbar markör (A och K) och som antingen har eller saknar en N-terminal hexahistidin Tagg (hans) beskrivs. Detaljerade protokoll för konstruktionen av syntetiska operoner som använder detta vektorsystem tillhandahålls tillsammans med motsvarande data, vilket visar att ett pMGX-baserat system innehållande fem gener lätt kan konstrueras och användas för att producera alla fem kodade proteiner i Escherichia coli . Denna systEm och protokoll gör det möjligt för forskare rutinmässigt att uttrycka komplexa multipomponentmoduler och vägar i E. coli .
Introduction
Samuttryck av multipla proteiner är allt viktigare, särskilt i syntetiska biologiska tillämpningar, där flera funktionella moduler måste uttryckas 1 ; Vid studier av protein-proteinkomplex, där uttryck och funktion ofta kräver samuttryck 2 , 3 ; Och att karakterisera och utnyttja biosyntetiska vägar, där varje gen i vägen måste uttryckas 4 , 5 , 6 , 7 , 8 . Ett antal system har utvecklats för samuttryck, särskilt i värdorganismen Escherichia coli , arbetshästen för rekombinant proteinuttryck 9 för laboratorier. Till exempel kan flera plasmider med olika selekterbara markörer användas för att uttrycka individuella proteiner med användning av en mängd olika ex Pressvektorer 10 , 11 . Enkla plasmidsystem för multipelt proteinuttryck har använt antingen multipla promotorer för att styra uttrycket av varje gen 10 , 12 ; Syntetiska operoner, där flera gener kodas på ett enda transkript 2 , 13 ; Eller i vissa fall en enda gen som kodar för en polypeptid som i slutändan behandlas proteolytiskt, vilket ger de önskade proteinerna av intresse 14 .
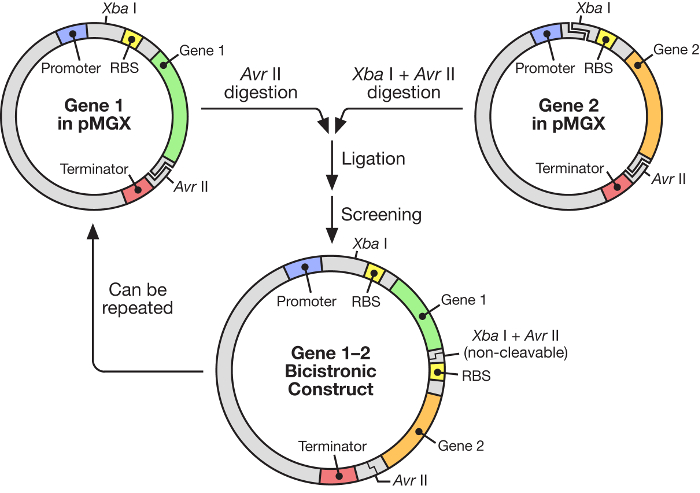
Figur 1: pMGX-arbetsflöde som visar konstruktionen av en polykistronisk vektor. PMGX-systemet ger en flexibel, lättanvänd strategi för konstruktion av syntetiska operoner under kontroll av en inducerbar T7-promotor.E.com/files/ftp_upload/55187/55187fig1large.jpg "target =" _ blank "> Vänligen klicka här för att se en större version av denna figur.
I detta manuskript beskrivs användningen av ett högeffektivt system för konstruktion av multigene syntetiska operoner under kontroll av ett inducerbart T7-RNA-polymeras ( Figur 1 ). Detta system medger att många gener kan uttryckas samtidigt från en plasmid. Det är baserat på ett plasmidsystem, ursprungligen kallat pKH22, som har använts framgångsrikt för ett antal olika applikationer 6 , 7 , 8 . Här expanderas denna plasmidsats för att innefatta fyra besläktade vektorer: pMGX-A, en expressionsvektor som saknar några C- eller N-terminala taggar och med ampicillinresistensmarkören; PMGX-hisA, en expressionsvektor som kodar för en N-terminal hexahistidintag och med ampicillinresistensmarkören; PMGX-K, en expressionsvektor lAckingera några C- eller N-terminala taggar och med kanamycinresistensmarkören; Och pMGX-hisK, en expressionsvektor som kodar för en N-terminal hexahistidintag och med kanamycinresistensmarkören. I denna studie demonstreras förfarandet för att alstra en polykistronisk vektor innehållande fem gener som använder pMGX-systemet, specifikt pMGX-A, tillsammans med den framgångsrika framställningen av varje enskilt protein i Escherichia coli .
Protocol
Representative Results
Discussion
Samuttryck av multipla gener är allt viktigare, särskilt vid karakterisering och rekonstituering av komplexa, multigena metaboliska vägar 3 , 4 , 5 . PMGX-systemet gör multigensamekspression i E. coli rutin 6 , 7 , 8 och tillgänglig för olika forskare. I denna studie visade sig fem proteiner av intresse att framställas …
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
Detta arbete stöddes av Kanada: s naturvetenskapliga och tekniska forskningsråd.
Materials
| Enzymes | |||
| Alkaline Phosphatase, Calf Intestinal (CIP) | New England Biolabs | M0290S | |
| AvrII | New England Biolabs | R0174S | |
| EcoRI | New England Biolabs | R0101S | |
| NdeI | New England Biolabs | R0111S | |
| XbaI | New England Biolabs | R0145S | |
| Herculase II Fusion DNA Polymerase | Agilent Technologies | 600677 | |
| T4 DNA Ligase | New England Biolabs | M0202S | |
| Name | Company | Catalog Number | Comments |
| Reagents | |||
| 1 kb DNA ladder | New England Biolabs | N3232L | |
| 4-20% Mini-PROTEAN TGX Stain-Free Protein Gels | Bio-Rad | 456-8095 | |
| 50 x TAE | Fisher Thermo Scientific | BP1332-4 | |
| Agar | Fisher Thermo Scientific | BP1423-500 | |
| Agarose | Fisher Thermo Scientific | BP160-500 | |
| Ampicilin | Sigma-Alrich | A9518-5G | |
| BL21 (DE3) chemically comeptent cells | Comeptent cell prepared in house | ||
| B-PER Bacterial Protein Extraction Reagent | Fisher Thermo Scientific | PI78243 | |
| dNTP mix | Agilent Technologies | Supplied with polymerase | |
| Gel Extraction Kit | Omega | D2500-02 | E.Z.N.A Gel Extraction, supplied by VWR Cat 3: CA101318-972 |
| Glycine | Fisher Thermo Scientific | BP381-1 | |
| His Tag Antibody [HRP], mAb, Mouse | GenScript | A00612 | |
| Immobilon Western Chemiluminescent HRP Substrate | EMD Millipore | WBKLS0100 | |
| IPTG | Sigma-Alrich | 15502-10G | |
| LB | Fisher Thermo Scientific | BP1426-500 | |
| Methanol | Fisher Thermo Scientific | A411-20 | |
| Pasteurized instant skim milk powder | Local grocery store | No-name grocery store milk is adequate | |
| Nitrocellulose membrane | Amersham Protran (GE Healthcare Life Sciences) | 10600007 | Membrane PT 0.45 µm 200 mm X 4 m, supplied by VWR Cat #: CA10061-086 |
| Plasmid DNA Isolation Kit | Omega | D6943-02 | E.Z.N.A Plasmid DNA MiniKit I, supplied by VWR Cat #: CA101318-898 |
| pMGX | Boddy Lab | Request from the Boddy Lab Contact cboddy@uottawa.ca | |
| Primers | Intergrated DNA Technologies | Design primers as needed for desired gene | |
| Synthetic Gene | Life Technologies | Design and optimize as needed | |
| Thick Blot Filter Paper | Bio-Rad | 1703932 | |
| Tris base | BioShop | TRS001.1 | |
| Tween-20 | Sigma-Alrich | P9416-50ML | |
| XL1-Blue chemically competent cells | Comeptent cell prepared in house | ||
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| BioSpectrometer | Eppendorf | RK-83600-07 | |
| Gel box – PAGE | Bio-Rad | 1658005 | Mini-PROTEIN Tetra Vertical Electrophoresis Cell |
| Gel Imager | Alpha Innotech | AlphaImager EC | |
| Incubator-oven | Fisher Thermo Scientific | 11-690-650D | Isotemp |
| Incubator-shaker | Fisher Thermo Scientific | SHKE6000-7 | MaxQ 6000 |
| Personna Razors | Fisher Thermo Scientific | S04615 | |
| Power Pack | Bio-Rad | S65533Q | FB300 |
| Transilluminator | VWR International | M-10E,6W | |
| Thermocylcer | Eppendorf | Z316091 | Mastercycler Personal, supplied by Sigma |
| UV Face-Shield | 18-999-4542 | ||
| Waterbath | Fisher Thermo Scientific | 15-460-2SQ | |
| Western Transfer Apparatus | Bio-Rad | 1703935 | Mini-Trans Blot Cell |
Riferimenti
- Purnick, P. E. M., Weiss, R. The second wave of synthetic biology: from modules to systems. Nat. Rev. Mol. Cell Biol. 10 (6), 410-422 (2009).
- Bieniossek, C., et al. Automated unrestricted multigene recombineering for multiprotein complex production. Nat. Methods. 6 (6), 447-450 (2009).
- Jochimsen, B., et al. Five phosphonate operon gene products as components of a multi-subunit complex of the carbon-phosphorus lyase pathway. Proc. Natl. Acad. Sci. USA. 108 (28), 11393-11398 (2011).
- Martin, V. J. J., Pitera, D. J., Withers, S. T., Newman, J. D., Keasling, J. D. Engineering a mevalonate pathway in Escherichia coli for production of terpenoids. Nat. Biotechnol. 21 (7), 796-802 (2003).
- Ajikumar, P. K., et al. Isoprenoid pathway optimization for Taxol precursor overproduction in Escherichia coli. Science. 330 (6000), 70-74 (2010).
- Boddy, C. N., Hotta, K., Tse, M. L., Watts, R. E., Khosla, C. Precursor-directed biosynthesis of epothilone in Escherichia coli. J. Am. Chem. Soc. 126 (24), 7436-7437 (2004).
- Lundgren, B. R., Boddy, C. N. Sialic acid and N-acyl sialic acid analog production by fermentation of metabolically and genetically engineered Escherichia coli. Org. Biomol. Chem. 5 (12), 1903-1909 (2007).
- Horsman, M. E., Lundgren, B. R., Boddy, C. N. N-Acetylneuraminic Acid Production in Escherichia coli Lacking N-Acetylglucosamine Catabolic Machinery. Chem. Eng. Commun. 203 (10), 1326-1335 (2016).
- Romier, C., et al. Co-expression of protein complexes in prokaryotic and eukaryotic hosts: experimental procedures, database tracking and case studies. Acta Crystallogr. D, Biol. Crystallogr. 62 (Pt 10), 1232-1242 (2006).
- Tolia, N. H., Joshua-Tor, L. Strategies for protein coexpression in Escherichia coli. Nat. Methods. 3 (1), 55-64 (2006).
- Chanda, P. K., Edris, W. A., Kennedy, J. D. A set of ligation-independent expression vectors for co-expression of proteins in Escherichia coli. Protein Expr. Purif. 47 (1), 217-224 (2006).
- Kim, K. -. J., et al. Two-promoter vector is highly efficient for overproduction of protein complexes. Protein Sci. 13 (6), 1698-1703 (2004).
- Tan, S., Kern, R. C., Selleck, W. The pST44 polycistronic expression system for producing protein complexes in Escherichia coli. Protein Expr. Purif. 40 (2), 385-395 (2005).
- Chen, X., Pham, E., Truong, K. TEV protease-facilitated stoichiometric delivery of multiple genes using a single expression vector. Protein Sci. 19 (12), 2379-2388 (2010).
- Lorenz, T. C. Polymerase chain reaction: basic protocol plus troubleshooting and optimization strategies. J. Vis. Exp. (63), e3998 (2012).
- Lee, P. Y., Costumbrado, J., Hsu, C. -. Y., Kim, Y. H. Agarose gel electrophoresis for the separation of DNA fragments. J. Vis. Exp. (62), (2012).
- Sukumaran, S. Concentration determination of nucleic acids and proteins using the micro-volume BioSpec-nano-spectrophotometer. J. Vis. Exp. (48), (2011).
- JoVE Science Education Database. Basic Methods in Cellular and Molecular Biology. Molecular Cloning. J. Vis. Exp Available from: https://www.jove.com/science-education/5074/molecular-cloning (2016)
- JoVE Science Education Database. Basic Methods in Cellular and Molecular Biology. The Western Blot. J. Vis. Exp Available from: https://www.jove.com/science-education/5065/the-western-blot (2016)
- Laible, M., Boonrod, K. Homemade site directed mutagenesis of whole plasmids. J. Vis. Exp. (27), (2009).

