Инкапсуляция клеток млекопитающих в альгинатных шариках с использованием простого перемешиваемого сосуда
Summary
В этом видео и рукописи описывается метод на основе эмульсии для инкапсуляции клеток млекопитающих в 0,5-10% альгинатных гранул, которые могут быть получены крупными партиями с использованием простого сосуда с мешалкой. Инкапсулированные клетки можно культивировать in vitro или трансплантировать для применения в клеточной терапии.
Abstract
Инкапсулирование клеток в альгинатных шариках использовалось для иммобилизованной клеточной культуры in vitro, а также для иммуноизоляции in vivo . Инкапсуляция островков поджелудочной железы широко изучалась как средство повышения выживаемости островков при аллогенных или ксеногенных трансплантатах. Альгинатная инкапсуляция обычно достигается путем экструзии сопел и внешнего гелеобразования. Используя этот метод, клеточные альгинатные капли, сформированные на кончике сопел, попадают в раствор, содержащий двухвалентные катионы, которые вызывают ионотропное гелеобразование альгината, когда они диффундируют в капли. Требование образования капель на наконечнике сопла ограничивает объемную пропускную способность и концентрацию альгината, которая может быть достигнута. В этом видео описывается масштабируемый метод эмульгирования для инкапсуляции клеток млекопитающих в 0,5-10% альгинат с выживаемостью клеток от 70 до 90%. В соответствии с этим альтернативным методом капли альгината, содержащие клетки и карбонат кальция, эмульгируют в минеральном масле,Пониженное снижением рН, приводящим к внутреннему высвобождению кальция и ионотропному альгинату. Текущий метод позволяет получать альгинатные гранулы в течение 20 мин после эмульгирования. Оборудование, необходимое для этапа инкапсуляции, состоит из простых сосудов с мешалкой, доступных для большинства лабораторий.
Introduction
Инкапсуляция клеток млекопитающих широко изучалась как средство защиты трансплантированных клеток от иммунного отторжения 1 или для обеспечения трехмерной поддержки иммобилизованной клеточной культуры 2 , 3 , 4 . Инкапсуляция поджелудочной железы в альгинатных шариках использовалась для лечения диабета у аллогенных 5 , 6 или ксеногенных 7 , 8 , 9 , 10 , 11 , 12 грызунов. Доклинические и клинические испытания инкапсулированной трансплантации трансплантата поджелудочной железы для лечения диабета 1 типа продолжаются 13 , 14 , 15 . Для применений трансплантации или более крупныхE in vitro иммобилизованных клеточных производств, обычно используются генераторы шариковых оснований. Как правило, смесь альгината и клеток прокачивается через сопло для образования капелек, которые попадают в перемешиваемый раствор, содержащий двухвалентные катионы, что приводит к внешнему гелеобразованию капель. Коаксиальный поток газа 16 , 17 , вибрация 18 сопел, электростатическое отталкивание 19 или вращающиеся провода 20 способствуют образованию капель на наконечнике сопла.
Основными недостатками традиционных генераторов шариков являются их ограниченная пропускная способность и ограниченный диапазон вязкости раствора, что приведет к адекватному формированию шарика 21 . При высоких расходах текучая среда, выходящая из сопла, распадается на капельки, меньшие диаметра сопла, уменьшая размерный контроль. Для увеличения пропускной способности можно использовать генераторы с несколькими соплами, ноРавномерное распределение потока между соплами и использование решений> 0,2 Pas проблематично 22 . Наконец, ожидается, что все устройства на основе сопел принесут некоторый ущерб островкам, так как диаметр используемых сопел составляет от 100 до 500 мкм, тогда как ~ 15% островков человека может быть больше 200 мкм 23 .
В этом видео мы описываем альтернативный метод инкапсуляции клеток млекопитающих путем образования капель на одном этапе эмульгирования вместо капли по капле. Поскольку производство шариков осуществляется в простой мешалке, этот метод подходит для небольших (~ 1 мл) и крупномасштабных (10 3 L диапазон) производства шариков с низкой стоимостью оборудования 24 . Этот метод позволяет получать шарики с высокой сферичностью с использованием широкого диапазона вязкостей альгината с короткими ( например, 20-минутными) временами получения шариков. Этот метод был первоначально разработан Poncelet et aл. 25 , 26 и используется для иммобилизации ДНК 27 , белков 28, включая инсулин 29 , и бактерий 30 . Недавно мы адаптировали эти методы к инкапсулированию клеток млекопитающих с использованием линий поджелудочной железы бета-клеток 31 , 32 и первичной ткани поджелудочной железы 32 .
Принцип метода заключается в создании эмульсии вода-в-масле, состоящей из капель альгината в минеральном масле, с последующим внутренним гелеобразованием альгинатных капель ( рис. 1 ). Сначала инкапсулянт ( например, клетки) диспергируют в растворе альгината, содержащем мелкозернистую кальциевую соль с низкой растворимостью при начальном рН процесса. Затем альгинатную смесь добавляют к перемешиваемой органической фазе для создания эмульсии, обычно в присутствииповерхностно-активное вещество. В случае инкапсуляции клеток млекопитающих компоненты, присутствующие в сыворотке, могут действовать как поверхностно-активные вещества. Затем рН снижают, чтобы солюбилизировать соль кальция, добавляя маслорастворимую кислоту, которая разделяется на водную фазу. Уксусная кислота с коэффициентом распределения минерального масла / воды <0,005 33 должна быть предварительно растворена в масле, затем добавлена в эмульсию, где она смешивается в масляной фазе и быстро перегоняется в водную фазу 34 . На рисунке 2 показаны химические реакции и диффузия, которые происходят во время стадии подкисления и внутреннего гелеобразования. Наконец, инкапсулированные клетки извлекают путем инверсии фазы, фазового разделения ускоряют путем центрифугирования, повторных этапов промывки и фильтрации. Затем эти этапы могут быть выполнены с помощью отбора проб из бусинок и клеток для анализа контроля качества, культуры клеток in vitro и / или трансплантации инкапсулированных клеток.
<p class = "jove_content" fo: keep-together.within-page = "1">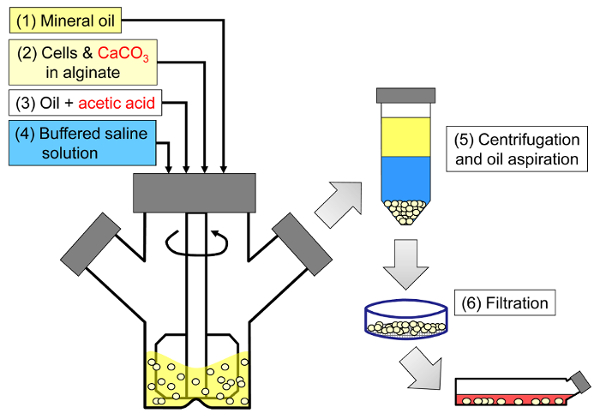
Рисунок 1: Схема процесса эмульгирования для инкапсулирования клеток млекопитающих. Бусины сначала получают путем эмульгирования смеси альгината, ячейки и СаСО 3 в минеральном масле (этапы 1 и 2 на схеме), инициируя внутреннее гелеобразование путем добавления уксусной кислоты (этап 3). Затем гелеобразные гранулы отделяют от масла путем добавления водного буфера для инициирования инверсии фазы (стадия 4) с последующим центрифугированием и масляной аспирированием (стадия 5), а затем фильтрацией (этап 6). Наконец, гранулы, собранные на фильтре, переносят в культуральную среду для культуры in vitro или для трансплантации. Нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
<imgAlt = "Рисунок 2" class = "xfigimg" src = "/ files / ftp_upload / 55280 / 55280fig2.jpg" />
Рисунок 2: Реакции и стадии диффузии, возникающие во время внутреннего гелеобразования. (1) Уксусную кислоту добавляют к органической фазе и транспортируют к капелькам альгината конвекцией. (2) Уксусная кислота переходит в водную фазу. (3) В присутствии воды кислота диссоциирует и диффундирует для достижения зерен СаСО 3, изображенных в темно-синем. (4) Ионы H + обмениваются с ионами Ca 2+ в CaCO 3 , высвобождая ионы Ca 2+ . (5) Ионы кальция диффундируют до тех пор, пока не столкнутся с непрореагировавшим альгинатом, что приведет к ионотропному сшиванию альгинатных цепей. Нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
В отличие от обычных сотовых инкапсуляторов на основе сопел широкое распределение размеров бусинок является expeИз-за механизма образования капель в перемешиваемой эмульсификации. Для подмножества приложений это распределение размера шарика может быть проблематичным. Например, большая часть клеток может быть выставлена на поверхности борта в меньших шариках. Если проблемы с питательными веществами ( например, кислородом) вызывают беспокойство, эти ограничения могут усугубляться в больших шариках. Преимущество метода перемешанной эмульгирования состоит в том, что средний размер шарика может быть легко отрегулирован путем изменения скорости перемешивания на стадии эмульгирования. Широкое распределение размера шарика можно также использовать для изучения влияния размера шарика на производительность инкапсулированных ячеек.
Инкапсуляция клеток млекопитающих путем эмульгирования и внутреннего гелеобразования является интересной альтернативой для лабораторий, которые не оснащены генератором шариков. Кроме того, этот метод дает пользователям возможность сократить время обработки или генерировать бусины с очень низкой или очень высокой концентрацией альгинатаations.
В приведенном ниже протоколе описывается, как инкапсулировать клетки в 10,5 мл 5% раствора альгината, полученного в буфере 10 мМ 4- (2-гидроксиэтил) -1-пиперазинэтансульфоновой кислоты (HEPES). Альгинат состоит из смеси 50:50 трансплантогенного LVM (содержание малнуроновой кислоты с низкой вязкостью) и альгината MVG (средняя вязкость с высоким содержанием гулуроновой кислоты). В качестве физического сшивающего агента используют карбонат кальция с конечной концентрацией 24 мМ. Легкое минеральное масло представляет собой органическую фазу, в то время как уксусная кислота используется для подкисления эмульсии и инициирования внутреннего гелеобразования. Однако тип и состав альгината, а также выбранный буфер процесса зависят от желаемого применения 32 . Для производства гранул с этим протоколом использовались различные типы альгинатов (см. Таблицу материалов).
Protocol
Representative Results
Discussion
Различные этапы (изображенные на фиг. 2 ) во время реакции внутреннего гелеобразования могут ограничивать общую кинетику. Было показано, что для зерен карбоната кальция, превышающих ~ 2,5 мкм, скорость растворения карбоната является ограничивающей скорость 26 ,…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
Мы благодарим Джил Осборн за ее наземную работу над процессом эмульгирования и Лорен Уилкинсон за техническую поддержку. Мы благодарим д-ра Игоря Лачика, доктора Тимоти Дж. Киффера и д-ра Джеймса Д. Джонсона за их вклад и сотрудничество. Мы благодарим Diabète Québec, JDRF, ThéCell, Центр исследований и исследований (CQMF), Научный совет по естественным наукам и инженерным исследованиям (NSERC), Центр трансплантации островных островков и регенерации бета-клеток, Канадскую сеть стволовых клеток, Фонд Майкла Смита по исследованиям в области здравоохранения, Le Fonds québécois de la recherche sur la nature et les technologies и COST 865 для финансовой поддержки.
Materials
| Reagents and consumables | |||
| LVM alginate (transplantation-grade) | Novamatrix | Non-applicable | Referred to as "alginate #1" in the results. |
| MVG alginate (transplantation-grade) | Novamatrix | Non-applicable | Referred to as "alginate #2" in the results. |
| Alginate (cell culture-grade) | Sigma | A0682 (low viscosity) or A2033 (medium viscosity) | A2033 is referred to as "alginate #3" in the results. |
| DMEM | Life Technologies | 11995-065 | |
| Fetal bovine serum, characterized, Canadian origin | Thermo Fisher Scientific | SH3039603 | |
| Glutamine | Life Technologies | 25030 | |
| Penicillin and streptomycin | Sigma | P4333-100ML | |
| HEPES, cell culture tested | Sigma | H4034-100G | |
| NaCl | Thermo Fisher Scientific | S271-1 | |
| Fine-grain CaCO3 | Avantor Materials | 1301-01 | After preparing the CaCO3 suspension, sonicate and use within one month. |
| Light mineral oil | Thermo Fisher Scientific | O121-4 | Sterile filter through a 0.22 μm pore size membrane prior to use. |
| Glacial acetic acid | Thermo Fisher Scientific | A38-500 | Handle with caution: refer to MSDS. |
| Sterile spatulas | Sigma | CLS3004-100EA | |
| Sterile nylon cell strainers, 40 µm | Thermo Fisher Scientific | 08-771-1 | |
| Serological pipettes (2 mL, 5 mL, 10 mL, 25 mL) | Sarstedt | 86.1252.001, 86.1253.001, 86.1254.001 and 86.1685.001 | |
| Pasteur pipettes | VWR | 14673-043 | |
| Toluidine Blue-O | Sigma | T3260 | |
| Equipment | |||
| 100 mL microcarrier spinner flasks | Bellco | 1965-00100 | The impeller configuration with recent models may not be suitable for adequate emulsification. A blade able to sweep the oil down to 0.5 cm from the bottom of the flask can be custom-made from a Teflon sheet. |
| Magnetic stir plate with adjustable speed | Bellco | 7760-06005 | The rotation speed should be calibrated (e.g. using a tachometer) prior to use. |
| Cell counter | Innovatis | Cedex AS20 | This system is now sold by Roche. This automated cell counter can also be replaced by manual cell enumeration after Trypan blue staining using a hemocytometer. |
| LED light box | Artograph | LightPad® PRO | This item can be replaced by other types of illuminators. |
| Handheld camera | Canon | PowerShot A590 IS | A variety of handheld cameras can be used to capture toluidine blue-o stained bead images. A ruler should be placed next to the Petri dish containing the beads prior to acquiring images. |
| Fluorescence microscope with phase contrast and adequate fluorescence filters | Olympus | IX81 | Several microscopy systems were used to image the beads. The results shown here were obtained with an IX81 microscope equipped with GFP and TRITC fluorescence filters. To capture entire beads, 4X to 20X objectives were used depending on the agitation rate. Live/dead staining images were typically captured with 20X to 40X objectives. |
| Image aquisition software | Molecular Devices | Metamorph | A variety of image acquisition software can be used to acquire phase contrast and fluorescence images. |
| Image analysis freeware | CellProfiler | Non-applicable | A variety of image analysis software can be used to identify beads as objects and analyze bead size (e.g. ImageJ). |
Riferimenti
- Scharp, D. W., Marchetti, P. Encapsulated islets for diabetes therapy: history, current progress, and critical issues requiring solution. Adv Drug Deliv Rev. 67-68, 35-73 (2014).
- Chayosumrit, M., Tuch, B., Sidhu, K. Alginate microcapsule for propagation and directed differentiation of hESCs to definitive endoderm. Biomaterials. 31 (3), 505-514 (2010).
- Sidhu, K., Kim, J., Chayosumrit, M., Dean, S., Sachdev, P. Alginate microcapsule as a 3D platform for propagation and differentiation of human embryonic stem cells (hESC) to different lineages. J Vis Exp. (61), (2012).
- Tostoes, R. M., et al. Perfusion of 3D encapsulated hepatocytes–a synergistic effect enhancing long-term functionality in bioreactors. Biotechnol Bioeng. 108 (1), 41-49 (2011).
- Duvivier-Kali, V. F., Omer, A., Parent, R. J., O’Neil, J. J., Weir, G. C. Complete protection of islets against allorejection and autoimmunity by a simple barium-alginate membrane. Diabetes. 50 (8), 1698-1705 (2001).
- Omer, A., et al. Long-term normoglycemia in rats receiving transplants with encapsulated islets. Transplantation. 79 (1), 52-58 (2005).
- Rayat, G. R., Rajotte, R. V., Ao, Z., Korbutt, G. S. Microencapsulation of neonatal porcine islets: protection from human antibody/complement-mediated cytolysis in vitro and long-term reversal of diabetes in nude mice. Transplantation. 69 (6), 1084-1090 (2000).
- Korbutt, G. S., Mallett, A. G., Ao, Z., Flashner, M., Rajotte, R. V. Improved survival of microencapsulated islets during in vitro culture and enhanced metabolic function following transplantation. Diabetologia. 47 (10), 1810-1818 (2004).
- Luca, G., et al. Improved function of rat islets upon co-microencapsulation with Sertoli’s cells in alginate/poly-L-ornithine. AAPS PharmSciTech. 2 (3), E15 (2001).
- Omer, A., et al. Survival and maturation of microencapsulated porcine neonatal pancreatic cell clusters transplanted into immunocompetent diabetic mice. Diabetes. 52 (1), 69-75 (2003).
- Schneider, S., et al. Long-term graft function of adult rat and human islets encapsulated in novel alginate-based microcapsules after transplantation in immunocompetent diabetic mice. Diabetes. 54 (3), 687-693 (2005).
- Cui, H., et al. Long-term metabolic control of autoimmune diabetes in spontaneously diabetic nonobese diabetic mice by nonvascularized microencapsulated adult porcine islets. Transplantation. 88 (2), 160-169 (2009).
- Krishnan, R., Alexander, M., Robles, L., Foster, C. E., Lakey, J. R. Islet and stem cell encapsulation for clinical transplantation. Rev Diabet Stud. 11 (1), 84-101 (2014).
- Robles, L., Storrs, R., Lamb, M., Alexander, M., Lakey, J. R. Current status of islet encapsulation. Cell Transplant. 23 (11), 1321-1348 (2014).
- Desai, T., Shea, L. D. Advances in islet encapsulation technologies. Nat Rev Drug Discov. , (2016).
- Anilkumar, A. V., Lacik, I., Wang, T. G. A novel reactor for making uniform capsules. Biotechnol Bioeng. 75 (5), 581-589 (2001).
- Wolters, G. H., Fritschy, W. M., Gerrits, D., van Schilfgaarde, R. A versatile alginate droplet generator applicable for microencapsulation of pancreatic islets. J Appl Biomater. 3 (4), 281-286 (1991).
- Heinzen, C., Marison, I., Berger, A., von Stockar, U. Use of vibration technology for jet break-up for encapsulation of cells, microbes and liquids in monodisperse microcapsules. Practical Aspects of Encapsulation Technologies. , 19-25 (2002).
- Poncelet, D., et al. A Parallel plate electrostatic droplet generator: Parameters affecting microbead size. Applied Microbiology and Biotechnology. 42 (2-3), 251-255 (1994).
- Prüße, U., Dalluhn, J., Breford, J., Vorlop, K. D. Production of Spherical Beads by JetCutting. Chemical Engineering & Technology. 23 (12), 1105-1110 (2000).
- Hoesli, C. A. . Bioprocess development for the cell-based treatment of diabetes (PhD thesis). , (2010).
- Brandenberger, H., Widmer, F. A new multinozzle encapsulation/immobilisation system to produce uniform beads of alginate. J Biotechnol. 63 (1), 73-80 (1998).
- Merani, S., Toso, C., Emamaullee, J., Shapiro, A. M. Optimal implantation site for pancreatic islet transplantation. Br J Surg. 95 (12), 1449-1461 (2008).
- Reis, C. P., Neufeld, R. J., Vilela, S., Ribeiro, A. J., Veiga, F. Review and current status of emulsion/dispersion technology using an internal gelation process for the design of alginate particles. J Microencapsul. 23 (3), 245-257 (2006).
- Poncelet, D., et al. Production of alginate beads by emulsification/internal gelation. I. Methodology. Appl Microbiol Biotechnol. 38 (1), 39-45 (1992).
- Poncelet, D., et al. Production of alginate beads by emulsification/internal gelation. II. Physicochemistry. Applied Microbiology and Biotechnology. 43 (4), 644-650 (1995).
- Alexakis, T., et al. Microencapsulation of DNA within alginate microspheres and crosslinked chitosan membranes for in vivo application. Appl Biochem Biotechnol. 50 (1), 93-106 (1995).
- Vandenberg, G. W., De La Noue, J. Evaluation of protein release from chitosan-alginate microcapsules produced using external or internal gelation. J Microencapsul. 18 (4), 433-441 (2001).
- Silva, C. M., Ribeiro, A. J., Figueiredo, I. V., Goncalves, A. R., Veiga, F. Alginate microspheres prepared by internal gelation: development and effect on insulin stability. Int J Pharm. 311 (1-2), 1-10 (2006).
- Larisch, B. C., Poncelet, D., Champagne, C. P., Neufeld, R. J. Microencapsulation of Lactococcus lactis subsp. cremoris. J Microencapsul. 11 (2), 189-195 (1994).
- Hoesli, C. A., et al. Reversal of diabetes by betaTC3 cells encapsulated in alginate beads generated by emulsion and internal gelation. J Biomed Mater Res B Appl Biomater. 100 (4), 1017-1028 (2012).
- Hoesli, C. A., et al. Pancreatic cell immobilization in alginate beads produced by emulsion and internal gelation. Biotechnol Bioeng. 108 (2), 424-434 (2011).
- Reinsel, M. A., Borkowski, J. J., Sears, J. T. Partition Coefficients for Acetic, Propionic, and Butyric Acids in a Crude Oil/Water System. Journal of Chemical & Engineering Data. 39 (3), 513-516 (1994).
- Xiu-Dong, L., Wei-Ting, Y., Jun-Zhang, L., Xiao-Jun, M., Quan, Y. Diffusion of acetic acid across oil/water interface in emulsification-internal gelation process for preparation of alginate gel beads. Chemical Research in Chinese Universities. 23 (5), 579-584 (2007).
- Fernandez, S. A., et al. Emulsion-based islet encapsulation: predicting and overcoming islet hypoxia. Bioencapsulation Innovations. (220), 14-15 (2014).
- Carpenter, A. E., et al. CellProfiler: image analysis software for identifying and quantifying cell phenotypes. Genome Biol. 7 (10), R100 (2006).
- Hinze, J. O. Fundamentals of the hydrodynamic mechanism of splitting in dispersion processes. AIChE Journal. 1 (3), 289-295 (1955).
- Kolmogorov, A. N. On the breakage of drops in a turbulent flow (translated from Russian). Doklady Akademii Nauk. 66, 825-828 (1949).
- Davies, J. T. Drop Sizes of Emulsions Related to Turbulent Energy-Dissipation Rates. Chemical Engineering Science. 40 (5), 839-842 (1985).
- Pacek, A. W., Chamsart, S., Nienow, A. W., Bakker, A. The influence of impeller type on mean drop size and drop size distribution in an agitated vessel. Chemical Engineering Science. 54 (19), 4211-4222 (1999).
- Steiner, H., et al. Numerical simulation and experimental study of emulsification in a narrow-gap homogenizer. Chemical Engineering Science. 61 (17), 5841-5855 (2006).
- Tcholakova, S., Denkov, N. D., Lips, A. Comparison of solid particles, globular proteins and surfactants as emulsifiers. Phys Chem Chem Phys. 10 (12), 1608-1627 (2008).
- Lagisetty, J. S., Das, P. K., Kumar, R., Gandhi, K. S. Breakage of viscous and non-Newtonian drops in stirred dispersions. Chemical Engineering Science. 41 (1), 65-72 (1986).
- Draget, K. I., Ostgaard, K., Smidsrod, O. Homogeneous Alginate Gels – a Technical Approach. Carbohydrate Polymers. 14 (2), 159-178 (1990).
- Poncelet, D., Dulieu, C., Jacquot, M., Wijffels, R. H. . Immobilized Cells. , 15-30 (2001).
- Islam, A. W., Zavvadi, A., Kabadi, V. N. Analysis of Partition Coefficients of Ternary Liquid-Liquid Equilibrium Systems and Finding Consistency Using Uniquac Model. Chemical and Process Engineering-Inzynieria Chemiczna I Procesowa. 33 (2), 243-253 (2012).
- Quong, D., Neufeld, R. J., Skjak-Braek, G., Poncelet, D. External versus internal source of calcium during the gelation of alginate beads for DNA encapsulation. Biotechnol Bioeng. 57 (4), 438-446 (1998).
- De Vos, P., De Haan, B. J., Van Schilfgaarde, R. Upscaling the production of microencapsulated pancreatic islets. Biomaterials. 18 (16), 1085-1090 (1997).
- Gross, J. D., Constantinidis, I., Sambanis, A. Modeling of encapsulated cell systems. J Theor Biol. 244 (3), 500-510 (2007).

