Encapsulación de células de mamífero en perlas de alginato usando un recipiente agitador simple
Summary
Este video y el manuscrito describen un método basado en emulsión para encapsular células de mamífero en perlas de alginato al 0,5% al 10% que se pueden producir en grandes lotes usando un simple recipiente agitado. Las células encapsuladas pueden cultivarse in vitro o trasplantarse para aplicaciones de terapia celular.
Abstract
La encapsulación celular en perlas de alginato se ha utilizado para cultivo celular inmovilizado in vitro así como para inmunoisolación in vivo . La encapsulación de islotes pancreáticos se ha estudiado extensamente como un medio para aumentar la supervivencia de los islotes en trasplantes alogénicos o xenogénicos. La encapsulación de alginato se alcanza comúnmente por extrusión de boquillas y gelificación externa. Usando este método, las gotitas de alginato que contienen células formadas en la punta de las boquillas caen en una solución que contiene cationes divalentes que causan gelación ionotrópica de alginato a medida que difunden en las gotitas. El requisito para la formación de gotitas en la punta de la boquilla limita el rendimiento volumétrico y la concentración de alginato que se pueden conseguir. Este video describe un método de emulsificación escalable para encapsular células de mamífero en alginato al 0,5% al 10% con una supervivencia celular del 70% al 90%. Mediante este método alternativo, las gotitas de alginato que contienen células y carbonato de calcio se emulsionan en aceite mineral, folPor una disminución del pH que conduce a la liberación interna de calcio ya la gelificación de alginato ionotrópico. El método actual permite la producción de perlas de alginato dentro de los 20 minutos de la emulsificación. El equipo requerido para la etapa de encapsulación consiste en recipientes agitados simples disponibles para la mayoría de los laboratorios.
Introduction
La encapsulación de células de mamífero se ha estudiado ampliamente como medio para proteger las células trasplantadas del rechazo inmune 1 o para proporcionar un soporte tridimensional para el cultivo celular inmovilizado 2 , 3 , 4 . El encapsulado de islotes pancreáticos en perlas de alginato se ha utilizado para revertir la diabetes en roedores alogénicos 5 , 6 o xenogénicos 7 , 8 , 9 , 10 , 11 , 12 . Los ensayos clínicos y preclínicos del trasplante de islotes pancreáticos encapsulados para tratar la diabetes tipo 1 están en curso 13 , 14 , 15 . Para aplicaciones de trasplante o de mayor escalaE la producción de células inmovilizadas in vitro , generalmente se utilizan generadores de perlas basados en boquillas. Típicamente, se bombea una mezcla de alginato y células a través de una boquilla para formar gotitas que caen en una solución agitada que contiene cationes divalentes, dando como resultado la gelificación externa de las gotitas. El flujo de gas coaxial 16 , 17 , la vibración de boquilla 18 , la repulsión electrostática 19 o los hilos giratorios 20 facilitan la formación de gotitas en la punta de la boquilla.
Los inconvenientes principales de los generadores de talón convencionales son su capacidad de producción limitada y el intervalo limitado de viscosidades en solución que darán lugar a una formación adecuada de talones 21 . A caudales elevados, el fluido que sale de la boquilla se rompe en gotitas más pequeñas que el diámetro de la boquilla, disminuyendo el control del tamaño. Se pueden utilizar generadores de bolas de boquillas múltiples para aumentar el rendimiento, peroLa distribución uniforme del flujo entre las toberas y el uso de soluciones> 0,2 Pas es problemático 22 . Por último, se espera que todos los dispositivos basados en boquillas impongan algún daño a los islotes, ya que el diámetro de las boquillas utilizadas está entre 100 μm y 500 μm, mientras que el ~ 15% de los islotes humanos puede ser mayor de 200 μm 23 .
En este video, describimos un método alternativo para encapsular células de mamífero formando gotitas en una única etapa de emulsificación en lugar de gota a gota. Dado que la producción de perlas se realiza en un recipiente de agitación simple, el método es adecuado para una producción pequeña (~ 1 ml) a gran escala (10 3 L) con costes de equipo reducidos 24 . Este método permite la producción de perlas con alta esfericidad usando una amplia gama de viscosidades de alginato con tiempos de generación cortos ( por ejemplo, 20 min). Este método fue desarrollado originalmente por Poncelet et aL 25 , 26 y se usan para inmovilizar el ADN 27 , las proteínas 28 incluyendo la insulina 29 y las bacterias 30 . Recientemente hemos adaptado estos métodos a la encapsulación de células de mamíferos utilizando líneas de células beta pancreáticas 31 , 32 y tejido pancreático primario 32 .
El principio del método es generar una emulsión agua-en-aceite que consiste en gotitas de alginato en aceite mineral, seguida de gelificación interna de las gotitas de alginato ( Figura 1 ). En primer lugar, el encapsulante ( por ejemplo, células) se dispersa en una solución de alginato que contiene una sal de calcio de grano fino con baja solubilidad al pH del proceso inicial. A continuación se añade la mezcla de alginato a una fase orgánica agitada para crear una emulsión, usualmente en presencia de unTensioactivo. En el caso de la encapsulación de células de mamífero, los componentes presentes en el suero pueden actuar como tensioactivos. A continuación, se reduce el pH con el fin de solubilizar la sal de calcio añadiendo un ácido soluble en aceite que divide en la fase acuosa. El ácido acético, con un coeficiente de reparto de aceite mineral / agua <0,005 33 , debe ser pre-disuelto en aceite, luego se agrega a la emulsión donde se mezcla en la fase oleosa y se divide rápidamente en la fase acuosa 34 . La Figura 2 ilustra las reacciones químicas y la difusión que tienen lugar durante la etapa de acidificación y gelificación interna. Finalmente, las células encapsuladas se recuperan mediante inversión de fase, separación de fases acelerada por centrifugación, etapas de lavado repetidas y filtración. Estos pasos pueden ser seguidos por muestreo de cuentas y células para análisis de control de calidad, cultivo celular in vitro y / o transplante de las células encapsuladas.
<p class = "jove_content" fo: keep-together.within-page = "1">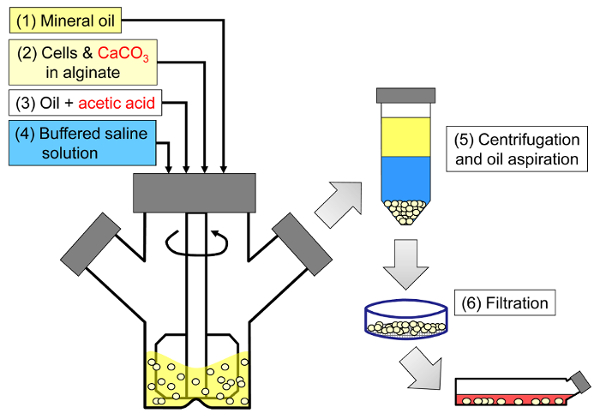
Figura 1: Esquema del proceso basado en emulsificación para encapsular células de mamífero. Las perlas se producen primero emulsionando un alginato, una célula y una mezcla de CaCO3 en aceite mineral (pasos 1 y 2 en el esquema), desencadenando la gelificación interna añadiendo ácido acético (paso 3). Las perlas gelificadas se separan después del aceite mediante la adición de un tampón acuoso para activar la inversión de fase (etapa 4), seguido de centrifugación y aspiración de aceite (etapa 5), y después filtración (etapa 6). Finalmente, las perlas recogidas en el filtro se transfieren al medio de cultivo celular para cultivo in vitro o para trasplante. Haga clic aquí para ver una versión más grande de esta figura.
<imgAlt = "Figura 2" class = "xfigimg" src = "/ files / ftp_upload / 55280 / 55280fig2.jpg" />
Figura 2: Reacciones y etapas de difusión que ocurren durante la gelificación interna. (1) Se añade ácido acético a la fase orgánica y se transporta a las gotitas de alginato por convección. (2) El ácido acético se divide en la fase acuosa. (3) En presencia de agua, el ácido se disocia y difunde hasta alcanzar los granos de CaCO3 representados en azul oscuro. (4) Los iones H + se intercambian con los iones Ca 2+ en CaCO 3 , liberando iones Ca 2+ . (5) Los iones de calcio se difunden hasta que encuentran alginato sin reaccionar, dando lugar a la reticulación ionotrópica de las cadenas de alginato. Haga clic aquí para ver una versión más grande de esta figura.
Contrariamente a los encapsuladores convencionales de celdas basadas en boquillas, una amplia distribución de tamaño de cordón es expeCitado a partir de este proceso debido al mecanismo de formación de gotitas en emulsificación agitada. Para un subconjunto de aplicaciones, esta distribución de tamaño de talón puede ser problemática. Por ejemplo, una fracción mayor de células puede estar expuesta en la superficie del cordón en perlas más pequeñas. Si las limitaciones de nutrientes ( por ejemplo, oxígeno) son una preocupación, estas limitaciones pueden exacerbarse en cuentas más grandes. Una ventaja del método de emulsión agitado es que el tamaño medio del cordón se puede ajustar fácilmente cambiando la velocidad de agitación durante la etapa de emulsión. La amplia distribución del tamaño del cordón también puede explotarse para estudiar el efecto del tamaño del cordón sobre el rendimiento de las células encapsuladas.
La encapsulación de las células de los mamíferos por emulsificación y gelificación interna es una alternativa interesante para los laboratorios que no están equipados con un generador de bolas. Además, este método ofrece a los usuarios la opción de reducir el tiempo de procesamiento, o generar perlas a muy bajo o muy alto concentrado de alginatoAciones.
El protocolo descrito a continuación describe cómo encapsular células en 10,5 ml de solución de alginato al 5% preparada en tampón de ácido 4- (2-hidroxietil) -1-piperazinoetanosulfónico (HEPES) 10 mM. El alginato consiste en una mezcla 50:50 de LVM de grado de trasplante (contenido de ácido manurónico alto en baja viscosidad) y alginato MVG (contenido de ácido gulurónico alto contenido en viscosidad media). Se utiliza carbonato de calcio a una concentración final de 24 mM como agente reticulante físico. El aceite mineral ligero constituye la fase orgánica, mientras que el ácido acético se utiliza para acidificar la emulsión y desencadenar la gelificación interna. Sin embargo, el tipo y composición de alginato, así como el tampón de proceso seleccionado dependen de la aplicación deseada 32 . Se ha utilizado una variedad de tipos de alginato (véase Tabla de materiales) para producir perlas con este protocolo.
Protocol
Representative Results
Discussion
Varias etapas (representadas en la Figura 2 ) durante la reacción de gelificación interna pueden limitar la cinética global. Para los granos de carbonato cálcico mayores de ~ 2,5 μm, se ha demostrado que la velocidad de disolución del carbonato es limitante de la velocidad 26 , 44 . La etapa de acidificación que conduce a la liberación interna de calcio también ha demostrado ser la variable crítica del proceso q…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
Damos las gracias a Jill Osborne por su trabajo de puesta a tierra en el proceso de emulsificación y Lauren Wilkinson para el apoyo técnico. Agradecemos al Dr. Igor Laçik, al Dr. Timothy J. Kieffer y al Dr. James D. Johnson por su contribución y colaboración. Agradecemos a Diabète Québec, a la JDRF, a ThéCell, al Centro de Investigación en Ciencias Naturales e Ingeniería (CRSNG), al Centro para el Trasplante de Islotes Humanos y la Regeneración de Células Beta, la Red Canadiense de Células Madre, Fundación Michael Smith para la Investigación en Salud, el Fondo québécois de la investigación sobre la naturaleza y las tecnologías y COST 865 para apoyo financiero.
Materials
| Reagents and consumables | |||
| LVM alginate (transplantation-grade) | Novamatrix | Non-applicable | Referred to as "alginate #1" in the results. |
| MVG alginate (transplantation-grade) | Novamatrix | Non-applicable | Referred to as "alginate #2" in the results. |
| Alginate (cell culture-grade) | Sigma | A0682 (low viscosity) or A2033 (medium viscosity) | A2033 is referred to as "alginate #3" in the results. |
| DMEM | Life Technologies | 11995-065 | |
| Fetal bovine serum, characterized, Canadian origin | Thermo Fisher Scientific | SH3039603 | |
| Glutamine | Life Technologies | 25030 | |
| Penicillin and streptomycin | Sigma | P4333-100ML | |
| HEPES, cell culture tested | Sigma | H4034-100G | |
| NaCl | Thermo Fisher Scientific | S271-1 | |
| Fine-grain CaCO3 | Avantor Materials | 1301-01 | After preparing the CaCO3 suspension, sonicate and use within one month. |
| Light mineral oil | Thermo Fisher Scientific | O121-4 | Sterile filter through a 0.22 μm pore size membrane prior to use. |
| Glacial acetic acid | Thermo Fisher Scientific | A38-500 | Handle with caution: refer to MSDS. |
| Sterile spatulas | Sigma | CLS3004-100EA | |
| Sterile nylon cell strainers, 40 µm | Thermo Fisher Scientific | 08-771-1 | |
| Serological pipettes (2 mL, 5 mL, 10 mL, 25 mL) | Sarstedt | 86.1252.001, 86.1253.001, 86.1254.001 and 86.1685.001 | |
| Pasteur pipettes | VWR | 14673-043 | |
| Toluidine Blue-O | Sigma | T3260 | |
| Equipment | |||
| 100 mL microcarrier spinner flasks | Bellco | 1965-00100 | The impeller configuration with recent models may not be suitable for adequate emulsification. A blade able to sweep the oil down to 0.5 cm from the bottom of the flask can be custom-made from a Teflon sheet. |
| Magnetic stir plate with adjustable speed | Bellco | 7760-06005 | The rotation speed should be calibrated (e.g. using a tachometer) prior to use. |
| Cell counter | Innovatis | Cedex AS20 | This system is now sold by Roche. This automated cell counter can also be replaced by manual cell enumeration after Trypan blue staining using a hemocytometer. |
| LED light box | Artograph | LightPad® PRO | This item can be replaced by other types of illuminators. |
| Handheld camera | Canon | PowerShot A590 IS | A variety of handheld cameras can be used to capture toluidine blue-o stained bead images. A ruler should be placed next to the Petri dish containing the beads prior to acquiring images. |
| Fluorescence microscope with phase contrast and adequate fluorescence filters | Olympus | IX81 | Several microscopy systems were used to image the beads. The results shown here were obtained with an IX81 microscope equipped with GFP and TRITC fluorescence filters. To capture entire beads, 4X to 20X objectives were used depending on the agitation rate. Live/dead staining images were typically captured with 20X to 40X objectives. |
| Image aquisition software | Molecular Devices | Metamorph | A variety of image acquisition software can be used to acquire phase contrast and fluorescence images. |
| Image analysis freeware | CellProfiler | Non-applicable | A variety of image analysis software can be used to identify beads as objects and analyze bead size (e.g. ImageJ). |
Riferimenti
- Scharp, D. W., Marchetti, P. Encapsulated islets for diabetes therapy: history, current progress, and critical issues requiring solution. Adv Drug Deliv Rev. 67-68, 35-73 (2014).
- Chayosumrit, M., Tuch, B., Sidhu, K. Alginate microcapsule for propagation and directed differentiation of hESCs to definitive endoderm. Biomaterials. 31 (3), 505-514 (2010).
- Sidhu, K., Kim, J., Chayosumrit, M., Dean, S., Sachdev, P. Alginate microcapsule as a 3D platform for propagation and differentiation of human embryonic stem cells (hESC) to different lineages. J Vis Exp. (61), (2012).
- Tostoes, R. M., et al. Perfusion of 3D encapsulated hepatocytes–a synergistic effect enhancing long-term functionality in bioreactors. Biotechnol Bioeng. 108 (1), 41-49 (2011).
- Duvivier-Kali, V. F., Omer, A., Parent, R. J., O’Neil, J. J., Weir, G. C. Complete protection of islets against allorejection and autoimmunity by a simple barium-alginate membrane. Diabetes. 50 (8), 1698-1705 (2001).
- Omer, A., et al. Long-term normoglycemia in rats receiving transplants with encapsulated islets. Transplantation. 79 (1), 52-58 (2005).
- Rayat, G. R., Rajotte, R. V., Ao, Z., Korbutt, G. S. Microencapsulation of neonatal porcine islets: protection from human antibody/complement-mediated cytolysis in vitro and long-term reversal of diabetes in nude mice. Transplantation. 69 (6), 1084-1090 (2000).
- Korbutt, G. S., Mallett, A. G., Ao, Z., Flashner, M., Rajotte, R. V. Improved survival of microencapsulated islets during in vitro culture and enhanced metabolic function following transplantation. Diabetologia. 47 (10), 1810-1818 (2004).
- Luca, G., et al. Improved function of rat islets upon co-microencapsulation with Sertoli’s cells in alginate/poly-L-ornithine. AAPS PharmSciTech. 2 (3), E15 (2001).
- Omer, A., et al. Survival and maturation of microencapsulated porcine neonatal pancreatic cell clusters transplanted into immunocompetent diabetic mice. Diabetes. 52 (1), 69-75 (2003).
- Schneider, S., et al. Long-term graft function of adult rat and human islets encapsulated in novel alginate-based microcapsules after transplantation in immunocompetent diabetic mice. Diabetes. 54 (3), 687-693 (2005).
- Cui, H., et al. Long-term metabolic control of autoimmune diabetes in spontaneously diabetic nonobese diabetic mice by nonvascularized microencapsulated adult porcine islets. Transplantation. 88 (2), 160-169 (2009).
- Krishnan, R., Alexander, M., Robles, L., Foster, C. E., Lakey, J. R. Islet and stem cell encapsulation for clinical transplantation. Rev Diabet Stud. 11 (1), 84-101 (2014).
- Robles, L., Storrs, R., Lamb, M., Alexander, M., Lakey, J. R. Current status of islet encapsulation. Cell Transplant. 23 (11), 1321-1348 (2014).
- Desai, T., Shea, L. D. Advances in islet encapsulation technologies. Nat Rev Drug Discov. , (2016).
- Anilkumar, A. V., Lacik, I., Wang, T. G. A novel reactor for making uniform capsules. Biotechnol Bioeng. 75 (5), 581-589 (2001).
- Wolters, G. H., Fritschy, W. M., Gerrits, D., van Schilfgaarde, R. A versatile alginate droplet generator applicable for microencapsulation of pancreatic islets. J Appl Biomater. 3 (4), 281-286 (1991).
- Heinzen, C., Marison, I., Berger, A., von Stockar, U. Use of vibration technology for jet break-up for encapsulation of cells, microbes and liquids in monodisperse microcapsules. Practical Aspects of Encapsulation Technologies. , 19-25 (2002).
- Poncelet, D., et al. A Parallel plate electrostatic droplet generator: Parameters affecting microbead size. Applied Microbiology and Biotechnology. 42 (2-3), 251-255 (1994).
- Prüße, U., Dalluhn, J., Breford, J., Vorlop, K. D. Production of Spherical Beads by JetCutting. Chemical Engineering & Technology. 23 (12), 1105-1110 (2000).
- Hoesli, C. A. . Bioprocess development for the cell-based treatment of diabetes (PhD thesis). , (2010).
- Brandenberger, H., Widmer, F. A new multinozzle encapsulation/immobilisation system to produce uniform beads of alginate. J Biotechnol. 63 (1), 73-80 (1998).
- Merani, S., Toso, C., Emamaullee, J., Shapiro, A. M. Optimal implantation site for pancreatic islet transplantation. Br J Surg. 95 (12), 1449-1461 (2008).
- Reis, C. P., Neufeld, R. J., Vilela, S., Ribeiro, A. J., Veiga, F. Review and current status of emulsion/dispersion technology using an internal gelation process for the design of alginate particles. J Microencapsul. 23 (3), 245-257 (2006).
- Poncelet, D., et al. Production of alginate beads by emulsification/internal gelation. I. Methodology. Appl Microbiol Biotechnol. 38 (1), 39-45 (1992).
- Poncelet, D., et al. Production of alginate beads by emulsification/internal gelation. II. Physicochemistry. Applied Microbiology and Biotechnology. 43 (4), 644-650 (1995).
- Alexakis, T., et al. Microencapsulation of DNA within alginate microspheres and crosslinked chitosan membranes for in vivo application. Appl Biochem Biotechnol. 50 (1), 93-106 (1995).
- Vandenberg, G. W., De La Noue, J. Evaluation of protein release from chitosan-alginate microcapsules produced using external or internal gelation. J Microencapsul. 18 (4), 433-441 (2001).
- Silva, C. M., Ribeiro, A. J., Figueiredo, I. V., Goncalves, A. R., Veiga, F. Alginate microspheres prepared by internal gelation: development and effect on insulin stability. Int J Pharm. 311 (1-2), 1-10 (2006).
- Larisch, B. C., Poncelet, D., Champagne, C. P., Neufeld, R. J. Microencapsulation of Lactococcus lactis subsp. cremoris. J Microencapsul. 11 (2), 189-195 (1994).
- Hoesli, C. A., et al. Reversal of diabetes by betaTC3 cells encapsulated in alginate beads generated by emulsion and internal gelation. J Biomed Mater Res B Appl Biomater. 100 (4), 1017-1028 (2012).
- Hoesli, C. A., et al. Pancreatic cell immobilization in alginate beads produced by emulsion and internal gelation. Biotechnol Bioeng. 108 (2), 424-434 (2011).
- Reinsel, M. A., Borkowski, J. J., Sears, J. T. Partition Coefficients for Acetic, Propionic, and Butyric Acids in a Crude Oil/Water System. Journal of Chemical & Engineering Data. 39 (3), 513-516 (1994).
- Xiu-Dong, L., Wei-Ting, Y., Jun-Zhang, L., Xiao-Jun, M., Quan, Y. Diffusion of acetic acid across oil/water interface in emulsification-internal gelation process for preparation of alginate gel beads. Chemical Research in Chinese Universities. 23 (5), 579-584 (2007).
- Fernandez, S. A., et al. Emulsion-based islet encapsulation: predicting and overcoming islet hypoxia. Bioencapsulation Innovations. (220), 14-15 (2014).
- Carpenter, A. E., et al. CellProfiler: image analysis software for identifying and quantifying cell phenotypes. Genome Biol. 7 (10), R100 (2006).
- Hinze, J. O. Fundamentals of the hydrodynamic mechanism of splitting in dispersion processes. AIChE Journal. 1 (3), 289-295 (1955).
- Kolmogorov, A. N. On the breakage of drops in a turbulent flow (translated from Russian). Doklady Akademii Nauk. 66, 825-828 (1949).
- Davies, J. T. Drop Sizes of Emulsions Related to Turbulent Energy-Dissipation Rates. Chemical Engineering Science. 40 (5), 839-842 (1985).
- Pacek, A. W., Chamsart, S., Nienow, A. W., Bakker, A. The influence of impeller type on mean drop size and drop size distribution in an agitated vessel. Chemical Engineering Science. 54 (19), 4211-4222 (1999).
- Steiner, H., et al. Numerical simulation and experimental study of emulsification in a narrow-gap homogenizer. Chemical Engineering Science. 61 (17), 5841-5855 (2006).
- Tcholakova, S., Denkov, N. D., Lips, A. Comparison of solid particles, globular proteins and surfactants as emulsifiers. Phys Chem Chem Phys. 10 (12), 1608-1627 (2008).
- Lagisetty, J. S., Das, P. K., Kumar, R., Gandhi, K. S. Breakage of viscous and non-Newtonian drops in stirred dispersions. Chemical Engineering Science. 41 (1), 65-72 (1986).
- Draget, K. I., Ostgaard, K., Smidsrod, O. Homogeneous Alginate Gels – a Technical Approach. Carbohydrate Polymers. 14 (2), 159-178 (1990).
- Poncelet, D., Dulieu, C., Jacquot, M., Wijffels, R. H. . Immobilized Cells. , 15-30 (2001).
- Islam, A. W., Zavvadi, A., Kabadi, V. N. Analysis of Partition Coefficients of Ternary Liquid-Liquid Equilibrium Systems and Finding Consistency Using Uniquac Model. Chemical and Process Engineering-Inzynieria Chemiczna I Procesowa. 33 (2), 243-253 (2012).
- Quong, D., Neufeld, R. J., Skjak-Braek, G., Poncelet, D. External versus internal source of calcium during the gelation of alginate beads for DNA encapsulation. Biotechnol Bioeng. 57 (4), 438-446 (1998).
- De Vos, P., De Haan, B. J., Van Schilfgaarde, R. Upscaling the production of microencapsulated pancreatic islets. Biomaterials. 18 (16), 1085-1090 (1997).
- Gross, J. D., Constantinidis, I., Sambanis, A. Modeling of encapsulated cell systems. J Theor Biol. 244 (3), 500-510 (2007).

