Istituzione di un Bioreposito di base clinico
Summary
I tumori cutanei vengono spesso scartati dopo la chirurgia microscopica di Mohs. Qui viene descritto un protocollo che consente al personale di supporto clinico di elaborare e memorizzare in modo efficace campioni tumorali cutanei ( ad esempio, carcinoma delle cellule squamose, carcinoma delle cellule basali e melanoma) per applicazioni di laboratorio a valle senza interferire con le operazioni cliniche.
Abstract
L'incidenza del cancro della pelle ( es., Carcinoma delle cellule squamose , carcinoma delle cellule basali e melanoma) è in aumento negli ultimi anni. Si prevede che ci sarà una domanda parallela per campioni tumorali cutanei per studi di ricerca biomedica. La disponibilità dei tessuti, tuttavia, è limitata a causa del costo della creazione di un bioreposito e della mancanza di protocolli disponibili per ottenere campioni clinici che non interferiscono con le operazioni cliniche. È stato stabilito un protocollo per raccogliere e elaborare campioni tumorali cutanei e associati di sangue e saliva che hanno un impatto minimo sulle procedure cliniche di routine alla data di una chirurgia Mohs. I campioni tumorali vengono raccolti e trattati da pazienti sottoposti al primo strato di chirurgia Mohs per tumori maligni cutanei provenienti da biopsia da parte del histotechnologista Mohs. Il tessuto normale adiacente viene raccolto all'atto della chiusura chirurgica. Ulteriori campioni che possono essere raccolti sono sangue intero e tampone buccale. Utilizzando campioni di tessuti normalmente scartati, è stato generato un bioreposito che offre diversi vantaggi fondamentali basandosi sulla clinica rispetto all'ambiente di laboratorio. Questi includono una vasta gamma di campioni raccolti; L'accesso ai dischi identificati, inclusi i rapporti patologici; E, per il tipico donatore, l'accesso a campioni aggiuntivi durante le visite di follow-up.
Introduction
La ricerca sul cancro e sul biomarker si basa su una fornitura di campioni di tessuti umani di qualità e l'offerta limitata ha ostacolato la ricerca 1 , 2 . Molti studi dermatologici sono limitati dall'inadeguata offerta, qualità variabile e costi associati all'uso del tessuto umano. Il costo della creazione di una grande banca bio-dedicata è stato stimato di circa due milioni di dollari3 e questi costi collocano l'uso del tessuto umano fuori dalla portata di molti ricercatori. Inoltre, il processo di generazione e conservazione di campioni di ricerca pone il rischio di influenzare le operazioni cliniche e di ritardare la cura del paziente se non eseguita con attenzione. È stato stabilito un bioreposito a basso costo basato su una clinica che si concentra sui campioni di cancro della pelle seguendo le migliori pratiche raccomandate e la convalida dei campioni 4 , 5 , 6 .
<pQuesto protocollo è stato sviluppato in una clinica di dermatologia che svolge un grande volume di interventi chirurgici microscopici Mohs per rimuovere il carcinoma delle cellule squamose (SCC), il carcinoma delle cellule basali (BCC) e i tumori della pelle del melanoma. I donatori volontari possono essere reclutati da questa popolazione paziente. È importante stabilire il biorepositivo nel sito della raccolta per bloccare rapidamente tessuto e sangue da pazienti autorizzati senza ritardare il trattamento. Raccogliere campioni dalla stessa clinica minimizza le variazioni nelle tecniche di raccolta e minimizza le variazioni della qualità dei campioni, che possono essere problematiche per le applicazioni a valle 7 , 8 .L'obiettivo della tecnica di chirurgia microscopica di Mohs è assicurare che tutti i tessuti del cancro siano rimossi mantenendo il più possibile il tessuto sano possibile. La procedura prevede la progressiva rimozione di strati sottili di tessuto tumorale. Ogni livello successivo è il suoEsaminato tologicamente (dopo la criocuzione del tessuto tumorale e la colorazione H & E) da un dermatologo per determinare se è stato rimosso tutto il tessuto tumorale. L'esclusione e l'esame di strati successivi di tessuti vengono eseguiti mentre il paziente rimane nell'ufficio. Questa tecnica è considerata la migliore opzione di trattamento per SCC 9 . A questo punto, la ferita è chiusa e, per migliorare la guarigione e l'aspetto estetico, il tessuto normale adiacente (ANT) viene spesso eliminato. Così, questa procedura chirurgica per rimuovere un tumore è ideale per raccogliere tessuto istologicamente caratterizzato per studi futuri.
La procedura di aggiudicazione dell'appalto per ottenere il tessuto tumorale, i tessuti normali adiacenti, la saliva e i campioni di sangue è stata progettata per avere un impatto minimo sui compiti normali del personale ( Figura 1 ). Gli assistenti medici eseguono il sangue durante la preparazione del paziente per la procedura. Dopo la conclusione della procedura Mohs, la M Lo histotechnologo di OHS prepara ulteriori diapositive istologiche del campione e trasferisce il tessuto al bioreposito. I costi associati alla creazione del bioreposito includono l'acquisto di congelatori di crioconservazione, la creazione di un modesto spazio di laboratorio clinico e lo sviluppo di un programma di monitoraggio delle scorte.
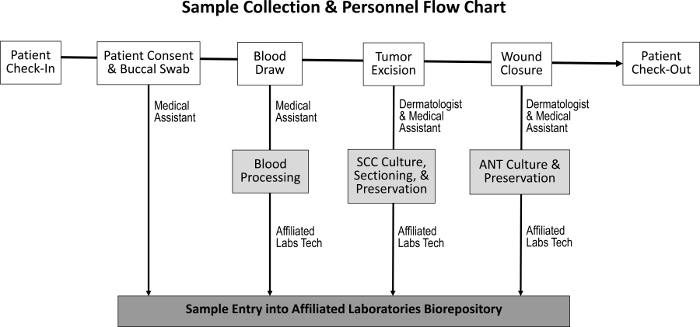
Figura 1: sequenza di raccolta dei campioni e personale responsabile. All'atto del check-in del paziente e del raggiungimento del consenso del paziente, l'assistente medico raccoglie un tampone bucale e svolge un prelievo di sangue. Il dermatologo e l'assistente medico poi accise il tumore e chiude la ferita, durante il quale vengono raccolti rispettivamente gli esemplari SCC e ANT. Un tecnico specializzato di laboratorio elabora il sangue e le sezioni dei campioni SCC e ANT per la coltura, la conservazione e l'ingresso nel bioreposito.Ftp_upload / 55583 / 55583fig1large.jpg "target =" _ blank "> Fare clic qui per visualizzare una versione più grande di questa figura.
La diversità dei campioni raccolti consente una varietà di approcci sperimentali ( Figura 2 ). I campioni raccolti dal paziente sono tamponi bucali (saliva può anche essere raccolta se necessario), sangue intero e tessuto esclasti. I tamponi bucali e un campione di tutto il sangue vengono salvati, senza elaborazione, per la genotipizzazione e il matching dei tessuti. Il sangue intero è separato in cellule del sangue bianco (WBC) e frazioni plasmatiche per analisi future. Dopo la trasformazione di Mohs, il tumore congelato viene posto direttamente in azoto liquido e trasferito a un congelatore -80 ° C. I campioni tumorali freschi, vitali e ANT vengono coltivati utilizzando modifiche delle tecniche precedenti 10 , 11 e poi criopreservate. Durante la raccolta, il numero di ciascun tipo di esempio viene registrato su un foglio di calcolo prima di entrare Il programma di monitoraggio dell'inventario per facilitare l'elaborazione accurata ( tabella 1 ).
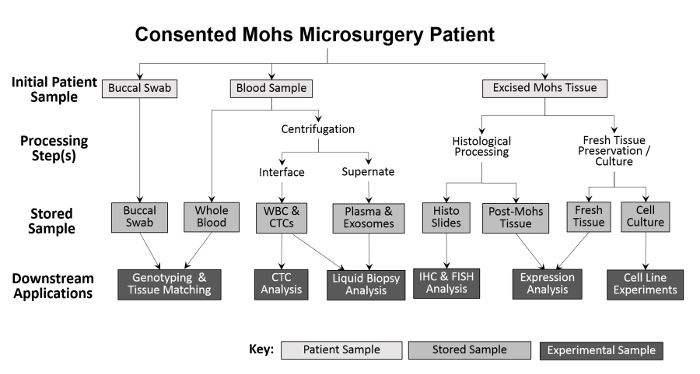
Figura 2: Struttura della raccolta e dell'elaborazione dei campioni biorepositivi basati su clinica. Un tampone e un campione di sangue buccale vengono raccolti dal paziente e memorizzati per il genotipizzazione a valle e la corrispondenza dei tessuti. Il sangue intero viene ulteriormente elaborato per l'isolamento delle cellule del sangue bianco (WBC) e l'analisi CTC, nonché per la raccolta del plasma e l'analisi biopsia liquida. Il tessuto prelevato durante la procedura Mohs è trattato istologicamente per scopi diagnostici, dopo di che le diapositive istologiche possono essere utilizzate sperimentalmente per ulteriori analisi immunohistochemiche. A condizione che il campione di tessuto ecceduto sia abbastanza grande, una porzione di tessuto fresco viene rimossa e tagliata per isolamento proteico e RNA e per la creazione di linee cellulari colte.55583 / 55583fig1large.jpg "target =" _ blank "> Fare clic qui per visualizzare una versione più grande di questa figura.
| Data di raccolta: | |||||
| Paziente 1 | Paziente 2 | Paziente 3 | Paziente 4 | Paziente 5 | |
| Iniziali e data di nascita | |||||
| Colore degli occhi | |||||
| Tipo di esempio | |||||
| Posizione campione | |||||
| Saliva | |||||
| WBuco sangue | |||||
| Plasma | |||||
| Tumore Viable | |||||
| Tessuto Normale Resistente | |||||
| Tumore Mohs Liquido Azoto | |||||
| Tessuto normale azoto liquido | |||||
| Slides |
Tabella 1: Lista di controllo per registrare le collezioni di campioni. I dati tracciati e registrati con ciascun campione raccolto comprendono le iniziali del paziente, la data di nascita e il colore degli occhi (per la tipizzazione della pelle), nonché i locatiSulla rimozione del campione. Il numero di campioni salivari, i volumi di raccolta del sangue e il numero di esemplari di tessuti vitali e conservati sono registrati anche come riferimenti per le allocazioni agli usi successivi. Clicca qui per scaricare questo file.
Per convalidare le procedure di raccolta dei campioni, ciascun tipo di esempio è stato testato nelle applicazioni a valle. Utilizzando modifiche delle tecniche precedenti 12 , il tumore e ANT sono stati utilizzati con successo nell'isolamento di proteine e RNA e possono essere utilizzati potenzialmente per l'isolamento del DNA. Le esplosioni vitali stabilite dalle sezioni del tessuto sono state valutate mediante microscopia, mentre le diapositive istologiche memorizzate sono state utilizzate per immunohistochemistry e immunofluorescenza.
Seguendo il protocollo qui descritto, è possibile estendere questo modello ad altre cliniche di dermatologia, altri tipi di tumore (come il melanoma), E altre specialità e pratiche chirurgiche per fornire campioni di tessuti umani per una ricerca multidimensionale nei tumori umani. Le modifiche leggere di questo protocollo sono probabilmente necessarie per altre pratiche, ma in linea di principio questo protocollo è applicabile a qualsiasi pratica chirurgica che scarta frequentemente i campioni dei pazienti raccolti durante il trattamento del paziente.
Protocol
Representative Results
Discussion
Alla conoscenza dell'autore, questo protocollo è il primo del suo genere che si concentra sull'approvazione clinica di campioni di tessuto cutaneo in un approccio economico e veloce. I pazienti sottoposti a microchirurgia di Mohs sono in genere pianificati durante specifici blocchi di tempo e la raccolta è limitata a questi periodi. La raccolta di campioni comporta l'impegno dell'assistente medico coinvolto nella cura del paziente, del histotechnolog Mohs che elabora i campioni tumorali e un membro del…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
Questo lavoro è stato sostenuto dai fondi del Midwestern University College of Health Sciences per la Facilitazione della Ricerca, concesso a EEH e all'Ufficio Midwestern Office of Research e ai Programmi Sponsorizzati Intramural Grant, assegnato a KJL. Ulteriori sostegno è stato fornito da Affiliated Laboratories e Dermatologia Affiliated. Ringraziamo Sarah Potekhen, Jamie Barto, Stefani Fawks, Cody Jording, Stacie Schimke, Heather Kissel e Ali Zaidi per la loro assistenza tecnica.
Materials
| BD Vacutainer Plastic Blood Collection Tubes with K3EDTA | ThermoFisher Scientific | 02-685-2B | |
| Electron Microscopy Sciences Double Edge Blades | ThermoFisher Scientific | 50-949-411 | |
| Curved Medium Point General Purpose Forceps | ThermoFisher Scientific | 16-100-110 | |
| Premium Microcentrifuge Tubes | ThermoFisher Scientific | 05-408-138 | |
| Lonza Walkersville KGM Keratinocyte Medium | ThermoFisher Scientific | NC9791321 | |
| Electron Microscopy Sciences Tissue TEK OCT Compound | ThermoFisher Scientific | 50-363-579 | |
| Leica CM1950 Cryostat | Leica Biosystems | 14047743909 | |
| Frosted Microscope Slides | ThermoFisher Scientific | 12-550-343 | |
| Shandon Rapid-Chrome H&E Frozen Section Staining Kit | ThermoFisher Scientific | 99-900-01 | |
| Nalgene Long-Term Storage Cryogenic Tubes | ThermoFisher Scientific | 03-337-7X | |
| Falcon 15 mL Conical Centrifuge Tubes | ThermoFisher Scientific | 14-959-53A | |
| Boca Scientific BuccalT-Swab | ThermoFisher Scientific | NC9679349 | |
| Cell Signaling Technology 10x RIPA Buffer | ThermoFisher Scientific | 50-195-822 | |
| Halt Protease and Phosphatase Inhibitor Cocktail | ThermoFisher Scientific | PI78443 | |
| Eppendorf 5424R Microcentrifuge | ThermoFisher Scientific | 05-401-203 | |
| Pellet Morter Cordless Homogenizer | ThermoFisher Scientific | 12-141-3 | |
| RNAse Free Pellet Pestle | ThermoFisher Scientific | 121-141-364 | |
| Forma SteriCycle CO2 Incubator | ThermoFisher Scientific | 13-998-089 | |
| HyClone Fetal Bovine Serum | ThermoFisher Scientific | SH30071.02 | |
| Gibco Advanced DMEM/F-12 | ThermoFisher Scientific | 12-634-028 | |
| Gibco Penicillin-Streptomycin | ThermoFisher Scientific | 15140148 | |
| Gibco 1M Hepes | ThermoFisher Scientific | 15-630-130 | |
| Nunc Cell Culture 35 mm with Vent | ThermoFisher Scientific | 1256591 | |
| Anti-CFH monoclonal antibody clone OX-24 | Abnova | MAB12583 | |
| Anti-p40 (p63 delta) antibody | Abnova | ABX-144A | |
| Anti MUC-1 antibody | Santa Cruz Biotech | sc-7313 | |
| Anti-Snail + Slug (phospho S246) | Abcam | Ab63568 | |
| Goat anti-rabbit IgG, Alexa Fluor 488 | Invitrogen | A-11034 | |
| Alexa Fluor 568 Phallodin | Molecular Probes | A12380 | |
| ProLong Gold Antifade Mountant with DAPI | Molecular Probes | P36941 | |
| Zeiss Axio Imager Z1 Microscope with Axiocam camera | Zeiss | 4300009901 | |
| Olympus IX51 phase contrast with DP72 camera | Olympus | IX511F3 |
Riferimenti
- Baker, M. Biorepositories: Building better biobanks. Nature. 486, 141-146 (2012).
- Ambrosone, C. B., Nesline, M. K., Davis, W. Establishing a cancer center data bank and biorepository for multidisciplinary research. Cancer Epidemiol Biomarkers Prev. 15, 1575-1577 (2006).
- Baird, P. M., Gunter, E. W., Vaught, J. Building a biobank. Biopreserv Biobank. 14, 87-88 (2016).
- Caixeiro, N. J., Lai, K., Lee, C. S. Quality assessment and preservation of RNA from biobank tissue specimens: a systematic review. J Clin Pathol. 69, 260-265 (2016).
- Campbell, L. D., et al. Development of the ISBER best practices for repositories: Collection, storage, retrieval and distribution of biological materials for research. Biopreserv Biobank. 10, 232-233 (2012).
- Neumeister, V. M. Tools to assess tissue quality. Clin Biochem. 47, 280-287 (2014).
- Vaught, J., et al. An NCI perspective on creating sustainable biospecimen resources. J Natl Cancer Inst Monogr. 2011, 1-7 (2011).
- Fu, T., Aasi, S. Z., Hollmig, S. T. Management of high-risk squamous cell carcinoma of the skin. Curr Treat Options Oncol. 17, (2016).
- Rasmussen, C., Thomas-Virnig, C., Allen-Hoffmann, B. L. Classical human epidermal keratinocyte cell culture. Methods Mol Biol. 945, 161-175 (2013).
- Purdie, K. J., Pourreyron, C., South, A. P. Cancer cell culture: Methods and protocols. , 151-159 (2011).
- Berglund, S. R., Schwietert, C. W., Jones, A. A., Stern, R. L., Lehman, J., Goldberg, Z. Optimized methodology for sequential extraction of RNA and protein from small human skin biopsies. J Invest Dermatol. 127, 349-353 (2007).
- Schroeder, A., et al. The RIN: an RNA integrity number for assigning integrity values to RNA measurements. BMC Mol Biol. 7, 1-14 (2006).
- Cooper, H. L., et al. Expression and glycosylation of MUC1 in epidermolysis bullosa-associated and sporadic cutaneous squamous cell carcinomas. Br J Dermatol. 151, 540-545 (2004).
- Riihila, P. M., et al. Complement factor H: a biomarker for progression of cutaneous squamous cell carcinoma. J Invest Dermatol. 134, 498-506 (2014).
- Ha Lan, T. T., et al. Expression of the p40 isoform of p63 has high specificity for cutaneous sarcomatoid squamous cell carcinoma. J Cutan Pathol. 41, 831-838 (2014).
- Alomari, A. K., Glusac, E. J., McNiff, J. M. p40 is a more specific marker than p63 for cutaneous poorly differentiated squamous cell carcinoma. J Cutan Pathol. 41, 839-845 (2014).
- Qiao, B., Johnson, N. W., Gao, J. Epithelial-mesenchymal transition in oral squamous cell carcinoma triggered by transforming growth factor-beta1 is Snail family-dependent and correlates with matrix metalloproteinase-2 and -9 expressions. Int J Oncol. 37, 663-668 (2010).
- Vaught, J. Developments in biospecimen research. Br Med Bull. 114, 29-38 (2015).

