クリニックベースのバイオリポジトリの設立
Summary
皮膚腫瘍は、しばしば、モース顕微鏡手術後に捨てられる。臨床支援スタッフが、臨床操作を妨害することなく、下流の実験室用途のための皮膚腫瘍( 例えば、扁平上皮細胞癌、基底細胞癌、および黒色腫)試料を効果的に処理および保存することを可能にするプロトコールがここに記載される。
Abstract
皮膚癌( 例えば、扁平上皮細胞癌、基底細胞癌および黒色腫)の発生率は、過去数年間にわたって増加している。生物医学研究研究のための皮膚腫瘍サンプルが並行して要求されることが期待される。しかしながら、組織の入手可能性は、バイオリポジトリを確立するコストと、臨床操作を妨害しない臨床サンプルを得るために利用可能なプロトコルがないために限定されている。モース外科手術の日にルーチンの臨床手順に最小限の影響を与える皮膚腫瘍および関連する血液および唾液サンプルを収集および処理するためのプロトコルが確立された。腫瘍試料は、モース組織工学者による生検で証明された皮膚悪性腫瘍のための第1層のモース手術を受けている患者から収集され、処理される。隣接する正常組織は、手術終了時に収集される。採取することができる追加のサンプルは、全血および口腔スワブ。通常は廃棄される組織サンプルを利用することにより、診療所と臨床検査室の設定に基づいていくつかの重要な利点を提供するバイオリポジトリが生成された。これらには、幅広い収集サンプルが含まれています。病理学的報告を含む、識別されていない患者記録へのアクセス;典型的なドナーの場合、フォローアップ訪問中の追加サンプルへのアクセス。
Introduction
がんやバイオマーカーの研究は質の高いヒトの組織サンプルの供給に依存しており、限られた供給は研究1,2を妨げている。多くの皮膚科学的研究は、供給不足、品質の変化、およびヒト組織の使用に関連するコストによって制限される。大規模な専用バイオバンクを構築するコストは約200万ドルと推定されており、これらのコストは人体組織の使用を多くの研究者の手の届かないところに置きます。さらに、研究サンプルを生成し保存するプロセスは、注意深く実行されなければ、臨床操作に影響を与え、患者のケアを遅らせるリスクをもたらす。推奨されるベストプラクティスとサンプルのバリデーション4,5,6に従って、皮膚癌サンプルに焦点を当てた費用効果の高いクリニックベースのバイオリポジトリが確立されました。
<pこのプロトコルは、扁平上皮癌(SCC)、基底細胞癌(BCC)およびメラノーマ皮膚癌を除去するために多量のモース顕微鏡手術を行う皮膚科診療所で開発されました。ボランティアドナーは、この患者集団から募集することができます。収集場所にバイオリポジトリを設置して、治療を遅らせることなく、同意された患者の組織や血液を迅速に採取することが重要です。同じ診療所から採取した検体を集めることは、採取技術のばらつきを最小限に抑え、検体の品質のばらつきを最小限に抑えます。これは、下流のアプリケーション7,8で問題になります。Mohs顕微鏡手術技術の目標は、可能な限り多くの健康な組織を保存しながら、すべての癌組織を確実に除去することです。この手順は、腫瘍組織の薄層の漸進的除去を含む。それぞれの連続する層は彼のものです皮膚科医によって(腫瘍組織を凍結切除し、H&E染色を行った後に)論理的に検査して、すべての癌組織が除去されたかどうかを決定する。患者がオフィスに留まる間、組織の次の層の切除および検査が実行される。この手法は、SCC 9の最良の治療選択肢と考えられています。この時点で、創傷は閉鎖され、治癒および美容的外観を改善するために、隣接する正常組織(ANT)が頻繁に摘出される。したがって、腫瘍を除去するためのこの外科的処置は、将来の研究のために組織学的に特徴付けられた組織を収集するのに理想的に適している。
腫瘍組織、隣接する正常組織、唾液、および血液サンプルを取得するための調達手順は、通常の職務に最小限の影響を及ぼすように設計されています( 図1 )。医療アシスタントは、手順のために患者を準備しながら血液採取を行う。 Mohs手順の完了後、Mオハイオ組織学者は標本の追加の組織スライドを準備し、その組織をバイオリポジトリに移す。バイオリポジトリの確立に関連するコストには、凍結保存フリーザの購入、適度な臨床検査スペースの作成、および在庫追跡プログラムの開発が含まれる。
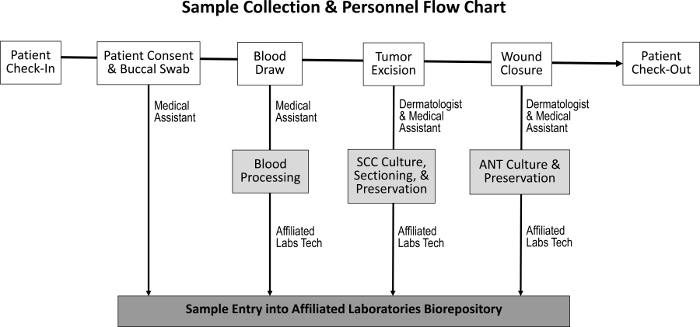
図1:サンプル収集と責任スタッフのシーケンス。患者のチェックインと患者の同意が得られると、医療アシスタントは頬の綿棒を採取して採血を行う。皮膚科医および医療補助員は、腫瘍を切除し、創傷を閉鎖し、その間SCCおよびANT標本をそれぞれ収集する。専用の実験技術者が血液を処理し、組織培養、保存、およびバイオリポジトリへの入室についてSCCおよびANT標本を区分する。ftp_upload / 55583 / 55583fig1large.jpg "target =" _ blank ">この図の拡大版を表示するには、ここをクリックしてください。
収集されたサンプルの多様性は、さまざまな実験的アプローチを可能にします( 図2 )。患者から採取した試料は、頬拭き(唾液も必要に応じて採取することができる)、全血、および切除組織である。口腔スワブおよび全血由来のサンプルは、遺伝子タイピングおよび組織適合のために、処理することなく保存される。将来の分析のために、全血を白血球(WBC)と血漿画分に分離する。モース処理後、凍結した腫瘍を液体窒素に直接入れ、-80℃の冷凍庫に移す。新鮮な生存可能な腫瘍組織およびANT試料を、以前の技術10,11の改変を用いて培養し、次いで凍結保存する。収集中、各サンプルタイプの数は、スプレッドシートに記録されてから正確な処理を容易にする在庫追跡プログラム( 表1 )。
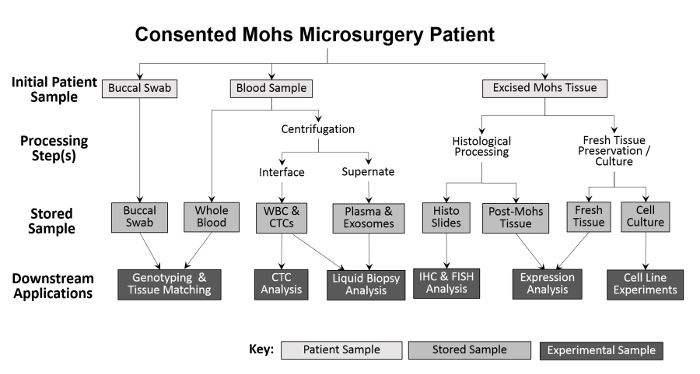
図2:臨床医ベースのバイオリポジトリのサンプル収集と処理の概要。頬側スワブおよび血液サンプルを患者から採取し、下流の遺伝子型決定および組織適合のために保存する。全血は、白血球(WBC)単離およびCTC分析ならびに血漿採取および液体生検分析のためにさらに処理される。 Mohs手順中に切除された組織は、診断目的のために組織学的に処理され、その後、組織学的スライドはさらなる免疫組織化学的分析のために実験的に使用され得る。切除された組織試料が十分に大きい場合、新鮮な組織の一部を取り出し、タンパク質およびRNAの単離および培養細胞系の確立のために切片化する。55583 / 55583fig1large.jpg "target =" _ blank ">この図の拡大版を見るには、ここをクリックしてください。
| コレクション日: | |||||
| 患者1 | 患者2 | 患者3 | 患者4 | 患者5 | |
| 頭文字と誕生日 | |||||
| 目の色 | |||||
| サンプルタイプ | |||||
| サンプルの場所 | |||||
| 唾液 | |||||
| W穴の血 | |||||
| プラズマ | |||||
| 腫瘍の生存率 | |||||
| 組織正常Viable | |||||
| 腫瘍モース液体窒素 | |||||
| 組織正常液体窒素 | |||||
| スライド |
表1:サンプルコレクションを記録するチェックリスト収集された各サンプルと共に追跡され、記録されたデータには、患者のイニシャル、生年月日、および肌の色のための目の色、試験片除去のオン。唾液サンプル数、採血量、および採取した生存および保存された組織標本の数も、後の使用のための参考文献として記録される。 このファイルをダウンロードするにはここをクリックしてください。
サンプル収集手順を検証するために、各サンプルタイプはダウンストリームアプリケーションでテストされています。以前の技術12の改変を用いて、腫瘍およびANTはタンパク質およびRNA単離に首尾よく用いられ、DNA単離のために潜在的に使用され得る。組織切片から確立された生存外植片を顕微鏡検査し、保存された組織スライドを免疫組織化学および免疫蛍光のために使用した。
本明細書に記載されたプロトコールに従って、このモデルを他の皮膚科診療所、他の腫瘍型(メラノーマなど)にまで拡張することが可能であり、、およびヒト癌への多面的研究のためのヒト組織サンプルを提供するための他の外科的専門性および実践を含む。このプロトコルのわずかな変更は、他のプラクティスにとって必要である可能性が高いが、原則として、このプロトコルは、患者治療の過程で収集された患者サンプルを日常的に廃棄する任意の外科手術に適用可能である。
Protocol
Representative Results
Discussion
著者らの知る限り、このプロトコールは、費用対効果と迅速なアプローチの両方で皮膚組織サンプルの臨床調達に焦点を当てた最初のものです。 Mohsマイクロサージャリーを受けている患者は、通常、特定の時間帯にスケジュールされ、収集はこれらの期間に限定されます。サンプル収集には、患者のケアに携わる医療補助員、腫瘍サンプルを処理するモース組織学者、サンプルの採取およ?…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
この研究は、中西部大学健康科学研究助成助成金、EEHに授与された資金、およびKJLに授与された中西部大学研究およびスポンサープログラムの教員補助プログラムの助成を受けて行われました。 Affiliated LaboratoriesおよびAffiliated Dermatologyが追加サポートを提供しました。彼らの技術的支援のためにSarah Potekhen、Jamie Barto、Stefani Fawks、Cody Jording、Stacie Schimke、Heather Kissel、Ali Zaidiに感謝します。
Materials
| BD Vacutainer Plastic Blood Collection Tubes with K3EDTA | ThermoFisher Scientific | 02-685-2B | |
| Electron Microscopy Sciences Double Edge Blades | ThermoFisher Scientific | 50-949-411 | |
| Curved Medium Point General Purpose Forceps | ThermoFisher Scientific | 16-100-110 | |
| Premium Microcentrifuge Tubes | ThermoFisher Scientific | 05-408-138 | |
| Lonza Walkersville KGM Keratinocyte Medium | ThermoFisher Scientific | NC9791321 | |
| Electron Microscopy Sciences Tissue TEK OCT Compound | ThermoFisher Scientific | 50-363-579 | |
| Leica CM1950 Cryostat | Leica Biosystems | 14047743909 | |
| Frosted Microscope Slides | ThermoFisher Scientific | 12-550-343 | |
| Shandon Rapid-Chrome H&E Frozen Section Staining Kit | ThermoFisher Scientific | 99-900-01 | |
| Nalgene Long-Term Storage Cryogenic Tubes | ThermoFisher Scientific | 03-337-7X | |
| Falcon 15 mL Conical Centrifuge Tubes | ThermoFisher Scientific | 14-959-53A | |
| Boca Scientific BuccalT-Swab | ThermoFisher Scientific | NC9679349 | |
| Cell Signaling Technology 10x RIPA Buffer | ThermoFisher Scientific | 50-195-822 | |
| Halt Protease and Phosphatase Inhibitor Cocktail | ThermoFisher Scientific | PI78443 | |
| Eppendorf 5424R Microcentrifuge | ThermoFisher Scientific | 05-401-203 | |
| Pellet Morter Cordless Homogenizer | ThermoFisher Scientific | 12-141-3 | |
| RNAse Free Pellet Pestle | ThermoFisher Scientific | 121-141-364 | |
| Forma SteriCycle CO2 Incubator | ThermoFisher Scientific | 13-998-089 | |
| HyClone Fetal Bovine Serum | ThermoFisher Scientific | SH30071.02 | |
| Gibco Advanced DMEM/F-12 | ThermoFisher Scientific | 12-634-028 | |
| Gibco Penicillin-Streptomycin | ThermoFisher Scientific | 15140148 | |
| Gibco 1M Hepes | ThermoFisher Scientific | 15-630-130 | |
| Nunc Cell Culture 35 mm with Vent | ThermoFisher Scientific | 1256591 | |
| Anti-CFH monoclonal antibody clone OX-24 | Abnova | MAB12583 | |
| Anti-p40 (p63 delta) antibody | Abnova | ABX-144A | |
| Anti MUC-1 antibody | Santa Cruz Biotech | sc-7313 | |
| Anti-Snail + Slug (phospho S246) | Abcam | Ab63568 | |
| Goat anti-rabbit IgG, Alexa Fluor 488 | Invitrogen | A-11034 | |
| Alexa Fluor 568 Phallodin | Molecular Probes | A12380 | |
| ProLong Gold Antifade Mountant with DAPI | Molecular Probes | P36941 | |
| Zeiss Axio Imager Z1 Microscope with Axiocam camera | Zeiss | 4300009901 | |
| Olympus IX51 phase contrast with DP72 camera | Olympus | IX511F3 |
Riferimenti
- Baker, M. Biorepositories: Building better biobanks. Nature. 486, 141-146 (2012).
- Ambrosone, C. B., Nesline, M. K., Davis, W. Establishing a cancer center data bank and biorepository for multidisciplinary research. Cancer Epidemiol Biomarkers Prev. 15, 1575-1577 (2006).
- Baird, P. M., Gunter, E. W., Vaught, J. Building a biobank. Biopreserv Biobank. 14, 87-88 (2016).
- Caixeiro, N. J., Lai, K., Lee, C. S. Quality assessment and preservation of RNA from biobank tissue specimens: a systematic review. J Clin Pathol. 69, 260-265 (2016).
- Campbell, L. D., et al. Development of the ISBER best practices for repositories: Collection, storage, retrieval and distribution of biological materials for research. Biopreserv Biobank. 10, 232-233 (2012).
- Neumeister, V. M. Tools to assess tissue quality. Clin Biochem. 47, 280-287 (2014).
- Vaught, J., et al. An NCI perspective on creating sustainable biospecimen resources. J Natl Cancer Inst Monogr. 2011, 1-7 (2011).
- Fu, T., Aasi, S. Z., Hollmig, S. T. Management of high-risk squamous cell carcinoma of the skin. Curr Treat Options Oncol. 17, (2016).
- Rasmussen, C., Thomas-Virnig, C., Allen-Hoffmann, B. L. Classical human epidermal keratinocyte cell culture. Methods Mol Biol. 945, 161-175 (2013).
- Purdie, K. J., Pourreyron, C., South, A. P. Cancer cell culture: Methods and protocols. , 151-159 (2011).
- Berglund, S. R., Schwietert, C. W., Jones, A. A., Stern, R. L., Lehman, J., Goldberg, Z. Optimized methodology for sequential extraction of RNA and protein from small human skin biopsies. J Invest Dermatol. 127, 349-353 (2007).
- Schroeder, A., et al. The RIN: an RNA integrity number for assigning integrity values to RNA measurements. BMC Mol Biol. 7, 1-14 (2006).
- Cooper, H. L., et al. Expression and glycosylation of MUC1 in epidermolysis bullosa-associated and sporadic cutaneous squamous cell carcinomas. Br J Dermatol. 151, 540-545 (2004).
- Riihila, P. M., et al. Complement factor H: a biomarker for progression of cutaneous squamous cell carcinoma. J Invest Dermatol. 134, 498-506 (2014).
- Ha Lan, T. T., et al. Expression of the p40 isoform of p63 has high specificity for cutaneous sarcomatoid squamous cell carcinoma. J Cutan Pathol. 41, 831-838 (2014).
- Alomari, A. K., Glusac, E. J., McNiff, J. M. p40 is a more specific marker than p63 for cutaneous poorly differentiated squamous cell carcinoma. J Cutan Pathol. 41, 839-845 (2014).
- Qiao, B., Johnson, N. W., Gao, J. Epithelial-mesenchymal transition in oral squamous cell carcinoma triggered by transforming growth factor-beta1 is Snail family-dependent and correlates with matrix metalloproteinase-2 and -9 expressions. Int J Oncol. 37, 663-668 (2010).
- Vaught, J. Developments in biospecimen research. Br Med Bull. 114, 29-38 (2015).

