Kliniğe Dayalı Biyorepositoryum Kurulması
Summary
Kutanöz tümörler genellikle Mohs mikrografik ameliyattan sonra atılır. Klinik destek personelinin klinik operasyonlara müdahale etmeden, aşağısındaki laboratuvar uygulamaları için kutanöz tümörün ( örn., Skuamöz hücreli karsinoma, bazal hücreli karsinoma ve melanom) örneklerini etkili bir şekilde işleyip saklayabilmesini sağlayan bir protokol açıklanmaktadır.
Abstract
Cilt kanseri insidansı (skuamöz hücreli karsinoma, bazal hücreli karsinom ve melanoma gibi) son birkaç yıldır artmaktadır. Biyomedikal araştırma çalışmaları için kutanöz tümör örnekleri için paralel bir talep olması bekleniyor. Bununla birlikte, klinik operasyonları etkilemeyen klinik örneklerin elde edilmesi için mevcut bir biyorepositoryasyonun sağlanması ve protokol eksikliğinden dolayı doku kullanılabilirliği sınırlıdır. Bir protokol, bir Mohs ameliyatı günü rutin klinik prosedürleri üzerinde en az etkili olan kutanöz tümör ve ilişkili kan ve tükürük numunelerini toplamak ve işlemek üzere oluşturulmuştur. Tümör örnekleri toplanır ve biyopside kanıtlanmış kutanöz habisler için ilk Mohs cerrahisi uygulanan hastalardan Mohs histotechnologist tarafından işlenir. Bitişik normal doku, cerrahi kapanma anında toplanır. Toplanan diğer numuneler tam kan ve böcek svaplarıdır. Normalde atılan doku örneklerini kullanarak, klinikte laboratuar ortamına göre ayarlanarak birkaç önemli avantaj sunan bir biyorepositoryum oluşturuldu. Bunlara, çok çeşitli toplanan numuneler dahildir; Patoloji raporları da dahil olmak üzere tanımlanmamış hasta kayıtlarına erişim; Ve tipik bağışta bulunanlar için, takip ziyaretleri sırasında ilave örneklere erişim.
Introduction
Kanser ve biyolojik belirteç araştırması, kaliteli insan dokusu örnekleri tedarikine dayanır ve sınırlı arz araştırmayı engelledi 1 , 2 . Pek çok dermatolojik çalışma, insan dokusunun kullanımı ile ilişkili yetersiz tedarik, değişken kalite ve maliyetlerle sınırlandırılmıştır. Büyük, özel bir biyobank kurma maliyetinin yaklaşık olarak 2 milyon dolar 3 olduğu tahmin edilmektedir ve bu maliyetler insan dokusunun kullanımını bir çok araştırmacıdan uzak tutmaktadır. Ayrıca, araştırma örnekleri üretme ve saklama süreci, klinik işlemleri etkileme ve dikkatli bir şekilde yürütülmemesine rağmen hasta bakımını erteleme riskini beraberinde getirir. Önerilen en iyi uygulamaları ve örnek validasyonunu takiben deri kanseri örneklerine odaklanan maliyet etkin, kliniğe dayalı bir biyorepositoryum oluşturulmuştur. 4 , 5 , 6 .
<pClass = "jove_content"> Bu protokol, skuamoz hücreli karsinomayı (SCC), bazal hücre karsinomasını (BCC) ve melanoma cilt kanserlerini çıkarmak için büyük miktarda Mohs mikrografi ameliyatı gerçekleştiren bir dermatoloji kliniğinde geliştirildi. Bu hasta popülasyonundan gönüllü bağışçılar işe alınabilir. Tedaviyi geciktirmeden muvaffakiyetli hastalardan doku ve kanları hızla yakalamak için toplanma sahasında biyorepositoryumun kurulması önemlidir. Aynı klinikteki örnekleri toplamak, toplama tekniklerindeki değişiklikleri en aza indirir ve numunelerin kalitesindeki farklılıkları en aza indirir ve bu da akışaşağı uygulamalar için sorun yaratabilir 7,8.Mohs mikrografik cerrahi tekniğinin amacı, tüm kanser dokularının mümkün olduğunca sağlıklı dokusu muhafaza ederken çıkartılmasını sağlamaktır. Prosedür, tümör dokusunun ince tabakalarının kademeli olarak çıkarılmasını içerir. Ardışık her katman onunTüm kanser dokusunun ortadan kaldırılıp kaldırılmadığını belirlemek için bir dermatolog tarafından tolojik olarak incelendi (tümör dokusunun kriyoteksiyonundan sonra ve H & E boyaması uygulandıktan sonra). Dokuların müteakip katmanlarının eksizyonu ve muayenesi, hasta ofiste kalırken yapılır. Bu teknik SCC 9 için en iyi tedavi seçeneği olarak kabul edilmektedir. Bu noktada, yara kapanır ve iyileşme ve kozmetik görünümü iyileştirmek için bitişik normal doku (ANT) sıklıkla eksize edilir. Bu nedenle, bir tümörü çıkarmak için bu cerrahi prosedür, gelecekteki çalışmalar için histolojik olarak karakterize edilmiş doku toplamak için ideal bir şekilde uygundur.
Tümör dokusunun, bitişik normal doku, tükürük ve kan numunelerinin elde edilmesi için tedarik prosedürü, normal personel görevleri üzerinde en az etkiye sahip olacak şekilde tasarlanmıştır ( Şekil 1 ). Tıbbi asistanlar, hastayı prosedüre hazırlarken kan çeker. Mohs prosedürünü tamamladıktan sonra, M Ohs histotechnologist, numunenin ek histolojik slaytlarını hazırlar ve dokuyu biorepositoryale aktarır. Biyorepositoryumun kurulmasıyla ilgili maliyetler kriyoprezervasyon dondurucularının satın alınması, mütevazı klinik laboratuar alanının oluşturulması ve bir envanter izleme programının geliştirilmesini içerir.
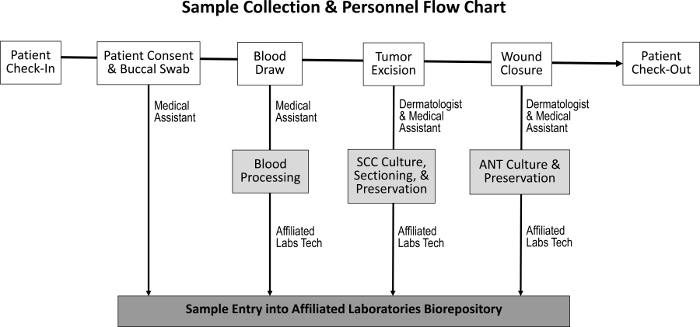
Şekil 1: Numune toplama ve sorumlu personel sırası. Hasta muayenesi ve hasta onayının alınması üzerine tıbbi yardımcısı bukkal bir sürüntü toplar ve kan çekişi yapar. Dermatolog ve tıbbi asistan daha sonra tümörü çıkarır ve yarayı kapatır, bu sırada sırasıyla SCC ve ANT numuneleri toplanır. Özel bir laboratuar teknisyeni kanı işler ve SCC ve ANT örneklerini doku kültürü, korunması ve biyorepositoryale girmesi için keser.Ftp_upload / 55583 / 55583fig1large.jpg "target =" _ blank "> Bu figürde daha büyük bir versiyon görmek için lütfen tıklayınız.
Toplanan numunelerin çeşitliliği, çeşitli deneysel yaklaşımlar sağlar ( Şekil 2 ). Hastadan toplanan numuneler bukkal svablar (gerekirse tükrük de toplanabilir), tam kan ve eksize edilen doku. Genetik ve doku eşleştirmesi için bukal svaplar ve tam kan örnekleri işlenmeksizin kaydedilir. Tam kan, gelecekteki analizler için beyaz kan hücresi (WBC) ve plazma fraksiyonlarına ayrılır. Mohs işlemesinden sonra, dondurulmuş tümör direkt olarak sıvı azota yerleştirilir ve -80 ° C'lik bir dondurucuya aktarılır. Taze, canlı tümör dokusu ve ANT numuneleri önceki tekniğin 10,11 tadilatları kullanılarak kültürlenir ve daha sonra dondurularak saklanır. Tahsilat sırasında, her numune tipinin numarası, girişe başlamadan önce bir elektronik tablo üzerine kaydedilir. Doğru işlemeyi kolaylaştırmak için envanter izleme programı ( Tablo 1 ).
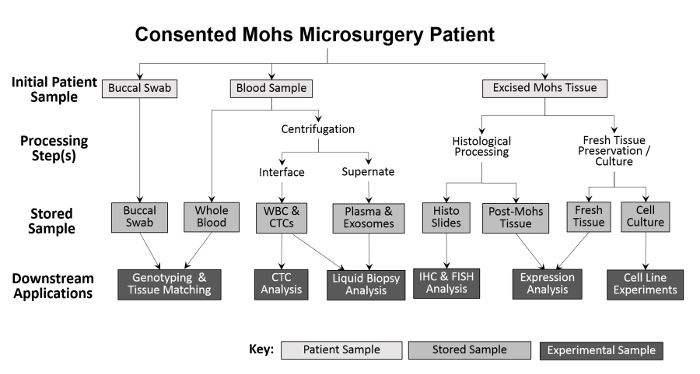
Şekil 2: Klinik temelli biyorepositoryal örneklerin toplanması ve işlenmesinin ana hatları. Bukkal bir çubuk ve kan örneği hastadan toplanır ve aşağı akım genotiplendirme ve doku uyumu için saklanır. Tam kan, beyaz küre hücresi (WBC) izolasyonu ve CTC analizi için ve ayrıca plazma toplama ve sıvı biyopsi analizi için işlenir. Mohs işlemi sırasında eksize edilen doku, tanı amaçlı olarak histolojik olarak işlenir ve bundan sonra histolojik slaytlar, daha ileri immünohistokimyasal analizler için deneysel olarak kullanılabilir. Kesilen doku örneğinin yeterince büyük olması koşuluyla, taze dokuların bir kısmı çıkarılır ve protein ve RNA izolasyonu için ve kültürlenmiş hücre hatlarının kurulması için kesitlendirilir.55583 / 55583fig1large.jpg "target =" _ blank "> Bu figürde daha büyük bir sürümünü görmek için lütfen tıklayınız.
| Koleksiyon Tarihi: | |||||
| Hasta 1 | Hasta 2 | Hasta 3 | Hasta 4 | Hasta 5 | |
| Baş harfleri ve doğum tarihleri | |||||
| Göz rengi | |||||
| Örnek Türü | |||||
| Örnek Konum | |||||
| Tükürük | |||||
| WDelik kan | |||||
| Plazma | |||||
| Tümör geçerli | |||||
| Doku Normal Normal | |||||
| Tümör Mohs Sıvı Azot | |||||
| Doku Normal Sıvı Azot | |||||
| Slaytlar |
Tablo 1: Örnek koleksiyonları kaydetmek için kontrol listesi. Toplanan her numuneyle birlikte izlenen ve kaydedilen veriler hasta baş harfleri, doğum tarihleri ve göz renginin (cilt tipi için) yanı sıra yereldirOn numune çıkarma. Toplanan tükürük numuneleri, kan alma hacimleri ve canlı ve korunmuş doku numunelerinin sayısı, daha sonraki kullanımlara tahsisler için referans olarak kaydedilir. Bu dosyayı indirmek için lütfen tıklayınız.
Numune toplama prosedürlerini doğrulamak için, her numune türü, aşağı akışlı uygulamalarda test edilmiştir. Önceki tekniklerin modifikasyonlarını kullanarak, tümör ve ANT, protein ve RNA izolasyonunda başarıyla kullanılmıştır ve potansiyel olarak DNA izolasyonu için kullanılabilir. Doku kesitlerinden kurulan canlı eksplantlar mikroskopi ile değerlendirilirken, depolanmış histolojik slaytlar immünohistokimya ve immünofloresan için kullanılmıştır.
Burada açıklanan protokolü izleyerek, bu modeli diğer dermatoloji kliniklerine, diğer tümör tiplerine (melanom gibi) genişletmek mümkündür., Ve diğer cerrahi spesiyaliteleri ve uygulamaları, insan kanserlerine yönelik çok yönlü araştırmalar için insan dokusu örnekleri sağlamak için kullanılmıştır. Bu protokolün ufak değişiklikler muhtemelen diğer uygulamalar için gereklidir, ancak ilke olarak, bu protokol hasta muamelesi sırasında toplanan hasta örneklerini düzenli olarak atan herhangi bir cerrahi uygulama için geçerlidir.
Protocol
Representative Results
Discussion
Yazarın bilgisine göre, bu protokol, kutanöz doku örneklerinin hem maliyet açısından hem de hızlı bir yaklaşımla klinik olarak tedarik edilmesine odaklanan türünün ilk örneğidir. Mohs mikrocerrahisi geçiren hastalar, genellikle belirli zaman dilimlerinde planlanır ve toplama işlemi bu sürelerle sınırlıdır. Numune toplama işlemi, hasta bakımında görev alan tıbbi asistandan, tümör numunelerini işleyen Mohs histotechnologist'ten ve numune girişini ve kan işlemeyi yürüten belirlenmiş…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
Bu çalışma, EEH'ye verilen Midwestern Üniversitesi Sağlık Bilimleri Araştırma Kolaylığı Hibe Grubundan ve Midwestern Üniversitesi Araştırma ve Destekleme Programları Ofisi'nden (Intranüal Grant) KJL'ye verilen fonlardan desteklenmiştir. Bağımlı Laboratuarlar ve Bağlı Dermatoloji tarafından ek destek sağlanmıştır. Teknik yardımları için Sarah Potekhen, Jamie Barto, Stefani Fawks, Cody Jording, Stacie Schimke, Heather Kissel ve Ali Zaidi'ye teşekkür ediyoruz.
Materials
| BD Vacutainer Plastic Blood Collection Tubes with K3EDTA | ThermoFisher Scientific | 02-685-2B | |
| Electron Microscopy Sciences Double Edge Blades | ThermoFisher Scientific | 50-949-411 | |
| Curved Medium Point General Purpose Forceps | ThermoFisher Scientific | 16-100-110 | |
| Premium Microcentrifuge Tubes | ThermoFisher Scientific | 05-408-138 | |
| Lonza Walkersville KGM Keratinocyte Medium | ThermoFisher Scientific | NC9791321 | |
| Electron Microscopy Sciences Tissue TEK OCT Compound | ThermoFisher Scientific | 50-363-579 | |
| Leica CM1950 Cryostat | Leica Biosystems | 14047743909 | |
| Frosted Microscope Slides | ThermoFisher Scientific | 12-550-343 | |
| Shandon Rapid-Chrome H&E Frozen Section Staining Kit | ThermoFisher Scientific | 99-900-01 | |
| Nalgene Long-Term Storage Cryogenic Tubes | ThermoFisher Scientific | 03-337-7X | |
| Falcon 15 mL Conical Centrifuge Tubes | ThermoFisher Scientific | 14-959-53A | |
| Boca Scientific BuccalT-Swab | ThermoFisher Scientific | NC9679349 | |
| Cell Signaling Technology 10x RIPA Buffer | ThermoFisher Scientific | 50-195-822 | |
| Halt Protease and Phosphatase Inhibitor Cocktail | ThermoFisher Scientific | PI78443 | |
| Eppendorf 5424R Microcentrifuge | ThermoFisher Scientific | 05-401-203 | |
| Pellet Morter Cordless Homogenizer | ThermoFisher Scientific | 12-141-3 | |
| RNAse Free Pellet Pestle | ThermoFisher Scientific | 121-141-364 | |
| Forma SteriCycle CO2 Incubator | ThermoFisher Scientific | 13-998-089 | |
| HyClone Fetal Bovine Serum | ThermoFisher Scientific | SH30071.02 | |
| Gibco Advanced DMEM/F-12 | ThermoFisher Scientific | 12-634-028 | |
| Gibco Penicillin-Streptomycin | ThermoFisher Scientific | 15140148 | |
| Gibco 1M Hepes | ThermoFisher Scientific | 15-630-130 | |
| Nunc Cell Culture 35 mm with Vent | ThermoFisher Scientific | 1256591 | |
| Anti-CFH monoclonal antibody clone OX-24 | Abnova | MAB12583 | |
| Anti-p40 (p63 delta) antibody | Abnova | ABX-144A | |
| Anti MUC-1 antibody | Santa Cruz Biotech | sc-7313 | |
| Anti-Snail + Slug (phospho S246) | Abcam | Ab63568 | |
| Goat anti-rabbit IgG, Alexa Fluor 488 | Invitrogen | A-11034 | |
| Alexa Fluor 568 Phallodin | Molecular Probes | A12380 | |
| ProLong Gold Antifade Mountant with DAPI | Molecular Probes | P36941 | |
| Zeiss Axio Imager Z1 Microscope with Axiocam camera | Zeiss | 4300009901 | |
| Olympus IX51 phase contrast with DP72 camera | Olympus | IX511F3 |
Riferimenti
- Baker, M. Biorepositories: Building better biobanks. Nature. 486, 141-146 (2012).
- Ambrosone, C. B., Nesline, M. K., Davis, W. Establishing a cancer center data bank and biorepository for multidisciplinary research. Cancer Epidemiol Biomarkers Prev. 15, 1575-1577 (2006).
- Baird, P. M., Gunter, E. W., Vaught, J. Building a biobank. Biopreserv Biobank. 14, 87-88 (2016).
- Caixeiro, N. J., Lai, K., Lee, C. S. Quality assessment and preservation of RNA from biobank tissue specimens: a systematic review. J Clin Pathol. 69, 260-265 (2016).
- Campbell, L. D., et al. Development of the ISBER best practices for repositories: Collection, storage, retrieval and distribution of biological materials for research. Biopreserv Biobank. 10, 232-233 (2012).
- Neumeister, V. M. Tools to assess tissue quality. Clin Biochem. 47, 280-287 (2014).
- Vaught, J., et al. An NCI perspective on creating sustainable biospecimen resources. J Natl Cancer Inst Monogr. 2011, 1-7 (2011).
- Fu, T., Aasi, S. Z., Hollmig, S. T. Management of high-risk squamous cell carcinoma of the skin. Curr Treat Options Oncol. 17, (2016).
- Rasmussen, C., Thomas-Virnig, C., Allen-Hoffmann, B. L. Classical human epidermal keratinocyte cell culture. Methods Mol Biol. 945, 161-175 (2013).
- Purdie, K. J., Pourreyron, C., South, A. P. Cancer cell culture: Methods and protocols. , 151-159 (2011).
- Berglund, S. R., Schwietert, C. W., Jones, A. A., Stern, R. L., Lehman, J., Goldberg, Z. Optimized methodology for sequential extraction of RNA and protein from small human skin biopsies. J Invest Dermatol. 127, 349-353 (2007).
- Schroeder, A., et al. The RIN: an RNA integrity number for assigning integrity values to RNA measurements. BMC Mol Biol. 7, 1-14 (2006).
- Cooper, H. L., et al. Expression and glycosylation of MUC1 in epidermolysis bullosa-associated and sporadic cutaneous squamous cell carcinomas. Br J Dermatol. 151, 540-545 (2004).
- Riihila, P. M., et al. Complement factor H: a biomarker for progression of cutaneous squamous cell carcinoma. J Invest Dermatol. 134, 498-506 (2014).
- Ha Lan, T. T., et al. Expression of the p40 isoform of p63 has high specificity for cutaneous sarcomatoid squamous cell carcinoma. J Cutan Pathol. 41, 831-838 (2014).
- Alomari, A. K., Glusac, E. J., McNiff, J. M. p40 is a more specific marker than p63 for cutaneous poorly differentiated squamous cell carcinoma. J Cutan Pathol. 41, 839-845 (2014).
- Qiao, B., Johnson, N. W., Gao, J. Epithelial-mesenchymal transition in oral squamous cell carcinoma triggered by transforming growth factor-beta1 is Snail family-dependent and correlates with matrix metalloproteinase-2 and -9 expressions. Int J Oncol. 37, 663-668 (2010).
- Vaught, J. Developments in biospecimen research. Br Med Bull. 114, 29-38 (2015).

