Oprichting van een Biorepository op een kliniek
Summary
Kutane tumoren worden vaak weggegooid na Mohs micrografische chirurgie. Hier wordt een protocol beschreven dat klinisch ondersteunend personeel effectief kan verwerken en opslaan van huidkanker ( bv. Plaveiselcelcarcinoom, basale celcarcinoom en melanoom) monsters voor stroomafwaartse laboratoriumtoepassingen zonder in te grijpen bij klinische operaties.
Abstract
De incidentie van huidkanker (bijvoorbeeld plaveiselcarcinoom, basaalcelcarcinoom en melanoom) is de afgelopen jaren toegenomen. Er wordt verwacht dat er sprake is van een parallelle vraag naar cutane tumormonsters voor biomedische onderzoeksstudies. De beschikbaarheid van weefsel is echter beperkt door de kosten van het opstellen van een biorepository en het ontbreken van protocollen die beschikbaar zijn voor het verkrijgen van klinische monsters die de klinische operaties niet interfereren. Er werd een protocol opgezet om kutane tumor en bijbehorende bloed- en speekselmonsters te verzamelen en te verwerken die minimale invloed hebben op routine klinische procedures op de datum van een Mohs-operatie. Tumormonsters worden verzameld en verwerkt van patiënten die hun eerste laag van Mohs-operatie ondergaan voor biopsie-bewezen kutane maligniteiten door de Mohs-histotechnoloog. Aangrenzend normaal weefsel wordt verzameld op het moment van chirurgische sluiting. Extra monsters die kunnen worden verzameld, zijn volledige bloed- en buccale swabs. Door gebruik te maken van weefselmonsters die normaal gesproken worden weggegooid, werd een biorepository gegenereerd die verschillende belangrijke voordelen biedt door in de kliniek versus de laboratoriumomgeving te zijn. Deze omvatten een breed scala van verzamelde monsters; Toegang tot ontdekte patiëntrecords, inclusief pathologieverslagen; En, voor de typische donor, toegang tot aanvullende monsters tijdens follow-upbezoeken.
Introduction
Kanker- en biomarker onderzoek is gebaseerd op een aanbod van kwaliteit menselijk weefselmonsters, en de beperkte voorraad heeft onderzoek 1 , 2 gehinderd. Veel dermatologische studies zijn beperkt door de ontoereikende toevoer, de variabele kwaliteit en de kosten die verband houden met het gebruik van menselijk weefsel. De kosten voor het opzetten van een grote, toegewijde biobank zijn geschat op ongeveer twee miljoen dollar 3 , en deze kosten maken het gebruik van menselijk weefsel buiten bereik van veel onderzoekers. Bovendien bestaat het proces van het genereren en opslaan van onderzoeksmonsters het risico om klinische operaties te beïnvloeden en de patiëntenzorg te vertragen, indien niet zorgvuldig uitgevoerd. Een kosteneffectieve klinische biorepositorie is opgericht die zich toelegt op huidkankermonsters na aanbeveelde best practices en sample validatie 4 , 5 , 6 .
<pClass = "jove_content"> Dit protocol is ontwikkeld in een dermatologie kliniek die een groot aantal Mohs micrographische operaties uitvoert om plaveiselcellencarcinoom (SCC), basale celcarcinoom (BCC) en melanoma huidkanker te verwijderen. Vrijwillige donoren kunnen worden aangeworven uit deze patiëntenpopulatie. Het is belangrijk om de biorepositor op de plaats van verzameling vast te stellen om weefsel en bloed snel van toegestane patiënten vast te stellen zonder behandeling te vertragen. Het verzamelen van monsters uit dezelfde kliniek minimaliseert variaties in inzamelingstechnieken en minimaliseert variaties in de kwaliteit van monsters, wat problematisch kan zijn voor downstream toepassingen 7 , 8 .Het doel van de micrografische chirurgische techniek van Mohs is ervoor te zorgen dat alle kankerweefsels worden verwijderd, terwijl zoveel mogelijk gezond weefsel wordt behouden. De procedure omvat de geleidelijke verwijdering van dunne lagen tumorweefsel. Elke opeenvolgende laag is zijnTologisch onderzocht (na cryosectie van het tumorweefsel en het uitvoeren van H & E-kleuring) door een dermatoloog om te bepalen of al het kankerweefsel is verwijderd. De excisie en het onderzoek van de volgende lagen weefsels wordt uitgevoerd terwijl de patiënt in het kantoor blijft. Deze techniek wordt beschouwd als de beste behandelingsoptie voor SCC 9 . Op dit punt is de wond afgesloten en, om de genezing en cosmetische verschijning te verbeteren, wordt aangrenzend normaal weefsel (ANT) vaak uitgesneden. Zo is deze chirurgische procedure om een tumor te verwijderen ideaal geschikt voor het verzamelen van histologisch gekarakteriseerd weefsel voor toekomstige studies.
De aanbestedingsprocedure voor het verkrijgen van tumorweefsel, aangrenzend normaal weefsel, speeksel en bloedmonsters is ontworpen om een minimale invloed op de normale staffuncties te hebben ( Figuur 1 ). Medische assistenten verrichten de bloeddruk tijdens het voorbereiden van de patiënt voor de procedure. Na afloop van de Mohs procedure, de M Ohs histotechnoloog bereidt aanvullende histologische dia's van het monster op en draagt het weefsel over naar het biorepository. Kosten verbonden aan het opstellen van de biorepository zijn de aankoop van cryopreservation freezers, het creëren van bescheiden klinische laboratoriumruimte en de ontwikkeling van een inventarisatie programma.
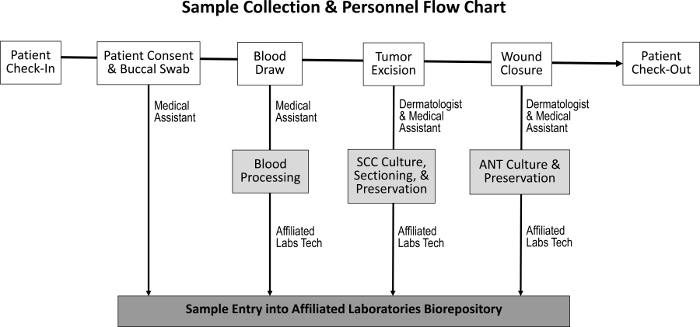
Figuur 1: Opeenvolging van steekproefverzameling en verantwoordelijke medewerkers. Bij de patiënt inchecken en het bereiken van de toestemming van de patiënt verzamelt de medische assistent een buccale swab en voert hij een bloedtekening uit. De dermatoloog en medische assistent accijnzen dan de tumor en sluiten de wond, gedurende welke tijd SCC en ANT-monsters worden verzameld. Een toegewijde laboratoriumtechnicus verwerkt het bloed en deelt de SCC- en ANT-monsters voor weefselkweek, behoud en toegang tot de biorepository.Ftp_upload / 55583 / 55583fig1large.jpg "target =" _ blank "> Klik hier om een grotere versie van deze figuur te bekijken.
De verscheidenheid van verzamelde monsters zorgt voor een verscheidenheid aan experimentele benaderingen ( Figuur 2 ). Monsters die van de patiënt zijn verzameld zijn buccale swabs (speeksel kan ook worden verzameld indien nodig), heel bloed en uitgesneden weefsel. De buccale swabs en een monster van het gehele bloed worden opgeslagen, zonder verwerking, voor genotyping en weefsel matching. Geheel bloed wordt gescheiden in witte bloedcel (WBC) en plasmafracties voor toekomstige analyses. Na het verwerken van Mohs wordt de bevroren tumor direct in vloeibare stikstof geplaatst en overgebracht naar een -80 ° C vriezer. Vers, levensvatbaar tumorweefsel en ANT-monsters worden gekweekt onder toepassing van modificaties van eerdere technieken 10 , 11 en vervolgens cryopreserveerd. Tijdens het verzamelen wordt het nummer van elk steekproef opgenomen op een spreadsheet voorafgaand aan inschrijving Het inventarisatieprogramma om de nauwkeurige verwerking te vergemakkelijken ( tabel 1 ).
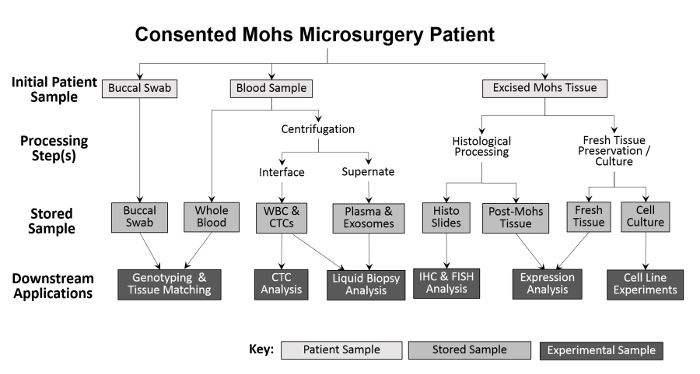
Figuur 2: Overzicht van klinische biorepository-inzameling en verwerking van klinieken. Een buccale zwabber en bloedmonster worden verzameld van de patiënt en opgeslagen voor downstream genotyping en weefsel matching. Geheel bloed wordt verder verwerkt voor witte bloedcellen (WBC) isolatie en CTC analyse, evenals voor plasma-insameling en vloeibare biopsie analyse. Weefsel uitgesneden tijdens de Mohs-procedure wordt histologisch verwerkt voor diagnostische doeleinden, waarna de histologische dia's experimenteel kunnen worden gebruikt voor verdere immunohistochemische analyses. Met dien verstande dat het uitgesneden weefselmonster groot genoeg is, wordt een gedeelte van versweefsel verwijderd en gesneden voor eiwit- en RNA-isolatie en voor de oprichting van gekweekte cellijnen.55583 / 55583fig1large.jpg "target =" _ blank "> Klik hier om een grotere versie van deze figuur te zien.
| Inzamelingsdatum: | |||||
| Patiënt 1 | Patiënt 2 | Patiënt 3 | Patiënt 4 | Patiënt 5 | |
| Voorletters en Geboortedatum | |||||
| Oogkleur | |||||
| Sample Type | |||||
| Plaats van de steekproef | |||||
| Speeksel | |||||
| wGat bloed | |||||
| Plasma | |||||
| Tumor levensvatbaar | |||||
| Weefsel Normaal Leefbaar | |||||
| Tumor Mohs Liquid Stikstof | |||||
| Weefsel Normaal vloeibaar stikstof | |||||
| slides |
Tabel 1: Checklist om steekproeven te registreren. Gegevens die worden opgespoord en opgenomen met elk verzameld monster, omvatten patiënt initialen, geboortedatum en oogkleur (voor huidtypen), evenals de locatiOp het verwijderen van het monster. Het aantal speekselmonsters, bloedinzamelvolumes en het aantal levende en geconserveerde weefselmonsters verzameld worden ook opgenomen als referenties voor toewijzingen tot latere toepassingen. Klik hier om dit bestand te downloaden.
Om de voorbeeldinzamelingsprocedures te valideren, is elk monstertype getest in downstream toepassingen. Door gebruik te maken van wijzigingen van eerdere technieken 12 , zijn tumor en ANT succesvol gebruikt in eiwit- en RNA-isolatie en kan deze mogelijk worden gebruikt voor DNA-isolatie. Bruikbare planten uit de weefselsecties zijn geëvalueerd door microscopie, terwijl opgeslagen histologische dia's zijn gebruikt voor immunohistochemie en immunofluorescentie.
Door het hier beschreven protocol te volgen is het mogelijk om dit model uit te breiden naar andere dermatologische klinieken, andere tumortypen (zoals melanoom), En andere chirurgische specialiteiten en praktijken om menselijke weefselmonsters te leveren voor veelzijdig onderzoek naar menselijke kanker. Lichte wijzigingen van dit protocol zijn waarschijnlijk nodig voor andere praktijken, maar in principe is dit protocol van toepassing op elke chirurgische praktijk die routinematig de patiëntenmonsters verzamelt die tijdens de patiëntbehandeling zijn verzameld.
Protocol
Representative Results
Discussion
Naar de kennis van de auteur is dit protocol de eerste in zijn soort dat zich richt op de klinische aanbesteding van cutane weefselmonsters in zowel een kosteneffectieve als snelle aanpak. Patiënten die Mohs-microchirurgie ondergaan, worden meestal gepland tijdens specifieke tijdstippen, en de inzameling is beperkt tot deze perioden. Proefcollectie omvat inspanning van de medische assistent die betrokken is bij patiëntenzorg, de Mohs-histotechnoloog die de tumormonsters verwerkt en een aangewezen laboratoriumpersoneel…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
Dit werk werd ondersteund door fondsen van de Midwestern University College of Health Sciences Research Facilitation Grant, toegekend aan EEH, en het Midwestern University Office of Research en Gesponsorde Programma's Intramural Grant, toegekend aan KJL. Aanvullende ondersteuning is verleend door aangesloten laboratoria en geaffilieerde dermatologie. Wij bedanken Sarah Potekhen, Jamie Barto, Stefani Fawks, Cody Jording, Stacie Schimke, Heather Kissel en Ali Zaidi voor hun technische bijstand.
Materials
| BD Vacutainer Plastic Blood Collection Tubes with K3EDTA | ThermoFisher Scientific | 02-685-2B | |
| Electron Microscopy Sciences Double Edge Blades | ThermoFisher Scientific | 50-949-411 | |
| Curved Medium Point General Purpose Forceps | ThermoFisher Scientific | 16-100-110 | |
| Premium Microcentrifuge Tubes | ThermoFisher Scientific | 05-408-138 | |
| Lonza Walkersville KGM Keratinocyte Medium | ThermoFisher Scientific | NC9791321 | |
| Electron Microscopy Sciences Tissue TEK OCT Compound | ThermoFisher Scientific | 50-363-579 | |
| Leica CM1950 Cryostat | Leica Biosystems | 14047743909 | |
| Frosted Microscope Slides | ThermoFisher Scientific | 12-550-343 | |
| Shandon Rapid-Chrome H&E Frozen Section Staining Kit | ThermoFisher Scientific | 99-900-01 | |
| Nalgene Long-Term Storage Cryogenic Tubes | ThermoFisher Scientific | 03-337-7X | |
| Falcon 15 mL Conical Centrifuge Tubes | ThermoFisher Scientific | 14-959-53A | |
| Boca Scientific BuccalT-Swab | ThermoFisher Scientific | NC9679349 | |
| Cell Signaling Technology 10x RIPA Buffer | ThermoFisher Scientific | 50-195-822 | |
| Halt Protease and Phosphatase Inhibitor Cocktail | ThermoFisher Scientific | PI78443 | |
| Eppendorf 5424R Microcentrifuge | ThermoFisher Scientific | 05-401-203 | |
| Pellet Morter Cordless Homogenizer | ThermoFisher Scientific | 12-141-3 | |
| RNAse Free Pellet Pestle | ThermoFisher Scientific | 121-141-364 | |
| Forma SteriCycle CO2 Incubator | ThermoFisher Scientific | 13-998-089 | |
| HyClone Fetal Bovine Serum | ThermoFisher Scientific | SH30071.02 | |
| Gibco Advanced DMEM/F-12 | ThermoFisher Scientific | 12-634-028 | |
| Gibco Penicillin-Streptomycin | ThermoFisher Scientific | 15140148 | |
| Gibco 1M Hepes | ThermoFisher Scientific | 15-630-130 | |
| Nunc Cell Culture 35 mm with Vent | ThermoFisher Scientific | 1256591 | |
| Anti-CFH monoclonal antibody clone OX-24 | Abnova | MAB12583 | |
| Anti-p40 (p63 delta) antibody | Abnova | ABX-144A | |
| Anti MUC-1 antibody | Santa Cruz Biotech | sc-7313 | |
| Anti-Snail + Slug (phospho S246) | Abcam | Ab63568 | |
| Goat anti-rabbit IgG, Alexa Fluor 488 | Invitrogen | A-11034 | |
| Alexa Fluor 568 Phallodin | Molecular Probes | A12380 | |
| ProLong Gold Antifade Mountant with DAPI | Molecular Probes | P36941 | |
| Zeiss Axio Imager Z1 Microscope with Axiocam camera | Zeiss | 4300009901 | |
| Olympus IX51 phase contrast with DP72 camera | Olympus | IX511F3 |
Riferimenti
- Baker, M. Biorepositories: Building better biobanks. Nature. 486, 141-146 (2012).
- Ambrosone, C. B., Nesline, M. K., Davis, W. Establishing a cancer center data bank and biorepository for multidisciplinary research. Cancer Epidemiol Biomarkers Prev. 15, 1575-1577 (2006).
- Baird, P. M., Gunter, E. W., Vaught, J. Building a biobank. Biopreserv Biobank. 14, 87-88 (2016).
- Caixeiro, N. J., Lai, K., Lee, C. S. Quality assessment and preservation of RNA from biobank tissue specimens: a systematic review. J Clin Pathol. 69, 260-265 (2016).
- Campbell, L. D., et al. Development of the ISBER best practices for repositories: Collection, storage, retrieval and distribution of biological materials for research. Biopreserv Biobank. 10, 232-233 (2012).
- Neumeister, V. M. Tools to assess tissue quality. Clin Biochem. 47, 280-287 (2014).
- Vaught, J., et al. An NCI perspective on creating sustainable biospecimen resources. J Natl Cancer Inst Monogr. 2011, 1-7 (2011).
- Fu, T., Aasi, S. Z., Hollmig, S. T. Management of high-risk squamous cell carcinoma of the skin. Curr Treat Options Oncol. 17, (2016).
- Rasmussen, C., Thomas-Virnig, C., Allen-Hoffmann, B. L. Classical human epidermal keratinocyte cell culture. Methods Mol Biol. 945, 161-175 (2013).
- Purdie, K. J., Pourreyron, C., South, A. P. Cancer cell culture: Methods and protocols. , 151-159 (2011).
- Berglund, S. R., Schwietert, C. W., Jones, A. A., Stern, R. L., Lehman, J., Goldberg, Z. Optimized methodology for sequential extraction of RNA and protein from small human skin biopsies. J Invest Dermatol. 127, 349-353 (2007).
- Schroeder, A., et al. The RIN: an RNA integrity number for assigning integrity values to RNA measurements. BMC Mol Biol. 7, 1-14 (2006).
- Cooper, H. L., et al. Expression and glycosylation of MUC1 in epidermolysis bullosa-associated and sporadic cutaneous squamous cell carcinomas. Br J Dermatol. 151, 540-545 (2004).
- Riihila, P. M., et al. Complement factor H: a biomarker for progression of cutaneous squamous cell carcinoma. J Invest Dermatol. 134, 498-506 (2014).
- Ha Lan, T. T., et al. Expression of the p40 isoform of p63 has high specificity for cutaneous sarcomatoid squamous cell carcinoma. J Cutan Pathol. 41, 831-838 (2014).
- Alomari, A. K., Glusac, E. J., McNiff, J. M. p40 is a more specific marker than p63 for cutaneous poorly differentiated squamous cell carcinoma. J Cutan Pathol. 41, 839-845 (2014).
- Qiao, B., Johnson, N. W., Gao, J. Epithelial-mesenchymal transition in oral squamous cell carcinoma triggered by transforming growth factor-beta1 is Snail family-dependent and correlates with matrix metalloproteinase-2 and -9 expressions. Int J Oncol. 37, 663-668 (2010).
- Vaught, J. Developments in biospecimen research. Br Med Bull. 114, 29-38 (2015).

