Un système de test en flexion millimètre pour mesurer les propriétés mécaniques des Spicules d’éponges marines
Summary
Nous présentons un protocole permettant d’effectuer des essais de flexion trois points sur les fibres d’échelle submillimétrique en utilisant un dispositif mécanique sur mesure. L’appareil permet de mesurer des forces allant de 20 µN jusqu’à 10 N et peut donc accueillir une variété de tailles de fibres.
Abstract
Beaucoup de charge portant des structures biologiques (LBBSs) — comme le rachis des plumes et des spicules — sont de petite taille (< 1 mm) mais pas microscopiques. Mesurer le comportement en flexion de ces LBBSs est important pour comprendre les origines de leurs fonctions mécaniques remarquables.
Les auteurs décrivent un protocole pour effectuer des essais de flexion trois points à l’aide d’un appareil mécanique sur mesure qui permet de mesurer des forces allant de 10-5 à 101 N et déplacements allant de 10-7 à 10-2 m. Le principal avantage de ce dispositif d’essai mécanique, c’est que les capacités de la force et le déplacement peuvent être facilement ajustées pour différentes LBBSs. Principe de fonctionnement de l’appareil est similaire à celle d’un microscope à force atomique. À savoir, la force est appliquée au LBBS par un point de charge qui est attaché à l’extrémité du bras de levier. Le déplacement de point de charge est mesuré par un capteur de déplacement optique de fibre et transformé en une force à l’aide de la rigidité mesurée en porte-à-faux. Gamme de force de l’appareil peut être réglé à l’aide de leviers de raideurs différentes.
Les capacités de l’appareil sont illustrées en réalisant des essais de flexion trois points sur les éléments squelettiques de l’éponge marine Euplectella aspergillum. Les éléments squelettiques — appelées spicules — sont des fibres de silice qui sont environ de 50 µm de diamètre. Nous décrivons les procédures pour l’étalonnage de l’appareil mécanique, les spicules de montage sur un appareil de flexion trois points avec une envergure de mm ≈1.3, et effectuer une flexion test. La force exercée sur le spicule et sa déformation à l’emplacement de la force appliquée sont mesurés.
Introduction
En étudiant les architectures des porteurs de structures biologiques (LBBSs), comme shell et osseuse, ingénieurs ont mis au point de nouveaux matériaux composites qui sont forts et durs 1. Il a été démontré que les propriétés mécaniques remarquables de LBBSs et de leurs homologues de bio-inspirés sont liées à leurs architectures internes complexes 2. Cependant, les relations entre les architectures LBBS et propriétés mécaniques ne sont pas totalement comprises. Mesurer la réponse mécanique d’un LBBS est la première étape pour comprendre comment son architecture améliore ses propriétés mécaniques.
Cependant, il est important que le type de test utilisé pour mesurer la réponse mécanique d’un LBBS est compatible avec sa fonction mécanique. Par exemple, étant donné que les plumes doivent supporter des charges aérodynamiques, la fonction principale d’un rachis de la plume doit fournir la rigidité en flexion 3. Par conséquent, un essai de flexion est préférable à un essai de tension uniaxiaux pour mesurer sa réponse mécanique. En fait, beaucoup de LBBSs — comme le rachis des plumes 3, herbe tiges 4et spicules 5,6,7,8— principalement déformer en pliant. C’est parce que ces LBBSs sont minces —c’est-à-dire, leur longueur est beaucoup plus grande que leur largeur ou profondeur. Toutefois, effectuer des essais de flexion sur ces LBBSs est difficile car les forces et les déplacements qu’ils peuvent supporter avant d’échouer varient de 10-2 à 102 N et 10-4 à 10-3 m, respectivement 3 , 4 , 5 , 7 , 8. en conséquence, le dispositif utilisé pour effectuer ces essais mécaniques devrait avoir force et déplacement des résolutions de ≈10-5 N et ≈10-7 m (soit 0,1 % d’une force maximale mesurable et le déplacement de la sonde), respectivement.
Disponible dans le commerce à grande échelle, des systèmes de tests mécaniques généralement ne peuvent mesurer forces et déplacements avec cette résolution. Tandis que la force atomique axée sur le microscope 9,10 ou microélectromécaniques axée sur les systèmes 11 dispositifs d’essai ont une résolution suffisante, la force maximale (déplacement respectif), ils peuvent mesurer est inférieure à la force maximale (déplacement respectif) qui résiste à la LBBS. Par conséquent, pour effectuer des essais de flexion sur ces LBBSs, les ingénieurs et les scientifiques doit compter sur mesure mécanique test périphériques 5,7,12,13. Le principal avantage de ces dispositifs sur mesure, c’est qu’elles peuvent accueillir de grandes plages de forces et de déplacements. Cependant, la construction et l’exploitation de ces appareils n’est pas bien documentée dans la littérature.
Un protocole est décrit pour effectuer des essais de flexion trois points à l’aide d’un appareil mécanique sur mesure qui permet de mesurer des forces allant de 10-5 à 101 N et déplacements allant de 10-7 à 10-2 m. Dessins techniques, y compris toutes les dimensions, les composants de l’appareil d’essai mécanique sont fournis dans les documents supplémentaires. Le principal avantage de ce dispositif d’essai mécanique, c’est que les plages de force et de déplacement peuvent être facilement ajustées pour convenir à différents LBBSs. Principe de fonctionnement de l’appareil est similaire à celle d’une microscopie de force atomique 9. Dans ce dispositif, un échantillon est placé dans une tranchée coupée dans une plaque d’acier inoxydable (voir Figure 1A-C). La durée de la tranchée est mesurée à partir de photographies au microscope optiques à 1278 ± 3 µm (moyenne ± écart-type ; n = 10). Les bords de la tranchée prend en charge l’échantillon au cours d’un essai de flexion (voir Figure 1et D). Cette étape de l’échantillon est attachée à un trois axes de positionnement et placée sous une cale en aluminium de sorte que le coin se situe à mi-chemin toutes les étapes de la tranchée (voir Figure 1C). En déplaçant la scène dans le  direction (voir Figure 1 aet C), le spécimen est poussé dans la cale provoquant le spécimen à plier.
direction (voir Figure 1 aet C), le spécimen est poussé dans la cale provoquant le spécimen à plier.
Nous nous référons à la cale sous la pointe de point de charge (LPT) et le composant de l’appareil qui contient la cale sous le point de charge (LP). Le LP est fixé à l’extrémité du bras de levier dont déplacement est mesurée par un capteur de déplacement optique de fibre (DOM). Le FODS émet des rayons infrarouges qui se reflète sur un miroir situé sur la surface supérieure de la LP (voir Figure 1B) et reçues par une fibre optique dans les DOM. Un morceau carré de ≈5 mm d’une plaquette de silicium poli est utilisé comme le miroir de LP et est apposé sur le LP avec de l’epoxy. Le FODS mesure déplacements en comparant l’intensité de la lumière émise et réfléchie. La rigidité en porte-à-faux et le déplacement sont utilisés pour calculer la force, 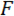 , expérimentés par la cale due à son interaction avec l’échantillon. Le déplacement en porte-à-faux est également utilisé pour calculer le déplacement de la section transversale de l’échantillon sous la cale,
, expérimentés par la cale due à son interaction avec l’échantillon. Le déplacement en porte-à-faux est également utilisé pour calculer le déplacement de la section transversale de l’échantillon sous la cale,  . Capteurs de force basé sur cantilever ont été utilisés dans un certain nombre de micro – et macro-scale mécaniques essais études 10,11,12,13,14. La conception spécifique présentée ici est une adaptation d’un appareil mécanique pour effectuer des expériences de contact adhésif 14. Un design similaire a également été utilisé dans un micro-tribomètre commercialement disponible 15,16.
. Capteurs de force basé sur cantilever ont été utilisés dans un certain nombre de micro – et macro-scale mécaniques essais études 10,11,12,13,14. La conception spécifique présentée ici est une adaptation d’un appareil mécanique pour effectuer des expériences de contact adhésif 14. Un design similaire a également été utilisé dans un micro-tribomètre commercialement disponible 15,16.
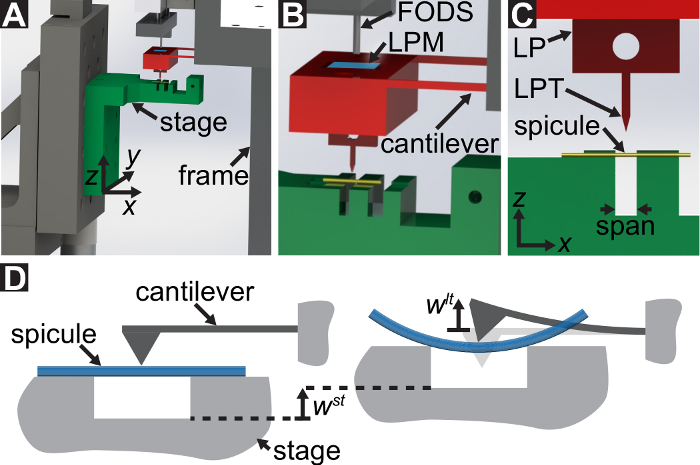
Figure 1 : vue d’ensemble de l’appareil de mesure mécanique. (A), A rendu de conception assistée par ordinateur de l’appareil. Les composantes de la scène sont surlignées en vert. La force de détection sous-assemblage (cantilever, point de charge (LP)) est surlignée en rouge. (B) A amplifié vue de (A). Le miroir LP est représentée en bleu sur le dessus de la LP sous le FODS et étiqueté l/min. (C) le système de coordonnées utilisé pour décrire le mouvement de l’étape de traduction. Par nivellement thétape e étape 1.9 du protocole, le 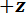 direction faite pour coïncider avec le vecteur normal à la surface du miroir LP. (D), un schéma de la configuration de flexion trois points montrant la déformation du spicule et les déplacements mesurés
direction faite pour coïncider avec le vecteur normal à la surface du miroir LP. (D), un schéma de la configuration de flexion trois points montrant la déformation du spicule et les déplacements mesurés 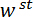 , et
, et 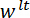 . S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
Les capacités de l’appareil sont illustrées en réalisant des essais de flexion trois points sur les éléments squelettiques de l’éponge marine Euplectella aspergillum6,7. Squelette de cette éponge est un assemblage de filaments, appelées spicules (voir la Figure 2A). Les spicules ≈50 µm d’épaisseur et sont composées principalement de silice 6. Axée sur les Biosilica spicules sont trouvent dans les éponges appartenant aux classes Demospongiae, Homoscleromorpha et Hexactinellida. Éponges, comme E. aspergillum, qui appartiennent à la classe Hexactinellida sont également connus comme « les éponges de verre ». Alors que les spicules d’éponges de verre sont composées essentiellement de silice, il a été démontré que la silice contienne souvent une matrice organique composée de soit collagène 17,18 ou chitine 19,20 , 21. cette matrice organique joue un rôle important dans la silice de 18,biomineralization20. En outre, dans certains spicules la matrice organique sert aussi comme un modèle pour la biominéralisation du calcium 22. En plus d’être distribué au sein de la silice, la matrice organique peut aussi former des couches distinctes qui partitionnent la silice de spicule en lamelles concentriques, cylindrique 6,23. Il a été démontré que cette architecture concentrique, lamellaire peut affecter déformation comportement 6,7,8,24,25,26 des spicules . Par conséquent, les propriétés mécaniques des spicules sont déterminées par une combinaison de leur composition chimique (i.e., la structure chimique du composite silice-protéine) et leur architecture 27. La structure chimique et l’architecture de verre les spicules des éponges sont toujours sous enquête 24,28,29.
La plupart des spicules dans E. aspergillum est cimentée pour former une cage squelette rigide. Toutefois, à la base du squelette il y a une touffe de très longtemps les spicules (≈10 cm) appelés les spicules d’ancrage (voir la Figure 2A). Les auteurs décrivent le protocole permettant d’effectuer des essais de flexion trois points sur une petite section des spicules d’ancrage.
À l’ étape 1 du protocole, la procédure d’assemblage et d’aligner les composants de l’appareil d’essai mécanique sur mesure est décrite. Étapes 2 et 4 du protocole fournissent des instructions pour générer données d’étalonnage utilisées pour calculer les forces et les déplacements dans l’essai de flexion. Les mesures prises pour préparer une section d’un spicule et monter sur le montage d’essai sont décrits à l’étape 3. La procédure des essais de flexion sur la section de spicule est décrite à l’étape 5. Enfin, dans la section Résultats représentant les données d’étalonnage obtenues aux étapes 2 et 4 sont utilisées ainsi que les données de test flexion obtenues à l’étape 5 pour calculer 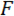 et
et 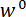 .
.

Figure 2 : Procédure pour sectionnement et inspection des spicules aspergillum e. (A) le squelette d’e. aspergillum. La touffe de spicules d’ancrage autoportant est montrée à la base du squelette. La barre d’échelle est de ~ 25 mm. (B) un spicule seule ancre est maintenu en place sur une lame de microscope avec un pinceau de martre #00000 rouge et sectionnés à l’aide d’une lame de rasoir. La barre d’échelle est ~ 12 mm (C) une section d’un spicule aspergillum E. placée dans la tranchée sur la scène de l’échantillon. Les bords de la tranchée et la crête de la tranchée sont surlignées en bleu sarcelle et orange, respectivement. Le spicule est poussé contre la crête de tranchée à faire en sorte que son axe est perpendiculaire sur les bords de la tranchée. (D) une micrographie d’un spicule qui passe la procédure de contrôle décrite à l’ étape 3.4 du protocole, qui explique comment déterminer si une section de spicule est endommagée et doit être jetée. (E), une micrographie d’un spicule contenant plusieurs fissures et manque de larges pans des couches de silice qui ne permettrait pas la procédure de contrôle décrite à l’ étape 3.4 du protocole. Barreaux de l’échelle = 250 µm (C), 100 µm (D) et 100 µm (E). S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
Protocol
Representative Results
Discussion
Plusieurs étapes du protocole sont particulièrement importants de veiller à ce que les forces et les déplacements sont mesurés avec précision. Alors que certaines de ces étapes critiques sont universels à tous les essais de flexion trois points, d’autres sont propres à ce dispositif d’essai mécanique.
À l’ étape 1.2 du protocole le miroir LP est nettoyé et inspecté à rayures et à l’ étape 1.6 du protocole, le gain de Dom est réglé. Il es…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
Ce travail a été soutenu par la National Science Foundation [mécanique des matériaux et Structures de programme, octroyer le numéro 1562656] ; et l’American Society of Mechanical Engineers [Haythornthwaite Young Investigator Award].
Materials
| TMC 36" x 48" isolation table with 4" CleanTop breadboard | TMC | 63-563 | Isolation Table |
| Diffeential Screw Adjuster | Thorlabs | DAS110 | For stage leveling plate |
| 1" Travel Micrometer Head with 0.001" Graduations | Thorlabs | 150-801ME | For stage leveling plate |
| Right-Angle Bracket for PT Series Translation Stages, 1/4"-20 Mounting Holes | Thorlabs | PT102 | For microscope mount |
| 1" Dovetail Translation Stage, 1/4"-20 Taps | Thorlabs | DT25 | For microscope mount |
| 1" Translation Stage with 1/4"-170 Adjustment Screw, 1/4"-20 Taps | Thorlabs | PT1B | For microscope mount |
| 12" Length, Dovetail Optical Rail | Edmund Optics | 54-401 | For microscope mount |
| 2.5" Width, Dovetail Carrier | Edmund Optics | 54-404 | For microscope mount |
| 0.5" Width, Dovetail Carrier | Edmund Optics | 54-403 | For microscope mount |
| InfiniTube Mounting C-Clamp with ¼-20 | Edmund Optics | 57-788 | Microscope component |
| Standard (with no In-Line Attachment), InfiniTube | Edmund Optics | 56-125 | Microscope component |
| Standard In-Line Attachment (Optimized at 2X-10X), InfiniTube | Edmund Optics | 56-126 | Microscope component |
| Mitutoyo/Achrovid Objective Adapter (M26 to M27) | Edmund Optics | 53-787 | Microscope component |
| 5X Infinity Achrovid Microscope Objective | Edmund Optics | 55-790 | Microscope component |
| 0.316" ID, Fiber Optic Adapter SX-6 | Edmund Optics | 38-944 | Microscope component |
| ¼" x 36", Flexible Fiber Optic Light Guide | Edmund Optics | 42-347 | Microscope component |
| 115V, MI-150 Fiber Optic Illuminator w/IR Filter and Holder | Edmund Optics | 55-718 | Microscope component |
| Allied Vision Manta G-223 2/3" Color CMOS Camera | Edmund Optics | 88-452 | Microscope component |
| Power Supply for Manta/ Guppy Pro/ Stingray/ Pike | Edmund Optics | 68-586 | Microscope component |
| 1/4" Travel Single Axis Translation Stage | Thorlabs | MS1S | FODS micrometer |
| Analog Reflectance Dependent Fiber Optic Displacement Sensor | Philtec | D20 | FODS |
| 30V, 3A DC Power Supply | Agilent | U8001A | Power supply for DAQ and FODS |
| 14-Bit, 48 kS/s Low-Cost Multifunction DAQ | National Instruments | USB-6009 | DAQ for FODS |
| Three Axis Motorized Translation Stage | Thorlabs | Thorlabs T25 XYZ-E/M | Translation stage |
| T-Cube DC Servo Motor Controller | Thorlabs | TDC001 | Motor controller for stage |
| T-Cube Power Supply | Thorlabs | TPS001 | Power supply for motor controller |
| National Instruments LabVIEW (2013 SP1) | National Instruments | Used for running software | |
| National Instruments LabVIEW Vision Acquisition Software (2016) | National Instruments | Used for running software | |
| Nikon Eclipse Ci-POL Main Body | MVI | MDA96000 | Polarized light microscope |
| Nikon Pi Intermediate Tube with Analyzer Slider | MVI | MDB45305 | Polarized light microscope |
| Nikon Dia-Polarizer | MVI | MDN11920 | Polarized light microscope |
| Power Cord – 7'6" | MVI | 79035 | Polarized light microscope |
| Nikon P-Amh Mechanical Stage | MVI | MDC45000 | Polarized light microscope |
| Nikon Lwd Achromat Condenser | MVI | MBL16100 | Polarized light microscope |
| Nikon LV-NBD5BD-CH Manual Quint Nosepiece ESD | MVI | MBP60125 | Polarized light microscope |
| Nikon C-TF Trinocular Tube F | MVI | MBB93100 | Polarized light microscope |
| Nikon CFI 10X Eyepiece FN 22mm NC | MVI | MAK10110 | Polarized light microscope |
| Nikon TU Plan Flour BD 10x Objective | MVI | MUE42100 | Polarized light microscope |
| Venus Flower Basket Sponge | Denis Brand | N/A | Sponge skeleton |
| 3.5X Headband Flip-Up Magnifier | McMaster Carr | 1490T5 | Used for spicule sectioning |
| Ø1" Silicon Wafer, Type P / <100> | Ted Pella | 16011 | Used for load point mirror |
| Low Lint Tapered Tip Cotton Swab | McMaster Carr | 71035T31 | Used for cleaning LP mirror |
| Rubber grip precision knife | McMaster Carr | 35575A68 | Used for sectioning spicules |
| Microscope Slides, frosted end, 75 x 25 x 1mm | Ted Pella | 260409 | Used for sectioning spicules |
| Sable Brushes, #00000, 0.08mm W x 4.0mm L | Ted Pella | 11806 | Used for handling spicules |
| PELCO Pro High Precision Tweezers, extra fine tips, superior finish | Ted Pella | 5367-5NM | Used for handling spicules |
| Dual Axis Linear Scale Micrometer | Edmund Optics | 58-608 | Used for calibrating the microscopes |
| FLEX-A-TOP FT-38 CAS | ESD Plastic Containers | FT-38-CAS | Used for storing spicules |
| Plastic Vial Bullseye Level | McMaster Carr | 2147A11 | Used for leveling the stage |
| Analytical Balance | Mettler Toledo | MS105DU | Used to mass calibration weights |
Riferimenti
- Wegst, U. G., Bai, H., Saiz, E., Tomsia, A. P., Ritchie, R. O. Bioinspired structural materials. Nat. Mater. 14 (1), 23-36 (2015).
- Meyers, M. A., McKittrick, J., Chen, P. Y. Structural biological materials: critical mechanics-materials connections. Science. 339 (6121), 773-779 (2013).
- Bodde, S. G., Meyers, M. A., McKittrick, J. Correlation of the mechanical and structural properties of cortical rachis keratin of rectrices of the Toco Toucan (Ramphastos toco). J. Mech. Behav. Biomed. Mater. 4 (5), 723-732 (2011).
- Gibson, L. J. The hierarchical structure and mechanics of plant materials. J. R. Soc. Interface. , (2012).
- Monn, M. A., Kesari, H. A new structure-property connection in the skeletal elements of the marine sponge Tethya aurantia that guards against buckling instability. Sci. Rep. 7, (2017).
- Monn, M. A., Weaver, J. C., Zhang, T., Aizenberg, J., Kesari, H. New functional insights into the internal architecture of the laminated anchor spicules of Euplectella aspergillum. Proc. Natl. Acad. Sci. U.S.A. 112 (16), 4976-4981 (2015).
- Monn, M. A., Kesari, H. Enhanced bending failure strain in biological glass fibers due to internal lamellar architecture. J. Mech. Behav. Biomed. Mater. , (2017).
- Levi, C., Barton, J. L., Guillemet, C., Bras, E., Lehuede, P. A remarkably strong natural glassy rod: the anchoring spicule of the Monorhaphis sponge. J. Mater. Sci. Letters. 8 (3), 337-339 (1989).
- Kesari, H., Doll, J. C., Pruitt, B. L., Cai, W., Lew, A. J. Role of surface roughness in hysteresis during adhesive elastic contact. Philos. Mag. Lett. 90 (12), 891-902 (2010).
- Croisier, F., et al. Mechanical testing of electrospun PCL fibers. Acta Biomater. 8 (1), 218-224 (2012).
- Haque, M. A., Saif, M. T. A review of MEMS-based microscale and nanoscale tensile and bending testing. Exp. Mech. 43 (3), 248-255 (2003).
- Gudlavalleti, S. . Mechanical testing of solid materials at the micro-scale. , (2002).
- Tohmyoh, H., Ishihara, M., Akanda, M. S., Yamaki, S., Watanabe, T., Iwabuchi, T. Accurate determination of the structural elasticity of human hair by a small-scale bending test. J. Biomech. 44 (16), 2833-2837 (2011).
- Waters, J. F. . Contact mechanics of biologically-inspired interface geometries. , (2009).
- Dai, Z., Gorb, S. N., Schwarz, U. Roughness-dependent friction force of the tarsal claw system in the beetle Pachnoda marginata (Coleoptera, Scarabaeidae). J. Exp. Biol. 205 (16), 2479-2488 (2002).
- Tramacere, F., Kovalev, A., Kleinteich, T., Gorb, S. N., Mazzolai, B. Structure and mechanical properties of Octopus vulgaris suckers. J. R. Soc. Interface. 11 (91), (2014).
- Ehrlich, H., et al. Nanostructural organization of naturally occurring composites: Part I. Silica-Collagen-based biocomposites. J. Nanomater. 53, (2008).
- Ehrlich, H., et al. Mineralization of the meter-long biosilica structures of glass sponges is templated on hydroxylated collagen. Nat. Chem. 2, 1084-1088 (2010).
- Ehrlich, H., et al. First evidence of the presence of chitin in skeletons of marine sponges. Part II. Glass sponges (Hexactinellida: Porifera). J. Exp. Zoo. 308 (4), 473-483 (2007).
- Ehrlich, H. Chitin and collagen as universal and alternative templates in biomineralization. Int. Geol Rev. 52, 661-699 (2010).
- Ehrlich, H., et al. Supercontinuum generation in naturally occurring glass sponge spicules. Adv. Opt. Mater. 4 (10), 1608-1613 (2016).
- Ehrlich, H., et al. Calcite reinforced silica-silica joints in the biocomposite skeleton of deep-sea glass sponges. Adv. Funct. Mater. 21, 3473-3481 (2011).
- Werner, P., Blumtritt, H., Zlotnikov, I., Graff, A., Dauphin, Y., Fratzl, P. Electron microscope analyses of the bio-silica basal spicule from the Monorhaphis chuni sponge. J. Struct. Biol. 191 (2), 165-174 (2015).
- Kolednik, O., Predan, J., Fischer, F. D., Fratzl, P. Bioinspired Design Criteria for Damage-Resistant Materials with Periodically Varying Microstructure. Adv. Funct. Mater. 21 (19), 3634-3641 (2011).
- Weaver, J. C., et al. Unifying design strategies in demosponge and hexactinellid skeletal systems. J. Adhes. 86 (1), 72-95 (2010).
- Walter, S. L., Flinn, B. D., Mayer, G. Mechanisms of toughening of a natural rigid composite. Mater. Sci. Eng. C. 27 (3), 570-574 (2007).
- Ehrlich, H. Silica biomineralization in Sponges. Encyclopedia of Geobiology. , 796-808 (2011).
- Zlotnikov, I., Werner, P., Fratzl, P., Zolotoyabko, E. Eshelby Twist as a possible source of lattice rotation in a perfectly ordered protein/silica structure grown by a simple organism. Small. 11 (42), 5636-5641 (2015).
- Zlotnikov, I., et al. A perfectly periodic three-dimensional protein/silica mesoporous structure produced by an organism. Adv. Mater. 26 (11), 1682-1687 (2014).
- Gere, J. M., Timoshenko, S. P. Chapter 5: Stresses in Beams. Mechanics of materials. , 205-217 (1997).
- Baratta, F. I., Matthews, W. T., Quinn, G. D. . Errors associated with flexure testing of brittle materials. , (1987).
- Quinn, G. D., Sparenberg, B. T., Koshy, P., Ives, L. K., Jahanmir, S., Arola, D. D. Flexural strength of ceramic and glass rods. J. Test. Eval. 37 (3), 1-23 (2009).
- Tattersall, H. G., Tappin, G. The work of fracture and its measurement in metals, ceramics and other materials. J. Mater. Sci. 1 (3), 296-301 (1966).

