Enzimatik Cascade reaksiyonlardan L-lizin Amino kiral alkoller sentezi için
Summary
Kiral amino alkoller çok yönlü kullanım için iskele organik sentezinde moleküllerdir. L-lizin başlayarak, biz sentez amino alkoller-diastereoselective C-H oksidasyon karboksilik asit yan tarafından karşılık gelen hidroksil amino asitin bölünme ardından dioxygenase tarafından katalize birleştiren bir enzimatik cascade tepki bir dekarboksilaz.
Abstract
Amino alkoller geniş bir uygulama yelpazesi ile çok yönlü bileşiklerdir. Örneğin, Organik sentez kiral iskele olarak kullanılmıştır. Onların sentez geleneksel organik kimya tarafından genellikle sıkıcı Multi-step sentez işlemlerle stereochemical sonucu zor kontrol gerektirir. Enzimatik synthetize amino alkoller hazır L-lizin 48 h dan başlayan bir iletişim kuralına tanıtacağız. Bu iletişim kuralı tarafından geleneksel Organik sentez yapmak çok zor olan iki kimyasal reaksiyonlar birleştirir. İlk adım, regio – ve diastereoselective oksidasyon lizin unactivated bir C-H bağı içinde yan zincir dioxygenase tarafından katalizlenir; regiodivergent dioxygenase tarafından katalize ikinci bir regio – ve diastereoselective oksidasyon 1,2-diols oluşumuna yol açabilir. Son adımda, karboksilik grubu Alfa amino asitin piridoksal-fosfat (PIP) dekarboksilaz (DC) tarafından i ciddi. Decarboxylative bu adımı yalnızca stereogenic hidroksi yerine merkezi bir beta/gama pozisyonda istinat amino asit, Alfa karbon etkiler. Elde edilen amino alkoller bu nedenle optik zenginleştirilmiş. Protokol dört amino alkoller semipreparative ölçekli sentezi başarıyla uygulandı. Tepkileri izleme yüksek performanslı sıvı Kromatografi (HPLC) tarafından derivatization sonra 1-fluoro-2,4-dinitrobenzene tarafından yapılmıştır. Basit arıtma katı fazlı ayıklama (SPE) tarafından tanınan mükemmel verimleri ile amino alkoller (%93 > % 95).
Introduction
Yararları biocatalysis tarafından sunulan rağmen sentetik yolları veya toplam biocatalytic yolları biocatalytic adımları Tümleştirme çoğunlukla enzimatik Kinetik çözünürlükleri için sınırlı kalır. Bu yolları asimetrik kemoterapi enzimatik sentez bir ilk adım olarak yaygın olarak kullanılmış olan ama biocatalysis fonksiyonel grup interconversions yüksek stereoselectivity1,2,3 ile çok daha fazla olanak sunuyor . Biocatalytic reaksiyonlar benzer koşullarda yapılmaktadır Ayrıca, bu nedenle cascade reaksiyonlar bir one-pot moda4,5‘ te gerçekleştirmek için uygun olduğu.
Kiral amino alkoller çok yönlü kullanım için yardımcı ya da Organik sentez6iskele olarak moleküllerdir. Amino alkol yan sık Sekonder metabolitler ve ilaç aktif maddeleri (API) bulunur. Birincil β-amino alkoller kiral γ-amino alkoller için kolayca karşılık gelen α-amino asitler konvansiyonel kimyasal sentez, ancak access tarafından kullanılabilir veya ikincil amino alkoller genellikle sıkıcı sentetik yolları ile birlikte duyarlı gerektirir Denetim stereokimya7,8,9,10. Onun yüksek stereoselectivity nedeniyle biocatalysis bu kiral yapı taşları11,12,13,14için üstün bir sentetik yol sağlayabilir.
Daha önce diastereoselective enzimatik prokollajen demir (II) dioxygenases tarafından katalize tarafından sentez, mono – ve di-hidroksi-L-lysines rapor / α-ketoacid-bağımlı Siklooksijenaz aile (αKAO) (Resim 1)15. Özellikle, L-lizin başlayarak, KDO1 dioxygenase (3S) – hidroksi türev (1), (4R) süre – tromboksan türev (2) KDO2 dioxygenase ile reaksiyonu tarafından oluşturulur. Art arda gelen regiodivergent hydroxylations KDO1 ve KDO2 tarafından kurşun oluşumu (3R, 4R) için – dihidroksi – L-lizin optik saf formu (3). Ancak, karboksilik asit yan pozisyonda α-amino grubu etkinliği16için gerekli olduğu gibi bu enzimler sınırlı substrat dizi onların büyük kullanımı basit aminler, prokollajen başta kimyasal sentez içinde engellemektedir.
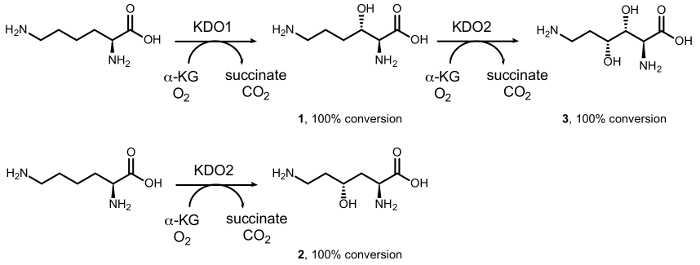
Şekil 1: L-lizin Biocatalytic dönüştürülme. Dönüşüm (3S) içine – hidroksi – L-lizin KDO1 dioxygenase tarafından; katalize (1) (4R) – hidroksi – L-lizin KDO2 dioxygenase tarafından; katalize (2) ve (3R, 4R) – dihidroksi – L-lizin (3) art arda sıralı tepki gittikçe KDO1 ve KDO2 dioxygenases tarafından katalize. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
Decarboxylation metabolizma17ortak bir tepkidir. Özellikle, amino asit DCs (EC 4.1.1) kofaktör-ücretsiz (pyruvoyl bağlıdır) ya da PIP-bağımlı enzim ve bakteriler ve daha yüksek organizmaların18,19 ilgili polyamines içine decarboxylation amino asitlerin katalizler , 20 , 21 , 22. de mono – ve dihidroksi bileşikler (şekil 3) 4–7, 10–11 hydroxylated cadaverine, L-lizin decarboxylation tarafından elde edilen diamin karşılık gelir. Cadaverine kimya sanayî için önemli bir yapı taşı, özellikle bu poliamid ve poliüretan polimerlerin bir bileşendir. Bu nedenle, biyo-esaslı üretimini bu diamin yenilenebilir kaynaklardan gelen petrol bazlı rota alternatif olarak dikkat çekti ve çeşitli mikroorganizmalar bu amaç için tasarlanmış. Bu metabolik yollar, lizin DC (LDC) anahtar enzimdir. LDC alanin racemase (AR) yapısal aile23için ait PLP-bağımlı bir enzimdir. PIP-bağımlı DCs (PIP-DCs) yüksek substrat özgü olduğu bilinmektedir. Ancak, bazı enzimler hafif karışıklık, örneğin LDC Selenomonas rumirantium (LDCSrum), düşük olarak L-Ornitin ve L-lizin amino asitler doğru aktif varlık yeteneği kendi benzer Kinetik sabitler için sahip olduğu Lisin ve ornithine decarboxylation24,25. Bu genişletilmiş substrat özgüllüğü Bu enzim, mono – ve di-hidroksi-L-lizin decarboxylation için iyi bir aday yapar. Buna ek olarak, DCs etkin lizin Hidroksil türevleri doğru bulmak için biz αKAO enzimler kodlama genler genomik bağlamında inceledi. Nitekim, prokaryotik genleri enzimler aynı biyosentetik yolu dahil kodlama genler genellikle gen kümelerde co lokalizedir. KDO2 ( Chitinophaga pinensis)’dan gen sözde PLP-DC (Şekil 2) kodlama bir gen ile birlikte lokalize bulundu. Buna ek olarak, hiçbir gen DC için kodlama KDO1 dioxygenase genomik bağlamında analiz ederken bulundu. C. pinensis (DCCpin) PLP-DC protein bu nedenle cascade tepki decarboxylation adımında katalizler umut verici adayı olarak seçildi.
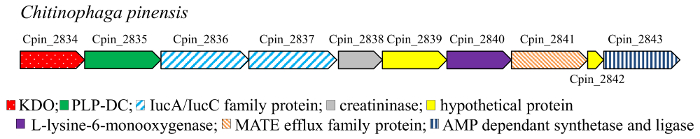
Şekil 2: C. pinensisKDO2 geni genomik bağlamında. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
Sonuç olarak, enzimatik cascade reaksiyonlar içeren dioxygenases ve DCs gelen amino asitler (şekil 3) Alifatik kiral β ve γ-amino alkoller sentezi elde etmek için tasarlanmış. Önceden bildirildiği gibi αKAO tarafından katalize C-H oksidasyon hidroksi yerine stereogenic Merkezi ile toplam diastereoselectivity tanıtır; Cβ/γ sembolik-ecek var olmak saklı içinde belgili tanımlık decarboxylative adım, amino asit yan16Cα karbon sadece etkileyen.
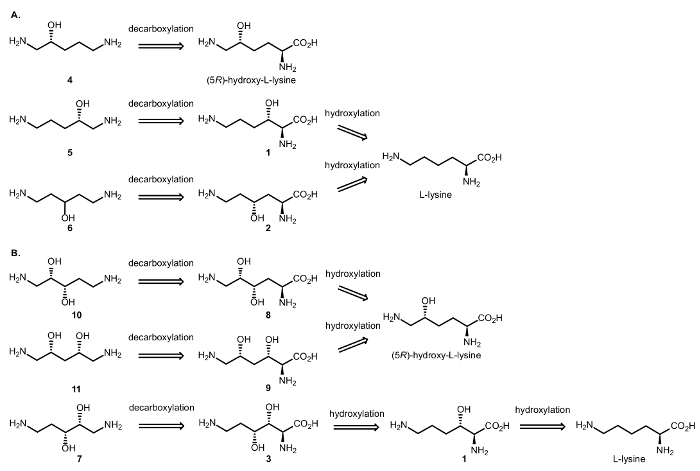
Şekil 3: Retrosynthetic analiz. (A)Retrosynthesis β ve γ amino alkoller (R) – 1,5 – diaminopentan-2-ol, (4) (5R) – hidroksi – L-lizin ve (S) – 1,5 – diaminopentan-2-ol (5) ve 1,5-diaminopentan-3-ol (6) dan L-lizin. (B) Retrosynthesis – 1,5 – β, γ – ve β, δ-amino diols (2S, 3S) diaminopentane-2,3-diol (10) ve (2R, 4S) – 1,5 – diaminopentane-2,4-diol (11) (5R) başlangıç- hidroksi-L-lizin ve (2R, 3R) – 1,5 – diaminopentane-2,3-diol (7) L-lizin başlayarak. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
L-lizin ve onun (5R) başlayan-hidroksi Türev, biz burada rapor bir iki/üç adım, tek bir kap, enzimatik yordamı dioxygenases ve amino alkoller hedef almak için PIP-DCs birleştirerek. Önceden bir sentez hedef molekülleri laboratuvar ölçekte reaksiyon koşulları, örneğin, başlangıç malzemelerin; tam dönüşüm sağlamak için gerekli enzim konsantrasyonları ayarlamak için analitik ölçekte yöntem geliştirildi Biz bu yordamı de mevcut.
Protocol
Representative Results
Discussion
Kiral amino alkoller ve türevleri uygulamalardan kiral benzerleri ilaç tedavisi için Organik sentez için geniş bir aralığı vardır. Amino alkoller tarafından geleneksel Organik sentez üretmek için multistep sentez çoktur, ama her zaman sıkıcı koruma/deprotection adımları ile birlikte stereokimya16hassas bir denetim nedeniyle etkili olmayabilir. Koruma/deprotection adımlarla dağıtır ve genellikle stereoselective son derece biocatalytic bir yaklaşım iyi bir alternatif temsil e…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Yazarlar Véronique de Berardinis verimli tartışma ve Alain Perret, Christine Pellé ve Peggy Sirvain teknik destek için teşekkür ederiz.
Materials
| HEPES | Sigma Aldrich | H3375 | |
| L-lysine hydrochloride | Sigma Aldrich | L5626 | |
| (5S)-hydroxy-L-lysine | Sigma Aldrich | GPS NONH | Out sourcing |
| α-ketoglutaric acid | Sigma Aldrich | 75892 | |
| Sodium ascorbate | Sigma Aldrich | A7631 | |
| Ammonium Iron(II) sulfate hexahydrate | Acros | 201370250 | |
| Pyridoxal phosphate (PLP) | Sigma Aldrich | 82870 | |
| 3,4-dimercaptobutane-1,2-diol (DTT) | Sigma Aldrich | D0632 | |
| 1-fluoro-2,4-dinitrobenzene (DNFB) | Sigma Aldrich | D1529 | |
| Ethanol | VWR | 20825.290 | |
| Sodium hydrogen carbonate | Sigma Aldrich | 71631 | |
| HCl 37% | Sigma Aldrich | 435570 | |
| HCl 0.1M | Fluka | 35335 | |
| Acetonitrile HiPerSolv CHROMANORM for LC-MS | VWR | 83640.320 | |
| 2,2,2-trifluoroacetic acid | VWR | 153112E | |
| Ammonia 28% | VWR | 21182.294 | |
| Methanol HiPerSolv CHROMANORM for LC-MS | VWR | 83638.32 | |
| Formic acid | Acros | 270480010 | |
| Phosphoric acid 85% | Acros | 201145000 | |
| Deuterium oxide | Acros | 320,710,075 | |
| NaOH | Sigma Aldrich | S5881 | |
| C18 HPLC column | Phenomenex | 00F-4601-Y0 | |
| Accela UHPLC System | ThermoFisher Scientific | ||
| Accela PDA detector | ThermoFisher Scientific | ||
| 4mm syringe filters – 0,22µm – PVDF | Merck | SLGVR04NL | |
| Single-use tuberculin syringe with ml graduation, Luer tip | VWR | HSWA5010.200V0 | |
| Cation exchange resin 100-200 mesh | Sigma Aldrich | 217506 | |
| Mixed mode cation-exchange solid-phase extraction cartridge 6 mL | Waters | 186000776 | |
| Extraction manifold | Waters | WAT200609 | |
| Rotary evaporator | Büchi | 531-0103 | |
| Lyophilizer alpha 1-2 LDplus | Christ | L083302 | |
| Micropipette 20 µL | Eppendorf | 3121000031 | |
| Micropipette 100 µL | Eppendorf | 3121000074 | |
| Micropipette 500 µL | Eppendorf | 3121000112 | |
| Micropipette 1000 µL | Eppendorf | 3121000120 | |
| 300 MHz spectrometer | Bruker | ||
| 2 mL microtube | CLEARLine | CL20.002.0500 | |
| 50 mL conical-bottom centrifuge tube | Fischer Scientific | 05-539-8 | |
| 25 mL round-bottom flask 14/23 | Fischer Scientific | 10353331 | |
| 100 mL round-bottom flask 29/32 | Fischer Scientific | 11786183 | |
| 250 mL round-bottom flask 29/32 | Fischer Scientific | 11786183 | |
| 250 mL erlenmeyer flask | Fischerbrand | 15496143 |
References
- Nestl, B. M., Hammer, S. C., Nebel, B. A., Hauer, B. New Generation of Biocatalysts for Organic Synthesis. Ang. Chem. Int. Ed. 53 (12), 3070-3095 (2014).
- Reetz, M. T. Biocatalysis in Organic Chemistry and Biotechnology: Past, Present, and Future. J. Am. Chem. Soc. 135 (34), 12480-12496 (2013).
- Turner, N. J., O’Reilly, E. Biocatalytic retrosynthesis. Nat. Chem. Biol. 9 (5), 285-288 (2013).
- Oroz-Guinea, I., Garcia-Junceda, E. Enzyme catalysed tandem reactions. Curr. Opin. Chem. Biol. 17 (2), 236-249 (2013).
- Ricca, E., Brucher, B., Schrittwieser, J. H. Multi-Enzymatic Cascade Reactions: Overview and Perspectives. Adv. Syn. Catal. 353 (13), 2239-2262 (2011).
- Ager, D. J., Prakash, I., Schaad, D. R. 1,2-Amino Alcohols and Their Heterocyclic Derivatives as Chiral Auxiliaries in Asymmetric Synthesis. Chem. Rev. 96 (2), 835-876 (1996).
- Abiko, A., Masamune, S. An improved, convenient procedure for reduction of amino acids to aminoalcohols: Use of NaBH4-H2SO4. Tet. Lett. 33 (38), 5517-5518 (1992).
- McKennon, M. J., Meyers, A. I., Drauz, K., Schwarm, M. A convenient reduction of amino acids and their derivatives. J. Org. Chem. 58 (13), 3568-3571 (1993).
- Singh, P., Samanta, K., Das, S. K., Panda, G. Amino acid chirons: a tool for asymmetric synthesis of heterocycles. Org. Biomol. Chem. 12 (33), 6297-6339 (2014).
- Colomer, I., et al. Aminomethylhydroxylation of alkenes: Exploitation in the synthesis of scaffolds for small molecule libraries. Bioorg. Med. Chem. 23 (11), 2736-2740 (2015).
- Steinreiber, J., et al. Synthesis of Aromatic 1,2-Amino Alcohols Utilizing a Bienzymatic Dynamic Kinetic Asymmetric Transformation. Adv. Syn. Catal. 349 (8-9), 1379-1386 (2007).
- Steinreiber, J., et al. Overcoming Thermodynamic and Kinetic Limitations of Aldolase-Catalyzed Reactions by Applying Multienzymatic Dynamic Kinetic Asymmetric Transformations. Ang. Chem. Int. Ed. 46 (10), 1624-1626 (2007).
- Kohls, H., et al. Selective Access to All Four Diastereomers of a 1,3-Amino Alcohol by Combination of a Keto Reductase- and an Amine Transaminase-Catalysed Reaction. Adv. Syn. Catal. 357 (8), 1808-1814 (2015).
- Sehl, T., Maugeri, Z., Rother, D. Multi-step synthesis strategies towards 1,2-amino alcohols with special emphasis on phenylpropanolamines. J. Mol. Cat. B: Enzymatic. 114, 65-71 (2015).
- Martinez, S., Hausinger, R. P. Catalytic Mechanisms of Fe(II)- and 2-Oxoglutarate-dependent Oxygenases. J. Biol. Chem. 290 (34), 20702-20711 (2015).
- Baud, D., et al. Synthesis of Mono‐and Dihydroxylated Amino Acids with New α‐Ketoglutarate‐Dependent Dioxygenases: Biocatalytic Oxidation of C-H Bonds. ChemCatChem. , (2014).
- Suzuki, H., Kurihara, S., Kusano, T., Suzuki, H. Ch. 4. Polyamines. 4, 47-59 (2015).
- Kind, S., Wittmann, C. Bio-based production of the platform chemical 1,5-diaminopentane. Appl. Microbiol. Biotechnol. 91 (5), 1287-1296 (2011).
- Schneider, J., Wendisch, V. F. Biotechnological production of polyamines by bacteria: recent achievements and future perspectives. Appl. Microbiol. Biotechnol. 91 (1), 17-30 (2011).
- Qian, Z. -. G., Xia, X. -. X., Lee, S. Y. Metabolic engineering of Escherichia coli for the production of cadaverine: A five carbon diamine. Biotechnol. Bioeng. 108 (1), 93-103 (2011).
- Shin, J. H., Lee, S. Y. Metabolic engineering of microorganisms for the production of L-arginine and its derivatives. Microb. Cell. Fact. 13, (2014).
- Nguyen, A., Schneider, J., Reddy, G., Wendisch, V. Fermentative Production of the Diamine Putrescine: System Metabolic Engineering of Corynebacterium Glutamicum. Metabolites. 5 (2), 211 (2015).
- Kidron, H., Repo, S., Johnson, M. S., Salminen, T. A. Functional Classification of Amino Acid Decarboxylases from the Alanine Racemase Structural Family by Phylogenetic Studies. Mol. Biol. Evol. 24 (1), 79-89 (2007).
- Takatsuka, Y., Onoda, M., Sugiyama, T., Muramoto, K., Tomita, T., Kamio, Y. Novel Characteristics of Selenomonas ruminantium Lysine Decarboxylase Capable of Decarboxylating Both L-Lysine and L-Ornithine. Biosci. Biotechnol. Biochem. 63 (6), 1063-1069 (1999).
- Takatsuka, Y., Tomita, T., Kamio, Y. Identification of the Amino Acid Residues Conferring Substrate Specificity upon Selenomonas ruminantium Lysine Decarboxylase. Biosci. Biotechnol. Biochem. 63 (10), 1843-1846 (1999).
- Baud, D., et al. Biocatalytic Approaches towards the Synthesis of Chiral Amino Alcohols from Lysine: Cascade Reactions Combining alpha-Keto Acid Oxygenase Hydroxylation with Pyridoxal Phosphate- Dependent Decarboxylation. Adv. Syn. Catal. 359 (9), 1563-1569 (2017).
- Ilisz, I., Berkecz, R., Peter, A. Application of chiral derivatizing agents in the high-performance liquid chromatographic separation of amino acid enantiomers: a review. J. Pharm. Biomed. Anal. 47 (1), 1-15 (2008).
- . Organic Chemistry. Nuclear Magnetic Resonance (NMR) Spectroscopy Available from: https://www.jove.com/science-education/5680/nuclear-magnetic-resonance-nmr-spectroscopy (2017)
- Hibi, M., Ogawa, J. Characteristics and biotechnology applications of aliphatic amino acid hydroxylases belonging to the Fe(II)/alpha-ketoglutarate-dependent dioxygenase superfamily. Appl. Microbiol. Biotechnol. 98 (9), 3869-3876 (2014).
- Hüttel, W. Biocatalytic Production of Chemical Building Blocks in Technical Scale with α-Ketoglutarate-Dependent Dioxygenases. Chem. Ing. Tec. 85 (6), 809-817 (2013).
- Kourist, R., Guterl, J. -. K., Miyamoto, K., Sieber, V. Enzymatic Decarboxylation-An Emerging Reaction for Chemicals Production from Renewable Resources. ChemCatChem. 6 (3), 689-701 (2014).
- Lee, J., Michael, A. J., Martynowski, D., Goldsmith, E. J., Phillips, M. A. Phylogenetic diversity and the structural basis of substrate specificity in the beta/alpha-barrel fold basic amino acid decarboxylases. J. Biol. Chem. 282 (37), 27115-27125 (2007).
- Porter, J. L., Rusli, R. A., Ollis, D. L. Directed Evolution of Enzymes for Industrial Biocatalysis. ChemBiochem. 17 (3), 197-203 (2016).

