Misurazione standardizzato di differenza di potenziale Transepithelial membrana nasale (NPD)
Summary
Qui, presentiamo un protocollo standardizzato per misurare la differenza di potenziale nasale (NPD). Regolatore di conduttanza del transmembrane di fibrosi cistica (CFTR) ed epiteliale del sodio (ENaC) canale funzione vengono valutati dal cambiamento nella tensione attraverso l’epitelio nasale dopo superfusione di soluzioni che modificano l’attività del canale ionico, fornendo un misura di risultato.
Abstract
Descriviamo una misura standardizzata della differenza di potenziale nasale (NPD). In questa tecnica, regolatore di conduttanza del transmembrane di fibrosi cistica (CFTR) e la funzione di canale (ENaC) epiteliale del sodio sono monitorati dal cambiamento nella tensione attraverso l’epitelio nasale dopo superfusione di soluzioni in grado di modificare il canale ionico attività. Questo è abilitato per la misurazione della differenza di potenziale tra il compartimento sottocutaneo e l’epitelio delle vie aeree nella narice, utilizzando un catetere a contatto con turbinate nasale inferiore.
Il test permette di misurare la tensione di linea di base stabile e i cambiamenti di tensione di rete successivi dopo aspersione di 100 µM amiloride, un inibitore del riassorbimento di Na+ in soluzione di Ringer; una soluzione esente da cloruri contenente amiloride alla secrezione di cloruro in auto e 10 µM isoproterenolo in una soluzione di cloruro-free con amiloride per stimolare il monofosfato di adenosina ciclico (cAMP)-conduttanza dipendente cloruro legate alla CFTR.
Questa tecnica ha il vantaggio di dimostrare le proprietà elettrofisiologiche dei due componenti chiave che istituisce l’idratazione del liquido di superficie delle vie aeree dell’epitelio respiratorio, ENaC e CFTR. Pertanto, è uno strumento di ricerca utile per la fase 2 e la prova di test di concetto di agenti destinati a attività CFTR ed ENaC per il trattamento delle malattie polmonari di fibrosi cistica (CF). È anche una procedura di follow-up chiave per stabilire la disfunzione CFTR quando test genetici e test del sudore sono ambigui. A differenza di cloruro di sudore, il test è relativamente più lungo e costoso. Richiede anche la formazione degli operatori e le competenze per condurre il test in modo efficace. Variabilità inter – e intra – soggetto è stata segnalata in questa tecnica, soprattutto in soggetti giovani o non collaboranti. Per facilitare questa preoccupazione, interpretazione è stata migliorata attraverso un algoritmo recentemente convalidato.
Introduction
L’obiettivo generale di questo metodo è quello di misurare la differenza di potenziale nasale (NPD) che mira a indagare il trasporto trans-epiteliale dello ione in vivo1. Questa tecnica permette la misurazione di sodio (Na+) e trasporto del cloruro (Cl–). NPD è stato utilizzato come strumento di ricerca dalla fine del 1980 ed è stato accettato nel 1998 come una procedura diagnostica nella dichiarazione di consenso Cystic Fibrosis Foundation (CFF)2 e nel 2017 in linee guida diagnostico di consenso la Cystic Fibrosis Foundation (CFF) 3. infatti, disfunzione CFTR biologica, che è la causa della fibrosi cistica, è testimoniata da un aumentato assorbimento di Na+ a membrana apicale e un difetto nella secrezione di Cl– . Questo test funzionale offre il vantaggio di uno strumento di diagnosi aggiuntiva quando genetica è non conclusiva in pazienti con sudore intermedio indeterminato test risultati3. Anche se queste informazioni possono essere ottenute anche da biopsie intestinali di misurazione corrente (ICM), ICM è, tuttavia, solo disponibile in pochi centri a livello mondiale e maggiori esigenze di standardizzazione. NPD è più disponibile in circa 60 centri globali e, inoltre, gli obiettivi dell’epitelio respiratorio che è la sede principale della malattia.
Dato le informazioni che fornisce attività di CFTR, viene anche usato nella prova di studi volti a valutare il ripristino funzionale della proteina CFTR dal modulatore terapie4,5,6,7, 8. Infatti, i dati dagli studi di CFTR mRNA/gene editing, potenziatore CFTR e terapie di correttore, evidenziano cambiamenti significativi in Cl– e Na+ di trasporto con terapia6,9 e conferma che il NPD può essere un reattivo endpoint in sperimentazioni cliniche. Come ci mancano punti finali clinici sensibili in grado di rilevare un sottile cambiamento dello stato clinico del paziente in tempi brevi, questo biomarcatore preclinico potrebbe essere altamente informativo. Campo delle terapie di modulatore CFTR allarga rapidamente e abbiamo urgente bisogno di prove in vivo che sono in grado di decifrare rapidamente composti attivi prima di andare a grande fase 3 prove10.
Il fisiologico razionale della tecnica si basa sulla misurazione della differenza di potenziale tra l’epitelio delle vie aeree nella narice e il compartimento sottocutaneo. Attività della scanalatura dello ione sono esplorati misurando la differenza di potenziale massima linea di base stabile (PD), suoi cambiamenti dopo blocco ENaC relativo assorbimento di Na+ e secrezione di Cl– di guida via apicale Cl– diversi trasportatori tra cui CFTR. Disfunzione CFTR è indicata da un cambiamento minimo in differenza di potenziale attraverso la stimolazione della secrezione di Cl– attraverso una via cAMP dipendente e un’aumentata ENaC mediata assorbimento di Na+ come rilevato da una differenza di potenziale di previsione negativa e una risposta migliorata di amiloride. La base meccanicistica per CF contro PD normale è riassunto nella Figura 1.
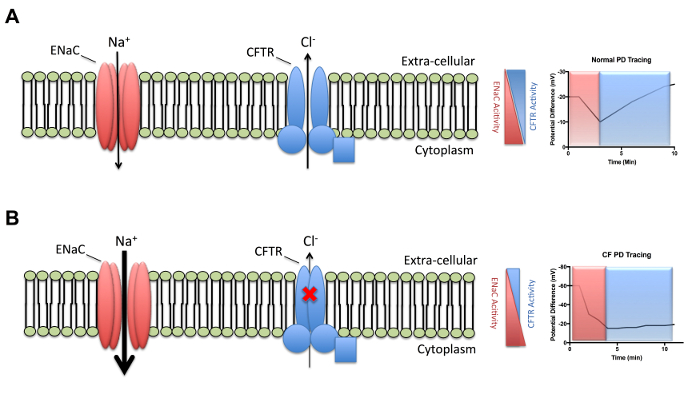
Figura 1: riepilogo figura dell’attività del canale ionico. Agli ioni di (A) attività nel dimostrare epitelio respiratorio equilibrata attività di ENaC e CFTR in soggetti normali e (B) perdita di attività CFTR conseguente aumentato trasporto del sodio ENaC mediata e ridotto dipendente cloruro CFTR trasporto. ENaC: canale epiteliale del sodio, Na+: sodio, CFTR: regolatore del transmembrane di fibrosi cistica, CL–: cloruro, mV: millivolt, PD: differenza di potenziale, min: minuti/s Clicca qui per visualizzare una versione più grande di questa figura.
Tuttavia, questo test dimostra un certo grado di variabilità sia a misure ripetute all’interno del paziente stesso e tra i pazienti con lo stesso genotipo. Questo è della massima importanza per facilitare l’interpretazione dei cambiamenti dopo il trattamento di modulatore. Inoltre, ci manca ancora convalidate soglie discriminare tra CF e soggetti sani. Ciò può essere parzialmente dovuto le differenze tra la disponibilità di strutture cliniche e le tecniche impiegate. Di conseguenza, un notevole sforzo internazionale finalizzato alla standardizzazione del test è in corso. Sia il noi CFF-TDN (Cystic Fibrosis Foundation-Therapeutics Development Network) ed ECFS-CTN (European Cystic Fibrosis Society-clinici prove Network) ha creato un NPD Procedure operative Standard (SOP) per l’uso nelle prove di ricerca e studio multicentrico. Questo recente lavoro collaborativo dal CTN e TDN ha provocato una SOP combinata, internazionale, che riunisce le competenze del CTN e TDN (2014)11. Questa carta presenta le tecniche di protocollo e prova per impiegare NPD per diagnosi di CF o avviati studi di proof-of-concept. Ogni centro la tecnica di esecuzione è responsabile per l’applicazione al suo comitato di etica istituzionale ricerca umana per l’approvazione.
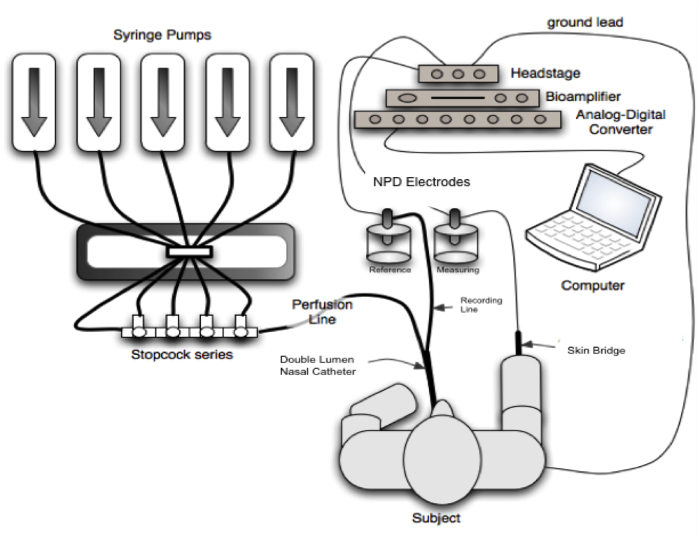
Figura 2: schema della intera NPD configurazione consigliata. Si noti che la configurazione consigliata è dimostrata, tra cui pompa di perfusione sequenziale e l’installazione di serie 4-fermata-gallo. Connessioni specifiche ed esempi di componenti sono mostrati nel SOP. (Diagramma modificato con il permesso di Solomon, G.M. petto, 201013) Clicca qui per visualizzare una versione più grande di questa figura.
Il flusso generale sperimentale è descritta nella Figura 2, per cui NPD è misurato tra il ponte di esplorare posizionato sul ponte epitelio di superficie e riferimento collocati nello spazio sottocutaneo, entrambe collegate con elettrodi e un’ad alta impedenza voltmetro.
Questo è assicurato da 2 sistemi differenti: ci sono 2 Setup di elettrodo di riferimento accettabile: (i) bilanciato Ag/AgCl elettrodi e un ponte di crema di elettrocardiogramma (ECG) collegato allo spazio sottocutaneo di leggera abrasione o (ii) saturato calomelano Semicelle e un agar riempito calibro 22 – 24 ago introdotto per via sottocutanea. Il contatto con la mucosa nasale è attivato da un catetere a doppio lume. Un lumen è riempito con agar o crema di ECG e collegato all’elettrodo di misura, l’altro permette di aspersione sulla mucosa nasale delle diverse soluzioni.
La punta del tubo di esplorazione viene posizionata sulla mucosa respiratoria sotto l’inferiore nasale dei turbinati (Figura 3).
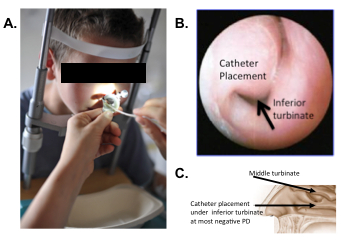
Figura 3: posizionamento di esplorare tubi sulla mucosa respiratoria. Posizionamento di visualizzando Vista esterna (A). (B) Rhinoscopic vista dimostrando di posizionamento. Diagramma (C) che indica la posizione anatomica per il posizionamento del catetere. PD: differenza di potenziale
Per studiare la risposta del PD a parecchie droghe, le soluzioni di sopraffusione vengono applicate tramite il secondo lume del catetere. Ci sono diversi passaggi chiave per quanto riguarda la preparazione e lo svolgimento delle misurazioni di NPD, che sono descritte di seguito nel protocollo, dalla preparazione iniziale attraverso all’analisi dei dati.
Dopo la preparazione di soluzioni ed elettrodi, qualità adeguate prove di elettrodi e cateteri permette per la condotta di base del test. Misure basali sono effettuate lungo il turbinato, inferiore che consente di selezionare il posto migliore per la misura, solitamente che con la misura più negativa. Quindi le aspersioni sequenziale determinano Na+ (ENaC) e Cl– flusso ionico (CFTR-dipendente) attraverso un cambiamento nella tensione attraverso l’epitelio nasale.
Protocol
Representative Results
Discussion
In vivo, NPD fornisce una misurazione uniche che possa essere eseguita ripetutamente su base longitudinale e dimostra che con misure ripetute, simili risultati longitudinali sono osservate su una base individuale e group-wise14, 15. C’è forte evidenza che la NPD ha validità di eccellente discriminazione per distinguere CF da non CF. 25 studi ha dimostrato costantemente una differenza statisticamente significativa nella Cl– e Na+ conduttanza tra pazienti CF e controlli sani10. Mentre parecchi indici precedentemente sviluppati dimostrano questa capacità, possiamo anticipare che sono necessari nuovi aggiornamenti dato recente standardizzazione della metodologia7,8.
Le modifiche e la risoluzione dei problemi
Questo test richiede diversi passaggi chiave per assicurare misure accurate. Questo include l’offset del ciclo chiuso elettrodi e cateteri per garantire che il sistema sta eseguendo a norme raccomandate. I pazienti devono rimanere fermi e astenersi dal parlare come questo riduce al minimo gli artefatti e dislocazione del catetere. Questo rende il test difficile in pazienti non cooperativi e la tecnica è stata segnalata soltanto in uno studio nei bambini sotto i 6 anni di età7.
Pre-ispezione dell’epitelio nasale è necessario garantire che non esistono croste o muco sull’epitelio, che può influire sulle misurazioni.
Cosa molto importante, si deve sottolineare che la posizione del posizionamento del catetere è oggetto di dibattito. Il SOP qui presentato utilizza misura sotto il turbinato inferiore (IT). Il posizionamento del catetere sotto esso è stato standardizzato e condotto nei trials multicentrici e, di conseguenza, questa è la tecnica consigliata. Misura sotto l’IT viene eseguita con il catetere foro laterale, che può essere difficile da mantenere in costante contatto con la mucosa nasale, pur essendo a contatto con le soluzioni. Altri gruppi possono misurare il PD al piano nasale, che è tecnicamente più facile. D’importanza, Vermeulen (2011) hanno dimostrato che i 2 metodi sono comparabili16.
Il riscaldamento delle soluzioni rimane un aspetto del dibattito tra europei e centri statunitensi17,18. Esso è stato sostenuto che l’utilizzo di soluzioni a 37 ° C invece di 22 ° C aumenta la risposta osservata cloruro totale di circa il 25% e la risposta di isoproterenolo-dipendente cloruro di circa 95%18. Tuttavia, il riscaldamento aumenta la variabilità, come valutato da una deviazione standard più grande del cloruro totale risposta17. Pertanto, come le soluzioni di riscaldamento sono un fattore aggiuntivo di variabilità, si consiglia di non scaldare le soluzioni se non richiesta su una base di studio.
In precedenza abbiamo confrontato sia delle tecniche dell’elettrodo e trovato che sistemi di elettrodi di AgCl sia calomelano operati allo stesso modo nelle correnti basale e stimolate in soggetti normali13.
Limiti della tecnica
Questo test è soggetto a variabilità significativa entro-oggetto. La variabilità di scoring è particolarmente prevalente in pazienti con tracciati indeterminati e questo deve essere contabilizzato in applicazione diagnostica19. Fattori di variabilità includono infezione acuta del tratto respiratorio superiore, ampi polipi nasali, chirurgia del seno prima e infiammazione relativa CF, che diminuiscono la sua specificità e sensibilità20,10. Inoltre, interpretazione dei tracciati può essere differenti tra i lettori, anche se i lettori esperti dimostrano accordo eccellente di scoring quantitativo e interpretabilità in CF e non CF tracciamenti, a contrasto con una significativa variabilità nella fiducia del traccia19.
Variabilità intrinseca contro soglie significative
Cosa molto importante, la fisiologica variabilità della misurazione è considerevole, come illustrato in diversi studi10, quali le prove di terapia del gene CFTR che ha dimostrato una notevole variabilità nei cambiamenti nel trasporto totale del cloruro e Amiloride gamma21,22. Valutazione della sezione trasversale suggerisce che zero Cl– plus isoproterenolo risposta sopra la soglia di -5 a -7 mV è il cut-off tra CF e non CF soggetti10.
Ci manca tuttavia la chiara conoscenza circa l’entità della variazione di questo parametro, che rappresenta un’efficace correzione di CFTR in studi di fase II con terapie di modificazione di malattia. Per valutare la risposta individuale, ripetuti test di monitoraggio della risposta ad un intervento potrebbe essere necessario distinguere cambiamenti significativi da variabilità intrinseca. Cosa molto importante, studi futuri a lungo termine con farmaci malattia devono dimostrare che il miglioramento nella funzione CFTR correla con miglioramento clinicamente rilevanti risultati o gli esiti surrogati (come miglioramento in FEV1) del CF malattia. Infatti, una fase recente studio II Ivacaftor ha dimostrato contrassegnato beneficio clinico nonostante un piccolo miglioramento nel cloruro secrezione23.
Tali studi aiuteranno a stabilire se un valore di cut-off di miglioramento nella conduttanza Cl–trans-epiteliale potrebbe essere un parametro surrogato per il beneficio clinico. Questo sarebbe un parametro importante per orientare lo sviluppo di CFTR modificando terapie.
Significato per quanto riguarda i metodi esistenti: Sweat Test e misurazioni di corrente intestinale (ICM)
In pazienti con fibrosi cistica ‘ discutibile ‘, come valutato da un sudore intermedio Cl– concentrazione tra 30 e 60 mM, i punteggi compositi di NPD forniti uno strumento altamente sensibile per diagnosticare i pazienti come ‘CF-probabile ‘ e ‘ CF-improbabile ‘10 . Misura corrente intestinale (ICM), che fornisce una misurazione ex vivo della Cl netti– flussi attraverso l’epitelio rettale, consente anche la determinazione della funzione CFTR residua con un’alta sensibilità perché CFTR è altamente espresso in Questo epitelio.
Considerando la modifica della funzione CFTR da modulatori CFTR, la relazione tra queste diverse modifiche di biomarcatore CFTR è attualmente poco chiaro. Anche se recenti lavori basato su Ivacaftor determinato che prova NPD e sudore sono correlati4, non è ancora stato stabilito se una misurazione nelle vie respiratorie è un migliore preannunciatore di risultato respiratorio rispetto, ad esempio, il sudore test24 , 25 o il cambiamento di ICM. Inoltre, farmaci modificatore possono anche differire in loro efficacies specifico organo. Per quanto riguarda la NPD, è importante notare che cambia in risposta PD e amiloride basale express trasporto Na+ , mentre cambiamenti nella risposta di isoproterenolo e Cl 0– – Cl trasporto express. È ancora da stabilire quale di questi è più importante per il miglioramento della malattia.
Futura applicazione di questa tecnica
L’uso di questa tecnica è previsto all’esterno del campo CF. Poiché questa tecnica è particolarmente adatta per dimostrare Na+ e Cl– canale ionico, può essere applicato per dimostrare la disfunzione in malattie vie aeree compreso asma26, bronchite cronica27, bronchiectasie non CF28 e pancreatite ricorrente29. Inoltre, le modifiche di questa tecnica sono state utilizzate nelle vie aeree inferiori (LAPD) per dimostrare la disfunzione CFTR airways-messa a fuoco più bassa nei pazienti di malattia polmonare ostruttiva cronica (BPCO) con bronchite cronica30.
NPD fornisce un biomarcatore sensibile in vivo della funzione CFTR, che può essere utilizzato per la diagnosi di entrambi e, inoltre, per gli studi di proof-of-concept che mira a correggere CFTR ed ENaC canale attività di ricerca traslazionale. Questo permette la valutazione longitudinale della funzione trans-epiteliale e promettente come una strategia per la medicina personalizzata adattare il correttore più efficiente per ogni paziente con CF.
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
Questa ricerca è stata sostenuta dal gruppo di lavoro per funzione CFTR del Comitato di standardizzazione (Clinical Trials Network, società europea fibrosi cistica) e nazionale risorse centro gruppo di lavoro (Therapeutics Development Network, fibrosi cistica Fondazione). Ulteriore supporto è stato fornito dalla CF Foundation (Clancy FY09 a GMS) e NIH (DK072482 SMR e GMS).
Materials
| KD Scientific infusion pump (or equivalent – such as programmable infusion pumps provided by the institution/hospital) | Fisher Scientific | ||
| Powerlab 4/30 | AD Instruments | ||
| BMA-200 AC/DC portable bioamplifier | AD Instruments | ||
| IS0-Z isolation headstage for BMA-200 | AD Instruments | ||
| Windows compatible PC – Minimum requirements of Windows XP or higher | Various | ||
| AD Instruments software: GLP Client V6 (Windows) or higher | AD Instruments | ||
| ECG electrode (ground for study subject) | Hospital standard | ||
| 2 mini calomel reference electrodes | Fisher Scientific | 13-620-79 | |
| Potassium Chloride KCl, Granular – USP, formula weight 76, qty: 500 gm | Spectrum | ||
| Sterile container (such as specimen collection container , or similar) to be used for KCl calomel bath, with holes cut in lid to hold electrodes in place. (If not provided by electrode manufacturer.) | Hospital standard | ||
| 2 electrodes: Ag/AgCl 8 mm TP electrode | BIOPAC Systems | UNSHLD-EL258 | |
| 2 Ag/AgCl electrodes, B0194, plug 4 mm | SLE Instruments | ||
| Signacreme® Conductive Electrode Cream | Fisher Scientific | Parker Labs ref # 17-05 | |
| Skin abrasion device | PROMED Feeling | Ref 374901 | |
| Hi Di 541 M, Diamond tipped dental burrs | Ash Instruments | ||
| Becton Dickinson PE 50 tubing | Fisher Scientific | 427411 | |
| Becton Dickinson PE 90 tubing | Fisher Scientific | 427421 | |
| Silastic tubing, 0.062” ID, 0.095” OD | Fisher Scientific | 508-007 | |
| Micropore Surgical Tape Paper (25 mm x 9.1 m) | 3M | 1530-1 | |
| Marquat double lumen catheter Length: 80 cm; Outer diameter: 2.5 mm; Internal diameter of the channels: 0.8 mm; Distance of the side-holes to the tip: 2 mm. EU label Agreement for NPD: I0202US | Marquat | I0202US | |
| 1" X 10 yards silk tape | 3M Durapore | 1538-1 | |
| IV extension tubing (30", 50/box) | International Limited | IMN30 | |
| Three-way stopcock (50/box) | Medex | MX5311L | |
| Sterile syringe filters (ANOTOP 25 sterile 50pk; 0.22-micron or smaller filters; or equivalent) | Fisher Scientific | 09-926-7 | |
| Becton Dickinson Intramedic Luer stub adapter (20G, for connection to PE90 if using nasal catheter produced at study site) | Fisher Scientific | 427564 | |
| Becton Dickinson 23G, 0.75” Vacutainer (“butterfly”) needles (0.6 x 19 mm; 50U/box) (for connection to PE50) if using nasal catheter produced at study site) | Fisher Scientific | 367283 | |
| Becton Dickinson Syringe 60 ml without needle Luer-Lok tip (40/Box) | Fisher Scientific | 309653 | |
| Becton Dickinson Syringe 10 ml without needle Luer-Lok tip (100/Box | Fisher Scientific | 309604 | |
| Single use sterile wipes (per institutional availability) | Hospital standard | ||
| 70% EtOH (1 pint), Aaper Alcohol and Chemical Co. catalog number NC9274019 (or equivalent) | Fisher Scientific | ||
| Corning single use sterile bottle-top filters, 0.22 μm pore size (0.15 – 1.0 litre volumes acceptable) | Fisher Scientific | 430624 | |
| Buffer Cert Ph 10.00 (1L Sn04332) – for pH meter calibration | Fisher Scientific | ||
| Buffer Cert Ph 4.00 (1L Sn04327) – for pH meter calibration | Fisher Scientific | ||
| Buffer Cert Ph 7.00 (500 ml Sn04328) – for pH meter calibration | Fisher Scientific | ||
| Disposable underpads (Blue Pads; 23"X36" 150/Box; or equivalent per hospital standard) | SureCare | ||
| 23G, 0.75” Vacutainer “butterfly” needles (0.6×19 mm; 50U/box) | Becton Dickinson | 367283 | |
| Difco Laboratories Agar (Noble 100g 0142-15-2; or equivalent) | Fisher Scientific | ||
| Welch Allyn Rhinoscope 71000-C (or equivalent) | Fisher Scientific | ||
| Welch Allyn Convertible Handle Battery 72300 (or equivalent) OR Otoscope with battery | Fisher Scientific | ||
| Head and chin rest (or equivalent; optional) | Richmond Products, Inc | 629R | |
| Static Dissipative Anti-Fatigue Matting (or equivalent) | Fisher Scientific | No. 791 | |
| REAGENTS FOR SOLUTIONS MIXED ON SITE | |||
| Sodium Chloride, Granular – USP NaCl | Spectrum | Formula Weight: 58; Size: 500 gm | |
| Calcium Chloride CaCl2•2H2O – USP | Spectrum | Formula Weight: 147; Size: 500 gm | |
| Magnesium Chloride Hexahydrate Crystal, MgCl2•6H2O – USP | Spectrum | Formula Weight: 203; Size: 500 gm | |
| Potassium Phosphate Dibasic, Anhydrous, Granular, K2HPO4 – USP | Spectrum | Formula Weight: 174; Size: 500 gm | |
| Potassium Phosphate Monobasic Crystals – NF (KH2PO4) | Spectrum | Formula Weight: 136; Size: 500 gm | |
| Sodium Gluconate- USP (monosodium salt) | Spectrum | Formula Weight: 218; Size: 500 gm | |
| Calcium Gluconate – USP (Anhydrous Powder) | Spectrum | Formula Weight: 430; Size: 500 gm | |
| Potassium Gluconate- USP (Anhydrous) | Spectrum | Formula Weight: 234; Size: 500 gm | |
| Magnesium Sulfate Heptahydrate – USP MgSO4•7H2O | Spectrum | Formula Weight: 246; Size: 500 gm | |
| Amiloride HCl – USP | Spectrum | Formula Weight: 302; Size: 5gm | |
| Adenosine 5’-Triphosphate (ATP) (Disodium salt) | Spectrum | Formula Weight: 551; Size: 5gm | |
| Magnesium Chloride, Hexahydrate, Crystal – USP MgCl2•6H2O | Spectrum | Formula Weight: 203; Size: 500 gm | |
| Double-distilled water (ddH2O) | Hospital Pharmacy | Formula Weight: NA; Size: 1 L | |
| Isoproterenol HCL Injection – USP 1 mg/5 ml ampule | Hospital Pharmacy | Formula Weight: 248; Size: single use | |
| Ringers Injection, USP or Ringers Irrigation | Hospital Pharmacy | Formula Weight: NA; Size: 5 L |
Riferimenti
- Rosenstein, B. What is a Cystic Fibrosis Diagnosis?. Clinics in Chest Medicine. 19, 423-441 (1998).
- Rosenstein, B., Cutting, G. R. The Diagnosis of Cystic Fibrosis: A Consensus Statement: Cystic Fibrosis Foundation Consensus Panel. The Journal of Pediatrics. 132, 589-595 (1998).
- Farrell, P. M., et al. Diagnosis of Cystic Fibrosis: Consensus Guidelines from the Cystic Fibrosis Foundation. The Journal of Pediatrics. 181, S4-S15 (2017).
- Mesbahi, M., et al. Changes of CFTR functional measurements and clinical improvements in cystic fibrosis patients with non-p.Gly551Asp gating mutations treated with ivacaftor. Journal of Cystic Fibrosis. 16, 45-48 (2017).
- Accurso, F., et al. Sweat chloride as a biomarker of CFTR activity: proof of concept and ivacaftor clinical trial data. Journal of Cystic Fibrosis. 13 (2), 139-147 (2014).
- Accurso, F., et al. Effect of VX-770 in Persons with Cystic Fibrosis and the G551D-CFTR Mutation. New England Journal of Medicine. 363, 1991-2003 (2010).
- Sermet, I., et al. Measurement of nasal potential difference in young children with an equivocal sweat test following newborn screening for cystic fibrosis. Thorax. 65 (6), 539-544 (2010).
- Wilschanski, M., et al. Mutations in the Cystic Fibrosis Transmembrane Regulator Gene and In vivo Transepithelial Potentials. American Journal of Respiratory and Critical Care Medicine. 174 (7), 787794 (2006).
- Sermet-Gaudelus, I., et al. Clinical Phenotype and Genotype of Children with Borderline Sweat Test and Abnormal Nasal Epithelial Chloride Transport. American Journal of Respiratory and Critical Care Medicine. 182 (7), 929-936 (2010).
- De Boeck, K., et al. CFTR biomarkers: time for promotion to surrogate endpoint?. European Respiratory Journal. 14, 38 (2013).
- US CFF-TDN (Cystic Fibrosis Foundation-Therapeutics Development Network) and the ECFS-CTN (European Cystic Fibrosis Society- Clinical Trials Network). Standard Operating Procedure 528.01. Standardized Measurement of Nasal Membrane Transepithelial Potential Difference (NPD). , (2014).
- Knowles, M., et al. Increased bioelectric potential difference across respiratory epithelia in CF. New England Journal of Medicine. 305 (25), 1489-1493 (1981).
- Solomon, G. M., et al. An international Randomised Multicentre Comparison of NPD Techniques. Chest. 138, 919-928 (2010).
- Sermet, I., et al. Chloride Transport in Nasal Ciliated Cells of Cystic Fibrosis Heterozygotes. American Journal of Respiratory and Critical Care Medicine. 171, 1026-1031 (2005).
- Naehrlich, L., et al. Nasal potential difference measurements in diagnosis of cystic fibrosis: an international survey. Journal of Cystic Fibrosis. 13 (1), 24-28 (2014).
- Vermeulen, F., et al. Nasal potential measurements on the nasal floor and under the inferior turbinate: Does it matter?. Pediatric Pulmonology. 46 (2), 145-152 (2011).
- Bronsveld, I., et al. Influence of perfusate temperature on nasal potential difference. European Respiratory Journal. 42, 389-393 (2013).
- Boyle, M., et al. A multi-center study on the effect of solution temperature on nasal potential difference measurements. Chest. 124 (2), 482-489 (2003).
- Solomon, G. M., et al. A Multiple Reader Scoring System for Nasal Potential Difference Parameters. Journal of Cystic Fibrosis. 16 (5), 573-578 (2017).
- Beekman, J. M., et al. CFTR functional measurements in human models for diagnosis, prognosis and personalized therapy: Report on the pre-conference meeting to the 11th ECFS Basic Science Conference, Malta, 26-29 March 2014. Journal of Cystic Fibrosis. 13, 363-372 (2014).
- Accurso, F., et al. Effect of VX-770 in persons with cystic fibrosis and the G551D-CFTR mutation. New England Journal of Medicine. 363, 1991-2003 (2010).
- Wilschanski, M., et al. Chronic ataluren (PTC124) treatment of nonsense mutation cystic fibrosis. European Respiratory Journal. 38, 59-69 (2011).
- Accurso, F., et al. Sweat Chloride as a biomarker of CFTR activity: proof of concept and Ivacaftor clinical trial data. Journal of Cystic Fibrosis. 13 (2), 139-147 (2014).
- Rowe, S., et al. Clinical Mechanism of the Cystic Fibrosis Transmembrane Conductance Regulator Potentiator Ivacaftor in G551D-mediated Cystic Fibrosis. American Journal of Respiratory and Critical Care Medicine. 190 (2), 175-184 (2014).
- Boyle, M., et al. A CFTR corrector lumacaftor and a CFTR potentiator (ivacaftor) for treatment of patients with cystic fibrosis who have a phe508del CFTR mutation: a phase 2 randomised controlled trial. The Lancet Respiratory Medicine. 2 (7), 527-538 (2014).
- Schulz, A., Tummler, B. Non-allergic asthma as a CFTR-related disorder. Journal of Cystic Fibrosis. 15 (5), 641-644 (2016).
- Sloane, P. A., et al. A pharmacologic approach to acquired cystic fibrosis transmembrane conductance regulator dysfunction in smoking related lung disease. PLoS One. 7 (6), e39809 (2012).
- Bienvenu, T., et al. Cystic Fibrosis Transmembrane Conductance Regulator Channel Dysfunction in Non-Cystic Fibrosis Bronchiectasis. American Journal of Respiratory and Critical Care Medicine. 181 (10), 1078-1083 (2010).
- Werlin, S., et al. Genetic and electrophysiological characteristics of recurrent acute pancreatitis. Journal of Pediatric Gastroenterology and Nutrition. 60 (5), 675-679 (2015).
- Dransfield, M. T., et al. Acquired Cystic Fibrosis Transmembrane Conductance Regulator Dysfunction in the Lower Airways in COPD. Chest. 144 (2), 498-506 (2013).

