מיקרוסקופיה קונפוקלית מגלה התא קולטן משטח צבירת דרך התמונה המתאם ספקטרוסקופיה
Summary
נוגדנים לאגד היעד הקולטנים על פני השטח של התא יכול להתייעץ קונפורמציה והשינויים קיבוץ באשכולות. שינויים דינמיים אלה יש השלכות על אפיון פיתוח תרופות בתאי המטרה. פרוטוקול זה מנצל מיקרוסקופיה קונפוקלית וספקטרוסקופיה של המתאם תמונה דרך ImageJ/פיג’י לכמת את מידת קולטן קיבוץ באשכולות על פני התא.
Abstract
מיקרוסקופיה קונפוקלית מספק מתודולוגיה נגיש כדי ללכוד אינטראקציות סלולרי תת קריטי אפיון ופיתוח נוסף של ניסויים פרה-קליניים סוכנים המסומנת הגששים פלורסנט. עם הפיתוחים האחרונים בתחום תרופות ציטוטוקסיות נוגדן מבוסס מערכות אספקה, הבנה התיקונים. הנגרמת על ידי סוכנים אלה בגדר של צבירת קולטן, הפנמה יש חשיבות קריטית. פרוטוקול זה ממנף את המתודולוגיה ומבוססת של immunocytochemistry פלורסנט והפצה קוד פתוח פיג’י של ImageJ, עם autocorrelation מובנה, פונקציות מתמטיות תמונה, כדי לבצע קורלציה מרחבית תמונה ספקטרוסקופיה (ICS). פרוטוקול זה quantitates את עוצמת פלורסנט של קולטני שכותרתו כפונקציה של אזור קרן של מיקרוסקופ קונפוקלי. זה מספק מדד כמותי של מצב צבירה מולקולת המטרה על פני התא. מתודולוגיה זו מתמקדת האפיון של תאים סטטי עם פוטנציאל להתרחב חקירות הטמפורלי של קולטן מצבור. פרוטוקול זה מציג מתודולוגיה נגיש לספק כימות של קיבוץ באשכולות אירועים המתרחשים על פני התא, ניצול טוב הוקמה ללא-התמחות מכשיר הדמיה וטכניקות.
Introduction
התפתחות נוגדנים טיפולית הראו הצלחה בטיפול של הגידול במספר סוגים1. הפיתוחים האחרונים של נוגדן תרופתיים conjugates (ADC) כמו מנגנוני מסירה עבור תרכובות ציטוטוקסיות הרחיבה את הדרישות להבנת הדינמיקה של אינטראקציות נוגדן: קולטן בתא פני השטח2. בעקבות מיקוד מוצלחת של נוגדנים לקולטן פני שטח התא, קומפלקסים אלה יכול לגרום דפוסים צבירת דומים לאלה הנהוגות ליגנד: נוגדן אינטראקציות3. שינויים קולטן צבירת יכול לגרום שינויים ממברנה תוצאה ההפנמה של הקולטן והסרה שלו מפני השטח של התא. בהקשר של המספר המשלים נוגדן-סמים, תהליך זה לאחר מכן משחרר את המטען ציטוטוקסיות לתוך endosomes למביטה ובעקבות כך הציטופלסמה, וכתוצאה מכך היעילה תא ההרג.
מיקרוסקופיה קונפוקלית סיפק אמצעי יעיל להמחיש אינטראקציות חשובות אלה של נוגדנים, קולטנים שלהם יעד4. כדי לחקור את השינויים של צבירה של מולקולת המטרה על פני התא פרוטוקול זה מנצל לאחר העיבוד של מיקרוסקופיה קונפוקלית תמונות באמצעות תמונות מרחבי המתאם ספקטרוסקופיה (ICS) טכניקה 5,6,7 .
הקרן של התמונה המתאם ספקטרוסקופיה היא התצפית כי תנודות עוצמת קרינה פלואורסצנטית המרחבי לשתף יחסים למצב שבו צפיפות, צבירה של המבנים שכותרתו. מערכת היחסים הזו היא הוקמה בעקבות החישוב של פונקציה autocorrelation המרחבי של התמונה שנתפסו5.
כל הווריאציות של התמונה המתאם ספקטרוסקופיה דורשים חישוב autocorrelation התמונה. זה ואחריו התאמת פונקציה זו לעקומה גאוסיאנית דו-ממדית על החילוץ של פרמטרים מצב צבירה כמותית הכלול בתוך התמונה. במילים פשוטות החישוב של autocorrelation תמונה כרוך השוואת כל זוגות פיקסל אפשרי בתוך תמונה וחישוב את הסבירות כי שניהם באותה מידה בהיר כמו אחד את השני. זה הוא מדמיין פונקציה של המרחק ואת הכיוונים של פיקסל ההפרדה8.
המסגרת התיאורטית ספקטרוסקופיה המתאם התמונה הוקמה ומוגדר על-ידי פיטרסון, ויסמן ואח. 5 , 6. ב פרוטוקול זה, autocorrelation החישובים מבוצעים פיג ‘ י/ImageJ, כמו גם יישום גליונות אלקטרוניים, ניתן לתאר את הבסיס עבור הפונקציה autocorrelation המרחבי עוצמת התנודה (Eq 1):
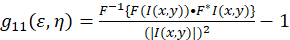
כאשר F מייצג התמרת פורייה; F− 1 ההופכי פורייה שינוי צורה; F * המרוכב שלה; השהיה המרחבי משתנים חדוה , η. ב- ICS המרחבי, כפי שמתואר פרוטוקול זה, הפונקציה autocorrelation ניתן לחשב באמצעות 2D מהר פורייה המרה אלגוריתם7,9. Autocorrelation-אפס הפרדה מרחבית הידוע גם אפס-בעומר, ג’י11(0, 0), מספק את ההופכי רשע מספר החלקיקים מתנת קרן שטח של המיקרוסקופ. ניתן להשיג על-ידי הזזת את הפונקציה autocorrelation מרחבי פונקציה גאוסיאנית דו-ממדית (Eq 2):
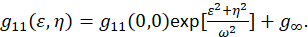
הפיקסלים שנתפסו בתמונה מוכלים בתוך אזור קבוע, מדידות אלה לא להרחיב עד אינסוף, המונח g∞ משמש היסט להביא בחשבון מתאמים המרחבי לטווח ארוך בתוך התמונה. למצרפי בגודל מולקולרי, ω הפונקציה בנקודה-התפשטות של המיקרוסקופ, שתואר על ידי רוחב המלא מקסימום חצי של הפונקציה autocorrelation המרחבי. השטח הכלול בתוך הפונקציה הליין של המכשיר התפקיד באמצעות חרוזים פלורסנט משנה רזולוציה.
עבור התמונה המתאם ספקטרוסקופיה פרוטוקול כפי שיתואר בהמשך, autocorrelation ואת פונקציות מתמטיות הדרושים להשלמת ICS מבוצעות באמצעות פלטפורמת עיבוד הדמיה של קוד פתוח, פיג’י10, הפצת ImageJ תוכנית11,12. פיג ‘ י/ImageJ מנצל את השינוי פורייה מהירה שהותקנו מראש בפונקציה FFT במתמטיקה. פונקציה זו מקצרת את זמן מחשוב נדרש חישוב זה על-ידי הפחתת טווח הנתונים במקדם של שניים בכל ממד13. כמו בפונקציה 2D autocorrelation הוא סימטרי כ x, ציר y, מגרש פרופיל קו בודד על התמונה autocorrelation יכול לשמש כדי למדוד את autocorrelation גלם כפונקציה של השהיה מרחבית. רעש אפס-בעומר מוסר לפני בהמשך חישוב, עם משרעת autocorrelation וכתוצאה מכך (ערך שיא, g(0)T) מתוקנות על רקע עם הביטוי (Eq 3):
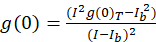
איפה אניb הוא עוצמת רשע אזור רקע למעט התא. צפיפות אשכול, או צפיפות של אובייקטים פלורסנט, מוגדרת על-ידי (Eq 4):
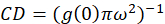
בפרוטוקול כפי שיתואר בהמשך, אנחנו עוד יותר פשוט חישוב צפיפות אשכול (CD), עם ההנחה בהתאם את התצפית כי פונקציה autocorrelation מנורמל תרקב לערך מתקרב 1.0 עם הגדלת לג מרחבית. עם השהיה המרחבי המרבי, יש עוד שום קורלציה של קרינה פלואורסצנטית ערכי העוצמה ומיחשוב ובכך ללא מתאם החישובים על אזור זה הם הערך של עוצמה מוכפל הזה בעוצמה אשר מחולק לאחר מכן ב- כיכר בעוצמה הזו, אשר מעצם הגדרתו הוא שווה ל- 1.0. לפיכך, אשכול צפיפות של פונקציה autocorrelation מנורמל יכול להיות מחושב על-ידי חיסור 1.0 מהפונקציה autocorrelation מנורמל לפני נטילת כל הדדיים (Eq 5):
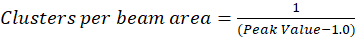
ניתן לבצע כיול נוסף של האזור קרן כדי quantitate את מספר אשכולות בתוך האזור של הפונקציה הליין של המכשיר. כיול זה חייב להתבצע תוך שימוש באותם תנאים אופטי המשמש במהלך ניתוח ספקטרוסקופיה המתאם התמונה.
Protocol
Representative Results
Discussion
הטכניקה של התמונה המתאם ספקטרוסקופיה (ICS) שמתארים לנו ב פרוטוקול זה משתמש מיקרוסקופ קונפוקלי רגיל ללא צורך גלאים מיוחדים. ICS בטכניקה המתוארת מנצל immunocytochemistry ומבוססת שיטות כדי לספק עבור דיגום מהיר של תנאים מרובים הטיפול לניתוח סטטיסטי מוגברת. מתודולוגיה זו עושה את זה עם הפחתה קלה של דיוק מו?…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
המחברים לאשר תמיכה NHMRC (מלגת 1084178 ו מענקי 1087850, 1030469, 1075898 (AMS)), במימון סרטן באוסטרליה, לחקר הסרטן לודוויג, ג’ון טי ריד בוטח, קרן סרטן המוח התרופה, La Trobe אוניברסיטת והסוכנות ויקטוריה סרטן. מימון התוכנית תמיכה תשתית תפעולית הניתן על ידי הממשלה ויקטוריאני, אוסטרליה הוא הודה גם.
Materials
| Nunc Lab-Tek II Chambered Coverglass – 8 well | ThermoFisher Scientific | 155409 | |
| DPBS, no calcium, no magnesium | ThermoFisher Scientific | 14190144 | |
| Fetal Bovine Serum | ThermoFisher Scientific | 10099141 | |
| TrypLE Express Enzyme (1x), no phenol red | ThermoFisher Scientific | 12604021 | |
| Penicillin-Streptomycin (10,000 U/mL) | ThermoFisher Scientific | 15140122 | |
| GlutaMAX Supplement | ThermoFisher Scientific | 35050061 | |
| Goat anti-Human IgG (H+L) Cross-Adsorbed Secondary Antibody, Alexa Fluor 488 | ThermoFisher Scientific | A11013 | |
| TetraSpeck Fluorescent Microsphere Standards 0.1µm | ThermoFisher Scientific | T7279 | |
| Cetuximab | Merck Serono | 3023715501 | |
| Parafilm M 38mx100mm | Merck Millipore | BRND701605 | |
| 16% Paraformaldehyde (formaldehyde) aqueous solution | ProSciTech | C004 | |
| Recombinant Human EGF | R&D System | 236-EG |
Riferimenti
- Scott, A. M., Wolchok, J. D., Old, L. J. Antibody therapy of cancer. Nature reviews. Cancer. 12 (4), 278-287 (2012).
- Parslow, A. C., Parakh, S., Lee, F. -. T., Gan, H., Scott, A. Antibody-Drug Conjugates for Cancer Therapy. Biomedicines. 4 (3), 14 (2016).
- Sorkin, A., Waters, C. M. Endocytosis of growth factor receptors. BioEssays. 15 (6), 375-382 (1993).
- Pawley, J. . Handbook of Biological Confocal Microscopy. , (2006).
- Petersen, N. O., Höddelius, P. L., Wiseman, P. W., Seger, O., Magnusson, K. E. Quantitation of membrane receptor distributions by image correlation spectroscopy: concept and application. Biophysical Journal. 65 (3), 1135-1146 (1993).
- Wiseman, P. W., Petersen, N. O. Image Correlation Spectroscopy. II. Optimization for Ultrasensitive Detection of Preexisting Platelet-Derived Growth Factor-β Receptor Oligomers on Intact Cells. Biophysical Journal. 76 (2), 963-977 (1999).
- Costantino, S., Comeau, J. W. D., Kolin, D. L., Wiseman, P. W. Accuracy and Dynamic Range of Spatial Image Correlation and Cross-Correlation Spectroscopy. Biophysical Journal. 89 (2), 1251-1260 (2005).
- Claire Robertson, S. C. G. Theory and practical recommendations for autocorrelation-based image correlation spectroscopy. Journal of Biomedical Optics. 17 (8), 080801 (2012).
- Ciccotosto, G. D., Kozer, N., Chow, T. T. Y., Chon, J. W. M., Clayton, A. H. A. Aggregation Distributions on Cells Determined by Photobleaching Image Correlation Spectroscopy. Biophysical Journal. 104 (5), 1056-1064 (2013).
- Schindelin, J., Arganda-Carreras, I., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Abràmoff, M. D., Magalhães, P. J., Ram, S. J. Image processing with ImageJ. Biophotonics International. 11 (7), 36-42 (2004).
- Collins, T. J. ImageJ for microscopy. BioTechniques. 43 (1 Suppl), 25-30 (2007).
- Rappaz, B., Wiseman, P. W. Image correlation spectroscopy for measurements of particle densities and colocalization. Current protocols in cell biology. , (2013).
- tferr/Scripts: BAR 1.5.1. Zenodo Available from: https://zenodo.org/record/495245 (2017)
- Elson, E. L. Fluorescence Correlation Spectroscopy: Past, Present, Future. Biophysical Journal. 101 (12), 2855-2870 (2011).
- Jares-Erijman, E. A., Jovin, T. M. Imaging molecular interactions in living cells by FRET microscopy. Current opinion in chemical biology. 10 (5), 409-416 (2006).
- Huang, B., Bates, M., Zhuang, X. Super-Resolution Fluorescence Microscopy. dx.doi.org.ez.library.latrobe.edu.au. 78 (1), 993-1016 (2009).
- Schermelleh, L., Heintzmann, R., Leonhardt, H. A guide to super-resolution fluorescence microscopy. The Journal of Cell Biology. 190 (2), 165-175 (2010).
- Nohe, A., Petersen, N. O. Image Correlation Spectroscopy. Sci. Signal. (417), pl7 (2007).

