AC confocal mikroskopi avslører cellen overflaten reseptor aggregering gjennom bildet korrelasjon spektroskopi
Summary
Antistoffer som binder å målrette reseptorer på cellens overflate kan gi conformation og klynging endringer. Disse dynamiske endringer har implikasjoner for å karakterisere narkotika utvikling i målcellene. Denne protokollen bruker AC confocal mikroskopi og bilde korrelasjon spektroskopi gjennom ImageJ/FIJI å kvantifisere omfanget av reseptor klynger på cellens overflate.
Abstract
AC confocal mikroskopi gir en tilgjengelig metode for å fange sub mobilnettet interaksjoner kritisk for karakterisering og videreutvikling av pre-klinisk agenter merket med fluorescerende sonder. Med nylige fremskritt i antistoff basert cytotoksiske narkotika er leveringssystemer, forstå forandringer indusert av disse agentene innan reseptor aggregering og internalisering av avgjørende betydning. Denne protokollen utnytter veletablerte metodikk fluorescerende immunocytochemistry og åpen kildekode FIJI fordelingen av ImageJ, med innebygd autokorrelasjon og bilde matematiske funksjoner, utføre romlige bilde korrelasjon spektroskopi (ICS). Denne protokollen quantitates fluorescerende intensiteten av merket reseptorer som en funksjon av bjelke AC confocal mikroskop. Dette gir et kvantitativt mål av mål molekylet samling på cellens overflate. Denne metodikken er fokusert på karakterisering av statisk celler med potensial til å utvide til timelige undersøkelser av reseptor aggregering. Denne protokollen presenterer en tilgjengelig metode for å gi kvantifisering klynging hendelser på celleoverflaten, utnytte godt etablerte teknikker og ikke-spesialiserte tenkelig apparat.
Introduction
Utviklingen av terapeutiske antistoffer har vist bemerkelsesverdig suksess i behandling av flere svulst typer1. Den nylige fremskritt av antistoff-stoff conjugates (ADC) overflaten som leveringsmekanismer for cytotoksiske forbindelser har utvidet kravene for å forstå dynamikken i antistoff: reseptor interaksjoner i cellen2. Etter vellykket målretting av et antistoff til cellen overflaten reseptoren, kan disse kompleksene indusere lignende aggregering mønstre de observeres i ligand: antistoff interaksjoner3. Endringer i reseptor aggregering kan indusere endringer i membranen og resulterer i internalisering av reseptoren og fjerning fra celleoverflaten. I forbindelse med et antistoff-stoff konjugert utgivelser denne prosessen senere cytotoksiske nyttelast internalisert endosomes og senere cytoplasma, resulterer i effektivt celle drapet.
AC confocal mikroskopi har gitt en effektiv måte å visualisere disse viktige interaksjoner av antistoffer og deres mål reseptorer4. For å utforske endringene av aggregering av mål molekylet på celleoverflaten utnytter denne protokollen etterbehandling av AC confocal mikroskopi bilder via en romlig bilde korrelasjon spektroskopi (ICS) teknikk 5,6,7 .
Grunnlaget for bildet korrelasjon spektroskopi er observasjon at romlig fluorescens intensitet svingninger deler et forhold i tetthet og aggregering delstaten merket strukturer. Dette forholdet er etablert etter av en romlig autokorrelasjon bildet5.
Alle varianter av bildet korrelasjon spektroskopi krever beregning av et bilde autokorrelasjon. Dette etterfølges av passer denne funksjonen til en todimensjonal Gaussisk kurve for utvinning av kvantitative aggregering staten parametere i bildet. Enkelt sagt beregningen av et bilde autokorrelasjon innebærer sammenligne alle mulige pixel parene som finnes i et bilde og beregne sannsynligheten som begge like lyse som hverandre. Dette er visualisert som en funksjon av avstand og retning av pixel separasjon8.
Teoretisk referanseramme for bildet korrelasjon spektroskopi ble opprettet og definert av Petersen og Wiseman et al. 5 , 6. i denne protokollen, autokorrelasjon beregningene utføres i Fiji/ImageJ samt et regnearkprogram, grunnlaget for funksjonen intensitet svingninger romlige autokorrelasjon kan beskrives som (Eq 1):
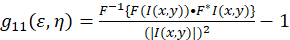
der F representerer Fourier transform; F−1 inverse Fourier transform; F * komplekskonjugerte; og romlig lag variabler ε og η. I romlig ICS, som beskrevet i denne protokollen, kan autokorrelasjon funksjonen beregnes ved hjelp av en 2D rask Fourier transform algoritmen7,9. Autokorrelasjon ved null romlige ellers kjent som null-lag, g11(0,0), gir omvendt gjennomsnittlig antall partikler tilstede per strålen område av mikroskopet. Den kan oppnås ved å tilpasse funksjonen romlige autokorrelasjon en todimensjonal Gaussisk funksjon (Eq 2):
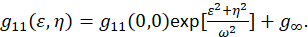
Pikslene fanget i et bilde er innenfor et angitt område og disse målingene forlenger ikke til uendelig, brukes begrepet g∞ som en offset til kontoen langtrekkende romlige sammenhenger i bildet. For molekylær størrelse aggregat, ω spilltilbud funksjon mikroskopet og beskrevet av fullbreddes på halv-maksimale romlige autokorrelasjon funksjonen. Området i funksjonen poenget spredningen av instrumentet kan kalibreres ved hjelp av sub oppløsning fluorescerende perler.
For bildet korrelasjon spektroskopi protokollen beskrevet her, er autokorrelasjon og matematiske funksjoner som kreves for å fullføre ICS utført ved hjelp av åpen kildekode bildebehandling behandling plattformen, Fiji10, en fordeling av ImageJ programmet11,12. Fiji/ImageJ benytter forhåndsinstallert rask Fourier transformasjon i funksjonen FFT matematikk. Denne funksjonen reduserer beregne tiden det tar for denne beregningen ved å redusere dataområdet med en faktor på to i hver dimensjon13. Funksjonen 2D autokorrelasjon er ca symmetrisk i x, y-aksen, kan en enkeltlinje profil tomt gjennom autokorrelasjon bildet brukes til å måle rå autokorrelasjon som en funksjon av romlige lag. Null-lag støy fjernes før videre beregning, med resulterende autokorrelasjon amplituden (toppverdien, g(0)T) korrigert for bakgrunn med uttrykket (Eq 3):
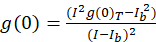
hvor jegb er mener intensiteten fra en bakgrunn region unntatt cellen. Den klynge tetthet eller tettheten av fluorescerende objekter, defineres av (Eq 4):
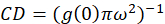
I protokollen beskrevet her, videre vi bare beregningen av klyngen (CD), med forutsetning basert på observasjon som en normalisert autokorrelasjon funksjon vil forfalle til verdien nærmer 1.0 med økende romlige lag. Maksimal romlige lag, det er ikke lenger noen sammenheng av fluorescens intensitetsverdiene og dermed uten en sammenheng beregninger på dette området er databehandling verdien av en intensitet multiplisert med denne intensiteten som deles deretter på kvadratet av at intensitet, som per definisjon er 1.0. Dermed kan klynge tetthet fra en normalisert autokorrelasjon funksjon beregnes ved å trekke 1.0 fra funksjonen normalisert autokorrelasjon før gjensidige (Eq 5):
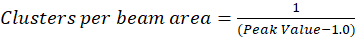
Ytterligere kalibrering av området strålen kan utføres for å quantitate antallet klynger i området av funksjonen poenget spredningen av instrumentet. Denne kalibreringen må utføres med samme optiske betingelsene brukes under bildet korrelasjon spektroskopi analysen.
Protocol
Representative Results
Discussion
Teknikken av bildet korrelasjon spektroskopi (ICS) som vi beskriver i denne protokollen bruker standard AC confocal mikroskop uten behov for spesialiserte detektorer. ICS teknikken beskrevet benytter veletablerte immunocytochemistry metoder å gi for rask prøvetaking av flere behandling for økt statistisk analyse. Denne metoden gjør det med en liten reduksjon i nøyaktig presisjon i forhold til alternative ett molekyl teknikker basert på sammenheng fluorescens svingninger av mobile molekyler spre gjennom en AC confoc…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
Forfatterne bekrefter finansiering støtte fra NHMRC (fellesskap 1084178 og tilskudd 1087850, 1030469, 1075898 (AMS)), kreft Australia, Ludwig kreftforskning, John T Reid stoler, kur Brain Cancer Foundation, La Trobe University og Victoria kreft byrået. Finansiering fra operative infrastruktur støtteprogrammet levert av den viktorianske regjeringen, er Australia også anerkjent.
Materials
| Nunc Lab-Tek II Chambered Coverglass – 8 well | ThermoFisher Scientific | 155409 | |
| DPBS, no calcium, no magnesium | ThermoFisher Scientific | 14190144 | |
| Fetal Bovine Serum | ThermoFisher Scientific | 10099141 | |
| TrypLE Express Enzyme (1x), no phenol red | ThermoFisher Scientific | 12604021 | |
| Penicillin-Streptomycin (10,000 U/mL) | ThermoFisher Scientific | 15140122 | |
| GlutaMAX Supplement | ThermoFisher Scientific | 35050061 | |
| Goat anti-Human IgG (H+L) Cross-Adsorbed Secondary Antibody, Alexa Fluor 488 | ThermoFisher Scientific | A11013 | |
| TetraSpeck Fluorescent Microsphere Standards 0.1µm | ThermoFisher Scientific | T7279 | |
| Cetuximab | Merck Serono | 3023715501 | |
| Parafilm M 38mx100mm | Merck Millipore | BRND701605 | |
| 16% Paraformaldehyde (formaldehyde) aqueous solution | ProSciTech | C004 | |
| Recombinant Human EGF | R&D System | 236-EG |
Riferimenti
- Scott, A. M., Wolchok, J. D., Old, L. J. Antibody therapy of cancer. Nature reviews. Cancer. 12 (4), 278-287 (2012).
- Parslow, A. C., Parakh, S., Lee, F. -. T., Gan, H., Scott, A. Antibody-Drug Conjugates for Cancer Therapy. Biomedicines. 4 (3), 14 (2016).
- Sorkin, A., Waters, C. M. Endocytosis of growth factor receptors. BioEssays. 15 (6), 375-382 (1993).
- Pawley, J. . Handbook of Biological Confocal Microscopy. , (2006).
- Petersen, N. O., Höddelius, P. L., Wiseman, P. W., Seger, O., Magnusson, K. E. Quantitation of membrane receptor distributions by image correlation spectroscopy: concept and application. Biophysical Journal. 65 (3), 1135-1146 (1993).
- Wiseman, P. W., Petersen, N. O. Image Correlation Spectroscopy. II. Optimization for Ultrasensitive Detection of Preexisting Platelet-Derived Growth Factor-β Receptor Oligomers on Intact Cells. Biophysical Journal. 76 (2), 963-977 (1999).
- Costantino, S., Comeau, J. W. D., Kolin, D. L., Wiseman, P. W. Accuracy and Dynamic Range of Spatial Image Correlation and Cross-Correlation Spectroscopy. Biophysical Journal. 89 (2), 1251-1260 (2005).
- Claire Robertson, S. C. G. Theory and practical recommendations for autocorrelation-based image correlation spectroscopy. Journal of Biomedical Optics. 17 (8), 080801 (2012).
- Ciccotosto, G. D., Kozer, N., Chow, T. T. Y., Chon, J. W. M., Clayton, A. H. A. Aggregation Distributions on Cells Determined by Photobleaching Image Correlation Spectroscopy. Biophysical Journal. 104 (5), 1056-1064 (2013).
- Schindelin, J., Arganda-Carreras, I., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Abràmoff, M. D., Magalhães, P. J., Ram, S. J. Image processing with ImageJ. Biophotonics International. 11 (7), 36-42 (2004).
- Collins, T. J. ImageJ for microscopy. BioTechniques. 43 (1 Suppl), 25-30 (2007).
- Rappaz, B., Wiseman, P. W. Image correlation spectroscopy for measurements of particle densities and colocalization. Current protocols in cell biology. , (2013).
- tferr/Scripts: BAR 1.5.1. Zenodo Available from: https://zenodo.org/record/495245 (2017)
- Elson, E. L. Fluorescence Correlation Spectroscopy: Past, Present, Future. Biophysical Journal. 101 (12), 2855-2870 (2011).
- Jares-Erijman, E. A., Jovin, T. M. Imaging molecular interactions in living cells by FRET microscopy. Current opinion in chemical biology. 10 (5), 409-416 (2006).
- Huang, B., Bates, M., Zhuang, X. Super-Resolution Fluorescence Microscopy. dx.doi.org.ez.library.latrobe.edu.au. 78 (1), 993-1016 (2009).
- Schermelleh, L., Heintzmann, R., Leonhardt, H. A guide to super-resolution fluorescence microscopy. The Journal of Cell Biology. 190 (2), 165-175 (2010).
- Nohe, A., Petersen, N. O. Image Correlation Spectroscopy. Sci. Signal. (417), pl7 (2007).

