En Strain Gauge skærm (sdb) for kontinuerlig ventil måbe målinger i toskallede bløddyr som svar på laboratoriet induceret Diel-cykling hypoxi og pH
Summary
Forstå de adfærdsmæssige reaktioner af toskallede suspension-foderautomater til miljøvariabler, som opløst ilt, kan forklare nogle økosystem-processer. Vi har udviklet en billig, laboratorium-baseret, strain gauge skærm (sdb) til at måle ventil måbe svar af østers, Crassostrea virginica, diel-cykling hypoxi og cykliske pH.
Abstract
En billig, laboratorium-baseret, strain gauge ventil måbe skærm (sdb) blev udviklet for at overvåge den ventil måbe opførsel af toskallede bløddyr i svar på diel-cykling hypoxi. En Wheatstone bro var tilsluttet strain gauges, der var tilknyttet skallerne af østers (Crassostrea virginica). De indspillede signaler tilladt for åbning og lukning af muslinger skal registreres kontinuerligt to-dages perioder af eksperimentelt inducerede diel-cykling hypoxi og diel-cykling ændringer i pH. Her, vi beskriver en protokol for at udvikle en billig strain gauge skærm og beskrive, i et eksempel laboratorium eksperiment, hvor vi brugte det til at måle ventil måbe opførsel af østlige østers (C. virginica), som svar på diel-cykling hypoxi og cykliske ændringer i pH. Ventil måbe blev målt på østers udsat for cykliske svær hypoksiske (0,6 mg/L) opløst ilt betingelser med og uden cykliske ændringer i pH, cykliske mild hypoksiske (1,7 mg/L) forhold og normoxic (7,3 mg/L) forhold. Vi viser at når østers støder gentagne diel cyklusser, de hurtigt lukker deres skaller som reaktion på svær hypoxi og lukke med en tidsforskydning til mild hypoxi. Når normoxia er gendannet, åbne de hurtigt igen. Østers reagerede ikke på cyklisk pH betingelser overlejret på diel cykling svær hypoxi. På reduceret ilt betingelser, mere end en tredjedel af østers lukket samtidigt. Vi demonstrere, at østers reagere på diel-cykling hypoxi, som skal overvejes når vurdere adfærd af muslinger til opløst ilt. Ventil SGM kan bruges til at vurdere svar af toskallede bløddyr til ændringer i opløst ilt eller forurenende stoffer. Forsegling teknikker til bedre tætning ventil måbe strain gauges fra havvand har brug for yderligere forbedring at øge levetiden af sensorer.
Introduction
Hypoxi, dvs, opløst ilt koncentrationer [gøre] tilstrækkeligt lav for at indvirke negativt på biologiske og økologiske processer men ofte funktionelt defineret som [gøre] < 2 mg / L1og iltmangel (funktionelt defineret som [] af 0,0-0,2 mg/L) forekommer hyppigere og alvorligt i verdens kystfarvande, flodmundinger og dybe hav2,3 og er ofte forværres ved at øge eutrofiering4,5. Med en stigende areal omfanget af hypoxi og iltmangel, macrofauna påvirkes negativt og miste habitat omfang og habitat kvalitet. Klimaændringer forventes for at forværre hypoxi og iltmangel6.
I mange stratificeret, næringsstof-beriget flodmundinger som Chesapeake Bay i USA, sæsonkorrigerede vedvarende iltmangel kan sejre og kan forekomme år efter år2. Derudover diel-cykling af hypoxi er hyppige i flodmundinger som Chesapeake Bay og andre steder og opstår sent i løbet af natten eller de tidlige morgentimer i sommeren7,8.
De fleste undersøgelser har fokuseret på effekten af kontinuerlig eksponering af organismer til lav [] og deres tolerance at hypoxi og iltmangel9,10,11,12,13,14 . Desuden, undersøgelser har kiggede på de store skift i artssammensætning distributioner, mængder og arter i svar til udvidet lav []4,15. Ofte arter, der er meget følsomme over for lav [DO], dør i masserne,16 skiftende den resterende arter til en yngre, mindre og mellemstore, kortlivede fauna som for eksempel fundet på Louisiana-Texas hylde økosystem4.
Adfærdsmæssige ændringer typisk gå forud for Fællesskabets sammenbrud17 og studier har rapporteret om adfærdsmæssige reaktioner af organismer til udvidet lav []4,16,17,18,19 ,20,21,22,23,24,25. Disse undersøgelser, dog fokus ikke på svarene fra organismer til diel-cykling engagementer af hypoxi og den svingende karakter af [] tilgængelighed i flodmundinger.
Diel-cykling hypoxi i lavvandede flodmundinger har fået stigende bevidsthed som undersøgelser overvåge [gøre] mere hyppigt i løbet af dage med sondes i flodmundinger16,26. Vand kan forblive hypoksiske for timer i slutningen af natten eller tidlig morgentimer om sommeren når der er ingen ilt-genererende fotosyntese i løbet af natten men høj ilt-forbrugende aerob respiration7,16. Det konstateredes også, at tidevandet påvirket diel cykling i lave betingelser med den mest ekstreme minima observeret Hvornår lavvande faldt sammen med slutningen af natten27. Først efter flere timer af hypoxi betyder [gøre] vende tilbage til normoxia7,16,28 i den daglige cyklus.
Til at bestemme den adfærdsmæssige reaktion på C. virginica diel-cykling hypoxi og pH vi kontrolleret åbning og lukning af ventiler af østers udsat for laboratoriet induceret diel cykling [do] og cykliske pH. Måbe svar af muslinger har været brugt til at påvise negative miljømæssige forhold. Ventil lukninger af muslinger i svar til forurenende stoffer29,30,31, giftige alger32,33,34, varmeforurening35,36 , 37, mad mængde falde38,39,40, fodring regime39,41, emersion37,42, lysperiode43 , 44, pH45,46, og kombinerede pH og oploest ilt47 er blevet målt. Måbe teknikker har, for eksempel, inkluderet direkte observationer48,49,13, kontinuerlige målinger ved hjælp af reed switches og magneter (Dreissena skærm)50eller fiber-optiske sensorer 51 der kræver klare vand. Derudover har magnet og magnetiske felt styrke Hall sensorer været brugt til at studere mussel måbe vinkel52,53,54,55, og en højfrekvente elektromagnetiske induktion system kan foranstaltningen den varierende afstand mellem to elektriske spoler, der er limet på ventilerne har været brugt56,57,58,59. En høj spændingskilde er nødvendig for den elektromagnetiske induktion system og magt skal leveres til begge sider af shell52. Dette system er også kommercielt tilgængelige som “MOSSELMONITOR” (http://mosselmonitor.nl/).
På en stram forskningsbudget, vi bygget en billig strain gauge skærm (sdb) at løbende måle oyster måbe over laboratorium-induceret diel cykling [do] og pH, under lav sigtbarhed. Vores system er også langt enklere end konkurrerende systemer, så mange dyr, der skal være instrumenteret under et eksperiment. Vi ønskede at afgøre C. virginica adfærdsmæssige Reaktionerne diel cykling svær ([gøre] = 0,6 mg/L) hypoxi med kontrol pH (pH = 7,8) og cykling pH (pH = 7,8-7,0), henholdsvis, og måbe svar til mild ([gøre] = 1,7 mg/L) hypoxi. Desuden, vi ønskede at afgøre, om østers er hurtigt reagere på ændringer i [gøre] over diel cyklus og hvordan de reagerer når normoxia vender tilbage efter en hypoksiske begivenhed. Måske er østers optimalt tilpasses hurtigt skiftende miljø, som findes i mange flodmundinger16,27 , hvor de lever. Mens mere komplekse ventil måbe skærme er tilgængelige, tilbyder SGM en billig teknik, der giver mulighed for kontinuerlig måling af ventil måbe i farvande selv under forhold med dårlig sigtbarhed.
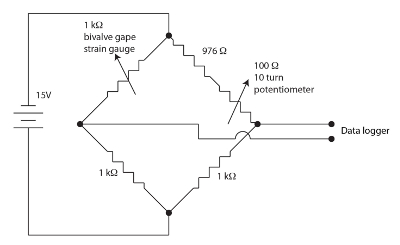
Figur 1. Wheatstone bro til valve måbe apparater. Venligst klik her for at se en større version af dette tal.
Strain gauge sensorer til overvågning toskallede måbe er resistiv film i en bugte mønster på en polyimid opbakning. Små mængder af pres modulere modstand af sensoren. Toskallede bøjer strain gage når det gapes forårsager en ændring i sensorens modstand. Vi ansat en værdiløs, afbalanceret, Wheatstone bro for hver toskallede kanal som vist i figur 1 til at måle ændringen i sensor modstand. Wheatstone broen er nulled af potentiometeret giver en temmelig stor gevinst at være ansat af en datalogger. En Wheatstone bro er en standardmetode til præcis måling af en ukendt modstand ved hjælp af et forhold til en kendt modstand standard og et voltmeter. Historien om denne meget gamle teknik er beskrevet i Ekelof (2001)60. Vi integreret 12 kanaler, hver med sin egen Wheatstone bro og værdiløs potentiometer, i Strain Gauge skærm (sdb) enhed.
Protocol
Representative Results
Discussion
Typiske undersøgelser fokus på det løbende, udvidet tidsperioder med lav ilt betingelser og svar, ofte målt som overlevelse af dyr. I øjeblikket er vores forståelse af de adfærdsmæssige reaktioner af dyr på diel-cykling hypoxi dog minimal63. Således bør flere undersøgelser fokusere på opførsel af organismer i svar på diel-cykling hypoxi, som forekommer regelmæssigt i løbet af sommeren i mange flodmundinger7,8.
<p class…Divulgazioni
The authors have nothing to disclose.
Acknowledgements
Vi takker Melinda Forseth for at tage billeder af østers og måle deres måbe bredde i ImageJ. Vi takker Denise Breitburg for adgang til akvarier med diel cykling hypoxi og cykliske pH betingelser. Vi takker Smithsonian Environmental Research Center, Edgewater, Maryland, for plads til eksperimenter. Hypoxi eksperimenter blev finansieret af en National Oceanic and Atmospheric Administration – Center for sponsoreret kystnære Ocean Research grant nr. NA10NOS4780138 og Smithsonian Hunterdon fond til Denise Breitburg. Ventilen måbe målinger under hypoxi eksperimenter blev finansieret af et fakultet Enhancement tilskud af Washington College til Elka T. Porter.
Materials
| Campbell CR 10x data logger | Campbell Scientific, Logan, Utah | Or other data logger. At Campbell the CR 10X has been replaced with the CR 1000 | |
| Campbell CR 10x multiplexer | Campbell Scientific, Logan, Utah | Data logger needs to have space for 12 channels | |
| Dsub connector male crimp pins | TE Connectivity | 205089-1 | pins for gape sensor leads |
| PCA tape | Micro Measurements Corp, NC | To seal the strain gauge | |
| Duro Quick Gel | Ace Hardware | Superglue | |
| SG13/1000-LY43 or LY41 | Omega Engineering Inc., Stanford, CT | Strain gauges | |
| 32 AWG (7/40) teflon Alpha wires | AlphaWire, Elizabeth, NJ | 2840/7 | Sensor cables, different colors are available |
| 1/16" heat shrink tubing | Qualtek | B01A3QKKO6 | To seal the leads of the sensor cable |
| Weller WES51 Analog Soldering Station | Amazon | Lots of soldering, need a good soldering iron. https://www.amazon.com/Weller-WES51-Analog-Soldering-Station/dp/B000BRC2XU/ref=sr_1_23?s=hi&ie=UTF8&qid=1505654295 &sr=1-23&keywords=soldering+iron |
|
| Rosin Soldering Flux Paste | Amazon | Needed for soldering | |
| 60-40 Tin Lead Rosin Core Solder Wire | Amazon | Needed for soldering | |
| Aquarium sealant | Home Depot | Attach sensors to bivalve | |
| PC Laptop | Any old PC to run Campbell gape program | ||
| heat gun | Amazon | shrink shrink tubing | |
| Drill | Hardware store, Amazon | for twisting wires to make sensor cables | |
| AC to DC power module | Acopian | DB15-30 | Wheatstone bridge power supply |
| Poteniometer | Clarostat | 733A | Wheatsone bridge nulling |
| isolating BNC connector | Sterren Electronics | "200-148 | Wheatstone bridge output for multimeter |
| Fused AC receptical panel module | Adam technologies | IEC-GS-1-200 | Wheatstone bridge power supply connector |
| 976 ohm 1% resistor | Vishay Dale | CMF50976R00FHEB | Wheatstone bridge resistor |
| 1 kohm 1% resistor | Vishay Dale | CMF501K0000FHEB | Wheatstone bridge resistor |
| Potentiometer scale dial | Kilo International | 462 | 10 turn dial for nulling potentiometer |
| DB25 male panel connector | TE connectivity | 1757819-8 | Data logger connector on Wheatstone bridge |
| DB25 female panel connector | TE connectivity | 1757819-8 | Sensor connector to Wheatstone bridge |
| perforated circuit board | Vector electronics | 64P44WE | circuit board for mounting of bridge components |
| enclosure | Hammond Manufacturing | 1444-29 | Enclosure for sensor readout electronics |
Riferimenti
- Vaquer-Sunyer, R., Duarte, C. M. Thresholds of hypoxia for marine biodiversity. Proceedings of the National Academy of Sciences of the United States of America. 105 (40), 15452-15457 (2008).
- Diaz, R. J., Rosenberg, R. Spreading dead zones and consequences for marine ecosystems. Science. 321, 926-929 (2008).
- Levin, L. A., Breitburg, D. L. Linking coasts and seas to address ocean deoxygenation. Nature Climate Change. 5, 401-403 (2015).
- Diaz, R. J., Rosenberg, R. Marine benthic hypoxia: A review of its ecological effects and the behavioural responses of benthic macrofauna. Oceanography and Marine Biology: An annual Review. 33, 245-303 (1995).
- Patterson, H. K., Boettcher, A., Carmichael, R. H. Biomarkers of dissolved oxygen stress in oysters: a tool for restoration and management efforts. PLoS One. 9 (8), 104440 (2014).
- Altieri, A. H., Gedan, K. B. Climate change and dead zones. Global Change Biology. 21 (4), 1395-1406 (2015).
- Tyler, R. M., Brady, D. C., Targett, T. E. Temporal and spatial dynamics of diel-cycling hypoxia in estuarine tributaries. Estuaries and Coasts. 32 (1), 123-145 (2009).
- Breitburg, D. L., et al. Landscape-level variation in disease susceptibility related to shallow-water hypoxia. PLoS One. 10 (2), 0116223 (2015).
- Stickle, W. B., Kapper, M. A., Liu, L. -. L., Gnaiger, E., Wang, S. Y. Metabolic adaptations of several species of crustaceans and molluscs to hypoxia: toterance and microcalometric studies. Biological Bulletin. 177 (2), 303-312 (1989).
- Gamenick, I., Jahn, A., Vopel, K., Guiere, O. Hypoxia and sulphide as structuring factors in a macrozoobenthic community on the Baltic Sea shore: colonization studies and tolerance experiments. Marine Ecology Progress Series. , 73-85 (1996).
- Modig, H., Olafsson, E. Responses of Baltic benthic invertebrates to hypoxic events. Journal of Experimental Marine Biology and Ecology. 229 (1), 133-148 (1998).
- Riedel, B., Zuschin, M., Stachowitsch, M. Tolerance of benthic macrofauna to hypoxia and anoxia in shallow coastal seas: a realistic scenario. Marine Ecology Progress Series. 458, 39-52 (2012).
- Lombardi, S. A., Harlan, N. P., Paynter, K. T. Survival, acid-base balance, and gaping responses of the Asian Oyster C. ariakensis and the Eastern Oyster C. virginica during clamped emersion and hypoxic immersion. Journal of Shellfish Research. 32 (2), 409-415 (2013).
- Jansson, A., Norkko, J., Dupont, S., Norkko, A. Growth and survival in a changing environment: Combined effects of moderate hypoxia and low pH on juvenile bivalve Macoma balthica. Journal of Sea Research. 102, 41-47 (2015).
- Gooday, A. J., et al. Faunal responses to oxygen gradients on the Pakistan margin: A comparison of foraminiferans, macrofauna and megafauna. Deep Sea Research Part II: Topical Studies in Oceanography. 56 (6-7), 488-502 (2009).
- Montagna, P. A., Ritter, C. Direct and indirect effects of hypoxia on benthos in Corpus Christi Bay, Texas, U.S.A. Journal of Experimental Marine Biology and Ecology. 330 (1), 119-131 (2006).
- Villnas, A., Norkko, J., Lukkari, K., Hewitt, J., Norkko, A. Consequences of increasing hypoxic disturbance on benthic communities and ecosystem functioning. PLoS One. 7 (10), 44920 (2012).
- Breitburg, D. Effects of hypoxia, and the balance between hypoxia and enrichment on coastal fishes and fisheries. Estuaries. 25 (4), 767-781 (2002).
- Costantini, M., et al. Effect of hypoxia on habitat quality of striped bass (Morone saxatilis) in Chesapeake Bay. Canadian Journal of Fisheries and Aquatic Sciences. 65 (5), 989-1002 (2008).
- Ludsin, S. A., et al. Hypoxia-avoidance by planktivorous fish in Chesapeake Bay: Implications for food web interactions and fish recruitment. Journal of Experimental Marine Biology and Ecology. 381, 121-131 (2009).
- Zhang, H., et al. Hypoxia-driven changes in the behavior and spatial distribution of pelagic fish and mesozooplankton in the northern Gulf of Mexico. Journal of Experimental Marine Biology and Ecology. 381, 80-91 (2009).
- Sparks, B. L., Strayer, D. L. Effects of low dissolved oxygen on juvenile Elliptio complanata (Bivalvia:Unionidae). Journal of the Norther American Benthological Society. 17, 129-134 (1998).
- Llanso, R. J. Effects of hypoxia on estuarine benthos: the lower Rappahannock River (Chesapeake Bay), a case study. Estuarine, Coastal and Shelf Science. 35 (5), 491-515 (1992).
- Riedel, B., Zuschin, M., Haselmair, A., Stachowitsch, M. Oxygen depletion under glass: Behavioural responses of benthic macrofauna to induced anoxia in the Northern Adriatic. Journal of Experimental Marine Biology and Ecology. 367 (1), 17-27 (2008).
- Riedel, B., et al. Effect of hypoxia and anoxia on invertebrate behaviour: Ecological perspectives from species to community level. Biogeosciences. 11 (6), 1491-1518 (2014).
- Breitburg, D. L. Near-shore hypoxia in the Chesapeake Bay: Patterns and relationships among physical factors. Estuarine Coastal and Shelf Science. 30, 593-609 (1990).
- Baumann, H., Wallace, R. B., Tagliaferri, T., Gobler, C. J. Large natural pH, CO2 and O2 fluctuations in a temperate tidal salt marsh on diel, seasonal, and interannual time scales. Estuaries and Coasts. 38, 220-231 (2015).
- Breitburg, D. L., et al. Landscape-level variation in disease susceptibility related to shallow-water hypoxia. PLoS One. 10 (2), 0116223 (2015).
- de Zwart, D., Kramer, J. M., Jenner, H. A. Practical experiences with the biological early warning system “mosselmonitor”. Environmental Toxicology and Water Quality. 10 (4), 237-247 (1995).
- Kadar, E., et al. Avoidance responses to aluminum in the freshwater bivalve Anodonta cygnea. Aquatic Toxicology. 55, 137-148 (2001).
- Soliman, M. F. M., El-Shenawy, N. S., Tadros, M. M., Abd El-Azeez, A. A. Impaired behavior and changes in some biochemical markers of bivalve (Ruditapes decussatus) due to zinc toxicity. Toxicological & Environmental Chemistry. 97 (5), 674-686 (2015).
- Shumway, S. E., Cucci, T. L. The effects of the toxic dinoflagellate Protogonyaulax tamarensis on the feeding and behaviour of bivalve molluscs. Aquatic Toxicology. 10, 9-27 (1987).
- Basti, L., et al. Effects of the toxic dinoflagellate Heterocapsa circularisquama on the valve movement behaviour of the Manila clam Ruditapes philippinarum. Aquaculture. 291 (1-2), 41-47 (2009).
- Tran, D., Haberkorn, H., Soudant, P., Ciret, P., Massabuau, J. -. C. Behavioral responses of Crassostrea gigas exposed to the harmful algae Alexandrium minutum. Aquaculture. 298 (3-4), 338-345 (2010).
- Shumway, S. E., Koehn, R. K. Oxygen consumption in the American oyster Crassostrea virginica. Marine Ecology Progress Series. 9, 59-68 (1982).
- Nicastro, K. R., Zardi, G. I., McQuaid, C. D., Pearson, G. A., Serrao, E. A. Love thy neighbour: group properties of gaping behaviour in mussel aggregations. PLoS One. 7 (10), (2012).
- Dowd, W. W., Somero, G. N. Behavior and survival of Mytilus. congeners following episodes of elevated body temperature in air and seawater. Journal of Experimental Biology. 216 (3), 502-514 (2013).
- Higgins, P. J. Effects of food availability on the valve movements and feeding behavior of juvenile Crassostrea virginica (Gmelin). I. Valve movements and periodic activity. Journal of Experimental and Experimental Marine Biology and Ecology. 45, 229-244 (1980).
- Riisgård, H. U., Lassen, J., Kittner, C. Valve-gape response times in mussels (Mytilus edulis)-Effects of laboratory preceding-feeding conditions and in situ tidally induced variation in phytoplankton biomass. Journal of Shellfish Research. 25, 901-911 (2006).
- Robson, A. A., De Leaniz, C. G., Wilson, R. P., Halsey, L. G. Behavioural adaptations of mussels to varying levels of food availability and predation risk. Journal of Molluscan Studies. 76, 348-353 (2010).
- Robson, A. A., de Leaniz, C. G., Wilson, R. P., Halsey, L. G. Effect of anthropogenic feeding regimes on activity rhythms of laboratory mussels exposed to natural light. Hydrobiologia. 655, 197-204 (2010).
- Nicastro, K. R., Zardi, G. I., McQuaid, C. D., Stephens, L., Radloff, S., Blatch, G. L. The role of gaping behaviour in habitat partitioning between coexisting intertidal mussels. BMC Ecology. 10, 17 (2010).
- Loosanoff, V. S., Nomejko, C. A. Feeding of oysters in relation to tidal stages and to periods of light and darkness. Biological Bulletin. 90 (3), 244-264 (1946).
- Comeau, L. A., Mayrand, E., Mallet, A. Winter quiescence and spring awakening of the Eastern oyster Crassostrea virginica at its northernmost distribution limit. Marine Biology. 159 (10), 2269-2279 (2012).
- Pynonnen, K. S., Huebner, J. Effects of episodic low pH exposure on the valve movements of the freshwater bivalve Anodonta cygnea L. Water Research. 29 (11), 2579-2582 (1995).
- Jakubowska, M., Normant-Saremba, M. The effect of CO2-induced seawater acidification on the behaviour and metabolic rate of the baltic clam Macoma balthica. Annales Zoologici Fennici. 52 (5-6), 353-367 (2015).
- Jakubowska, M., Normant, M. Metabolic rate and activity of blue mussel Mytilus edulis trossulus.under short-term exposure to carbon dioxide-induced water acidification and oxygen deficiency. Marine and Freshwater Behaviour and Physiology. 48 (1), 25-39 (2015).
- Newell, C. R., Wildish, D. J., MacDonald, B. A. The effects of velocity and seston concentration on the exhalent siphon area, valve gape and filtration rate of the mussel Mytilus edulis. Journal of Experimental Marine Biology and Ecology. 262, 91-111 (2001).
- Maire, O., Amouroux, J. -. M., Duchene, J. -. C., Gremare, A. Relationship between filtration activity and food availability in the Mediterranean mussel Mytilus galloprovincialis. Marine Biology. 152 (6), 1293-1307 (2007).
- Borcherding, J. Ten years of practical experience with the Dreissena-monitor, a biological early warning system for continuous water quality monitoring. Hydrobiologia. 556 (1), 417-426 (2006).
- Frank, D. M., Hamilton, J. F., Ward, E. E., Shumway, S. E. A fiber optic sensor for high resolution measurement and continuous monitoring of valve gape in bivalve molluscs. Journal of Shellfish Research. 26 (2), 575-580 (2007).
- Wilson, R., Reuter, P., Wahl, M. Muscling in on mussels: New insights into bivalve behaviour using vertebrate remote-sensing technology. Marine Biology. 147 (5), 1165-1172 (2005).
- Nagai, K., Honjo, T., Go, J., Yamashita, H., Seok Jin, O. Detecting the shellfish killer Heterocapsa circularisquama (Dinophyceae) by measuring bivalve valve activity with a Hall element sensor. Aquaculture. 255 (1-4), 395-401 (2006).
- Robson, A., Wilson, R., de Leaniz, C. G. Mussels flexing their muscles: a new method for quantifying bivalve behaviour. Marine Biology. 151 (3), 1195-1204 (2007).
- Robson, A. A., Thomas, G. R., de Leaniz, C. G., Wilson, R. P. Valve gape and exhalant pumping in bivalves: optimization of measurement. Aquatic Biology. 6 (1-3), 191-200 (2009).
- de Zwart, D., Kramer, J. M., Jenner, H. A. Practical experiences with the biological early warning system “mosselmonitor”. Environmental Toxicology and Water Quality. 10 (4), 237-247 (1995).
- Jou, L. -. J., Lin, S. -. C., Chen, B. -. C., Chen, W. -. Y., Liao, C. -. M. Synthesis and measurement of valve activities by an improved online clam-based behavioral monitoring system. Computers and Electronics in Agriculture. 90, 106-118 (2013).
- Barile, N. B., Scopa, M., Recchi, S., Nerone, E. Biomonitoring of coastal marine waters subject to anthropogenic use: development and application of the biosensor Mosselmonitor. Ovidius University Annals of Chemistry. 27 (2), 81-86 (2016).
- Ballesta-Artero, I., Witbaard, R., Carroll, M. L., van der Meer, J. Environmental factors regulating gaping activity of the bivalve Arctica islandica in Northern Norway. Marine Biology. 164 (5), 116 (2017).
- Ekelof, S. The genesis of the Wheatstone bridge. Engineering Science and Education Journal. 10, 37-40 (2001).
- Keppel, A. G., Breitburg, D. L., Wikfors, G. H., Burrell, R. B., Clark, V. M. Effects of co-varying diel-cycling hypoxia and pH on disease susceptibility in the eastern oyster Crassostrea virginica. Marine Ecology Progress Series. 538, 169-183 (2015).
- Burrell, R. B., Keppel, A. G., Clark, V. M., Breitburg, D. L. An automated monitoring and control system for flow-through co-cycling hypoxia and pH experiments. Limnology and Oceanography: Methods. 14, 168-185 (2015).
- Porter, E. T., Breitburg, D. L. Eastern oyster Crassostrea virginica, valve gape behavior under diel-cycling hypoxia. Marine Biology. 163 (218), (2016).
- Bergeron, C. M. . The impact of sediment resuspension on mercury cycling and the bioaccumulation of methylmercury into benthic and pelagic organisms. , (2005).

