प्रयोगशाला प्रेरित Diel-सायक्लिंग हाइपोक्सिया और पीएच के जवाब में Bivalve मोलस्क में सतत वाल्व खोलना माप के लिए एक तनाव गेज मॉनिटर (SGM)
Summary
bivalve निलंबन के व्यवहार प्रतिक्रियाओं को समझना पर्यावरण चर के लिए भक्षण, इस तरह के ऑक्सीजन भंग के रूप में, कुछ पारिस्थितिकी तंत्र प्रक्रियाओं की व्याख्या कर सकते हैं । हम एक सस्ती विकसित की है, प्रयोगशाला आधारित, तनाव गेज मॉनिटर (SGM) कस्तूरी, Crassostrea virginica, diel साइकिल चालन हाइपोक्सिया और चक्रीय पीएच के लिए वाल्व खोलना प्रतिक्रियाओं को मापने के लिए ।
Abstract
एक सस्ती, प्रयोगशाला आधारित, तनाव गेज वाल्व खोलना मॉनिटर (SGM) diel-सायक्लिंग हाइपोक्सिया के जवाब में bivalve मोलस्क के वाल्व खोलना व्यवहार पर नजर रखने के लिए विकसित किया गया था । एक ह्वीटस्टोन पुल तनाव गेज से जुड़ा हुआ था जो कस्तूरी (Crassostrea virginica) के गोले से जुड़ी हुई थी । रिकॉर्ड खोलने और bivalves के समापन के लिए अनुमति दी लगातार दो दिन की अवधि के प्रयोग पर दर्ज किया जाना प्रेरित diel-सायक्लिंग हाइपोक्सिया और diel-पीएच में साइकिल चालन परिवर्तन । यहां, हम एक सस्ती तनाव गेज की निगरानी के विकास के लिए एक प्रोटोकॉल का वर्णन और वर्णन, एक उदाहरण प्रयोगशाला प्रयोग में, हम कैसे यह पूर्वी कस्तूरी (सी virginica) के वाल्व खोलना व्यवहार को मापने के लिए इस्तेमाल किया, के जवाब में diel-सायक्लिंग हाइपोक्सिया और पीएच में चक्रीय परिवर्तन । वाल्व की दूरी पर मापा गया था कस्तूरी चक्रीय गंभीर hypoxic के अधीन (०.६ mg/l) के साथ और पीएच में चक्रीय परिवर्तन के बिना ऑक्सीजन शर्तों भंग, चक्रीय हल्के hypoxic (१.७ mg/l) शर्तों और normoxic (७.३ mg/l) शर्तों. हम यह है कि जब कस्तूरी दोहराया diel चक्र मुठभेड़ का प्रदर्शन, वे तेजी से गंभीर हाइपोक्सिया के जवाब में अपने गोले बंद और हल्के हाइपोक्सिया के लिए एक समय अंतराल के साथ बंद । जब normoxia को बहाल किया जाता है, वे तेजी से फिर से खुला । कस्तूरी diel सायक्लिंग गंभीर हाइपोक्सिया पर चक्रीय पीएच शर्तों आरोपित का जवाब नहीं था । कम ऑक्सीजन की स्थिति में, एक तिहाई से अधिक कस्तूरी एक साथ बंद कर दिया । हम प्रदर्शित करते है कि कस्तूरा diel-सायक्लिंग हाइपोक्सिया, जो bivalves के व्यवहार का आकलन जब ऑक्सीजन भंग करने के लिए विचार किया जाना चाहिए का जवाब । वाल्व SGM भंग ऑक्सीजन या दूषित पदार्थों में परिवर्तन करने के लिए bivalve मोलस्क की प्रतिक्रियाओं का आकलन करने के लिए इस्तेमाल किया जा सकता है । तकनीक सील बेहतर करने के लिए सील वाल्व खोलना समुद्र के पानी से तनाव गेज सेंसरों की दीर्घायु को बढ़ाने के लिए आगे सुधार की जरूरत है ।
Introduction
हाइपोक्सिया, यानी, ऑक्सीजन सांद्रता भंग [क्या] पर्याप्त रूप से नकारात्मक जैविक और पारिस्थितिक प्रक्रियाओं को प्रभावित करने के लिए, लेकिन अक्सर कार्यात्मक रूप [के रूप में परिभाषित] < 2 mg/l1, और anoxia (कार्य के रूप में परिभाषित [do] के 0.0-0.2 mg/l) अधिक बार और गंभीर रूप से उत्पंन कर रहे है दुनिया के तटीय जल, ज्वारनदमुख और गहरे महासागर में2,3 और अक्सर eutrophication4,5बढ़ाने से बढ़ा रहे हैं । हाइपोक्सिया और anoxia के एक बढ़ती आरईएल सीमा के साथ, macrofauna नकारात्मक प्रभाव और निवास सीमा और आवास की गुणवत्ता खो रहे हैं । जलवायु परिवर्तन हाइपोक्सिया और anoxia6खराब करने की भविष्यवाणी की है ।
कई स्तरीकृत में, पोषक तत्वों से समृद्ध ज्वारनदमुख जैसे Chesapeake खाड़ी, संयुक्त राज्य अमरीका, मौसम लगातार हाइपोक्सिया प्रबल कर सकते है और वर्ष के बाद साल2हो सकता है । इसके अलावा, हाइपोक्सिया के diel-सायक्लिंग ज्वारनदमुख में Chesapeake खाड़ी और अंय स्थानों के रूप में लगातार है और देर रात या गर्मियों में सुबह घंटे के दौरान7,8है ।
अधिकांश अध्ययनों से कम करने के लिए जीवों के निरंतर जोखिम के प्रभाव पर ध्यान केंद्रित किया है [DO] और हाइपोक्सिया और anoxia के लिए उनकी सहिष्णुता पर9,10,11,12,13,14 . इसके अलावा, अध्ययन प्रजातियों के वितरण, बहुतायत में बड़े पैमाने पर बदलाव को देखा है, और प्रजातियों के लिए विस्तारित कम के जवाब में संरचना []4,15। अक्सर प्रजातियों कि बहुत कम करने के लिए संवेदनशील है [DO], जनता में मर जाते हैं,16 एक छोटी, छोटे आकार, लघु के रूप में रहने वाले जीव के लिए शेष प्रजातियों स्थानांतरण, उदाहरण के लिए, लुइसियाना पर पाया-टेक्सास शेल्फ पारिस्थितिकी तंत्र4।
व्यवहार परिवर्तन आम तौर पर समुदाय पतन से पहले17 और अध्ययन जीवों की व्यवहार प्रतिक्रियाओं पर सूचित किया है कम करने के लिए बढ़ाया [DO]4,16,17,18,19 ,20,21,22,23,24,25। इन अध्ययनों से, तथापि, जीवों की प्रतिक्रियाओं पर ध्यान केंद्रित नहीं करने के लिए diel-हाइपोक्सिया के सायक्लिंग जोखिम और के अस्थिर प्रकृति [do] ज्वारनदमुख में उपलब्धता.
Diel-साइकिलिंग हाइपोक्सिया उथले ज्वारनदमुख में अध्ययन की निगरानी के रूप में बढ़ती जागरूकता प्राप्त किया है [क्या]16ज्वारनदमुख,26में sondes के साथ दिन के पाठ्यक्रम पर अधिक बार । पानी रात के अंत में घंटे के लिए hypoxic रह सकता है या गर्मियों में सुबह घंटे जब वहां कोई ऑक्सीजन पैदा कर रहा है रात के दौरान प्रकाश संश्लेषण लेकिन उच्च ऑक्सीजन लेने वाली एरोबिक श्वसन7,16। यह भी पाया गया कि ज्वार की सबसे चरम minima के साथ कम कर शर्तों के diel सायक्लिंग प्रभावित जब कम ज्वार रात27के अंत के साथ मेल किया । हाइपोक्सिया के कई घंटे के बाद ही करता है [क्या] normoxia7,16,28 दैनिक चक्र में वापस आ जाओ ।
diel-सायक्लिंग हाइपोक्सिया और पीएच के लिए सी virginica के व्यवहार प्रतिक्रिया का निर्धारण करने के लिए हम पर नजर रखने के उद्घाटन और कस्तूरी के वाल्व के बंद करने के लिए प्रेरित प्रयोगशाला diel सायक्लिंग के [करना] और चक्रीय पीएच । bivalves के जवाब खोलना प्रतिकूल पर्यावरणीय परिस्थितियों का पता लगाने के लिए इस्तेमाल किया गया है । संदूषण के जवाब में bivalves के वाल्व क्लोजर29,30,31, विषाक्त शैवाल३२,३३,३४, थर्मल प्रदूषण३५,३६ , ३७, खाद्यान्न मात्रा घटने३८,३९,४०, फीडिंग रेट्स३९,४१, emersion३७,४२, photoperiod४३ , ४४, पीएच४५,४६, और संयुक्त पीएच और भंग ऑक्सीजन४७ मापा गया है । खोलना तकनीक है, उदाहरण के लिए, प्रत्यक्ष प्रेक्षणों४८,४९,13, सतत रीड स्विच और मैग्नेट (Dreissena मॉनिटर)५०, या फाइबर ऑप्टिक सेंसर का उपयोग कर माप शामिल ५१ कि साफ पानी की आवश्यकता होती है । इसके अलावा, चुंबक और चुंबकीय क्षेत्र शक्ति हॉल सेंसर कौड़ी खोलना कोण५२,५३,५४,५५, और एक उच्च आवृत्ति विद्युत चुंबकीय प्रेरण प्रणाली का अध्ययन करने के लिए इस्तेमाल किया गया है कि वाल्व पर चिपके हुए हैं कि दो बिजली के तार के बीच अलग दूरी को मापने कर सकते हैं५६,५७,५८,५९इस्तेमाल किया गया है । एक उच्च वोल्टेज स्रोत विद्युत प्रेरण प्रणाली और बिजली के लिए आवश्यक है खोल५२के दोनों पक्षों को दिया है । यह प्रणाली “MOSSELMONITOR” (http://mosselmonitor.nl/) के रूप में भी व्यावसायिक रूप से उपलब्ध है ।
एक तंग अनुसंधान बजट पर, हम एक सस्ती तनाव गेज की निगरानी (SGM) का निर्माण लगातार के लिए प्रयोगशाला पर कस्तूरा खोलना-प्रेरित diel सायक्लिंग [DO] और पीएच कम दृश्यता की स्थिति के तहत, उपाय । हमारी प्रणाली भी प्रतिस्पर्धा प्रणालियों की तुलना में बहुत आसान है, कई जानवरों की अनुमति एक प्रयोग के दौरान साधन हो । हम सी के व्यवहार प्रतिक्रियाओं का निर्धारण करना चाहते थे . virginica diel सायक्लिंग गंभीर ([do] = ०.६ मिलीग्राम/l) नियंत्रण पीएच (पीएच = ७.८) और सायक्लिंग पीएच (पीएच = 7.8-7.0), क्रमशः, और हल्के करने के लिए प्रतिक्रियाओं ([do] = १.७ मिलीग्राम/l) हाइपोक्सिया के साथ हाइपोक्सिया । इसके अलावा, हम अगर कस्तूरी को तेजी से [क्या में परिवर्तन का जवाब कर सकते है निर्धारित करना चाहता था] diel चक्र से अधिक है और वे कैसे प्रतिक्रिया जब एक hypoxic घटना के बाद normoxia रिटर्न । शायद कस्तूरी इष्टतम तेजी से अस्थिर वातावरण है कि कई ज्वारनदमुख16,27 में पाया जाता है कि वे कहां रहते है अनुकूलित कर रहे हैं । जबकि अधिक जटिल वाल्व खोलना पर नज़र रखता है उपलब्ध हैं, SGM एक सस्ती तकनीक है कि कम दृश्यता की स्थिति में भी पानी में वाल्व खोलना की सतत माप की अनुमति देता है प्रदान करता है ।
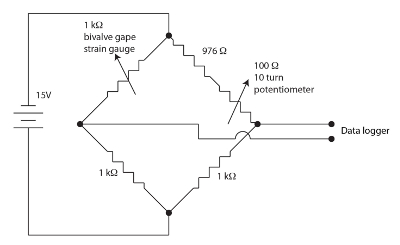
चित्र 1. वाल्व खोलना तंत्र के लिए ह्वीटस्टोन पुल । कृपया यहां क्लिक करें इस आंकड़े का एक बड़ा संस्करण को देखने के लिए ।
bivalve खोलना निगरानी के लिए इस्तेमाल किया तनाव गेज सेंसर एक polyimide समर्थन पर एक बल पैटर्न में विरोध फिल्मों रहे हैं । तनाव की छोटी मात्रा में सेंसर का प्रतिरोध मिलाना । bivalve फ्लेक्स तनाव ललकार जब यह है सेंसर प्रतिरोध में परिवर्तन के कारण मुर्गियों । हम प्रत्येक bivalve चैनल के लिए एक अशक्त, संतुलित, ह्वीटस्टोन पुल के रूप में चित्रा 1 में दिखाया सेंसर प्रतिरोध में परिवर्तन को मापने के लिए कार्यरत हैं । ह्वीटस्टोन पुल डेटा लकड़हारा द्वारा नियोजित किया जा करने के लिए एक काफी अधिक लाभ की अनुमति नापने द्वारा नल है । एक ह्वीटस्टोन पुल सही एक ज्ञात प्रतिरोध मानक और एक वाल्टमीटर के लिए एक अनुपात का उपयोग कर एक अज्ञात प्रतिरोध को मापने के लिए एक मानक विधि है । इस बहुत पुरानी तकनीक का इतिहास Ekelof (२००१)६०में चर्चा की है । हम एकीकृत 12 चैनलों, अपने स्वयं के ह्वीटस्टोन पुल और नल नापने के साथ, तनाव गेज मॉनिटर (SGM) इकाई में ।
Protocol
Representative Results
Discussion
ठेठ अध्ययन कम ऑक्सीजन की स्थिति और प्रतिक्रिया, अक्सर पशुओं के अस्तित्व के रूप में मापा के निरंतर, विस्तारित समय अवधि पर ध्यान केंद्रित । हालांकि, वर्तमान में, diel-सायक्लिंग हाइपोक्सिया करने के लिए पशुओ?…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
हम कस्तूरी की तस्वीरें लेने और ImageJ में उनकी दूरी की चौड़ाई को मापने के लिए मेलिंडा फोरसिथ धंयवाद । हम diel सायक्लिंग हाइपोक्सिया और चक्रीय पीएच शर्तों के साथ aquaria के लिए उपयोग के लिए डेनिस Breitburg धंयवाद । हम स्मिथसोनियन पर्यावरण अनुसंधान केंद्र, Edgewater, मैरीलैंड, प्रयोगों के लिए अंतरिक्ष के लिए धंयवाद । हाइपोक्सिया प्रयोगों एक राष्ट्रीय ओशियानिक और वायुमंडलीय प्रशासन द्वारा वित्त पोषित किया गया केंद्र के लिए प्रायोजित तटीय महासागर अनुसंधान अनुदान No. NA10NOS4780138 और स्मिथसोनियन Hunterdon कोष डेनिस Breitburg के लिए । हाइपोक्सिया प्रयोगों के दौरान वाल्व दूरी माप वाशिंगटन कॉलेज द्वारा एक संकाय संवर्धन अनुदान द्वारा वित्त पोषित किया गया Elka टी पोर्टर ।
Materials
| Campbell CR 10x data logger | Campbell Scientific, Logan, Utah | Or other data logger. At Campbell the CR 10X has been replaced with the CR 1000 | |
| Campbell CR 10x multiplexer | Campbell Scientific, Logan, Utah | Data logger needs to have space for 12 channels | |
| Dsub connector male crimp pins | TE Connectivity | 205089-1 | pins for gape sensor leads |
| PCA tape | Micro Measurements Corp, NC | To seal the strain gauge | |
| Duro Quick Gel | Ace Hardware | Superglue | |
| SG13/1000-LY43 or LY41 | Omega Engineering Inc., Stanford, CT | Strain gauges | |
| 32 AWG (7/40) teflon Alpha wires | AlphaWire, Elizabeth, NJ | 2840/7 | Sensor cables, different colors are available |
| 1/16" heat shrink tubing | Qualtek | B01A3QKKO6 | To seal the leads of the sensor cable |
| Weller WES51 Analog Soldering Station | Amazon | Lots of soldering, need a good soldering iron. https://www.amazon.com/Weller-WES51-Analog-Soldering-Station/dp/B000BRC2XU/ref=sr_1_23?s=hi&ie=UTF8&qid=1505654295 &sr=1-23&keywords=soldering+iron |
|
| Rosin Soldering Flux Paste | Amazon | Needed for soldering | |
| 60-40 Tin Lead Rosin Core Solder Wire | Amazon | Needed for soldering | |
| Aquarium sealant | Home Depot | Attach sensors to bivalve | |
| PC Laptop | Any old PC to run Campbell gape program | ||
| heat gun | Amazon | shrink shrink tubing | |
| Drill | Hardware store, Amazon | for twisting wires to make sensor cables | |
| AC to DC power module | Acopian | DB15-30 | Wheatstone bridge power supply |
| Poteniometer | Clarostat | 733A | Wheatsone bridge nulling |
| isolating BNC connector | Sterren Electronics | "200-148 | Wheatstone bridge output for multimeter |
| Fused AC receptical panel module | Adam technologies | IEC-GS-1-200 | Wheatstone bridge power supply connector |
| 976 ohm 1% resistor | Vishay Dale | CMF50976R00FHEB | Wheatstone bridge resistor |
| 1 kohm 1% resistor | Vishay Dale | CMF501K0000FHEB | Wheatstone bridge resistor |
| Potentiometer scale dial | Kilo International | 462 | 10 turn dial for nulling potentiometer |
| DB25 male panel connector | TE connectivity | 1757819-8 | Data logger connector on Wheatstone bridge |
| DB25 female panel connector | TE connectivity | 1757819-8 | Sensor connector to Wheatstone bridge |
| perforated circuit board | Vector electronics | 64P44WE | circuit board for mounting of bridge components |
| enclosure | Hammond Manufacturing | 1444-29 | Enclosure for sensor readout electronics |
Riferimenti
- Vaquer-Sunyer, R., Duarte, C. M. Thresholds of hypoxia for marine biodiversity. Proceedings of the National Academy of Sciences of the United States of America. 105 (40), 15452-15457 (2008).
- Diaz, R. J., Rosenberg, R. Spreading dead zones and consequences for marine ecosystems. Science. 321, 926-929 (2008).
- Levin, L. A., Breitburg, D. L. Linking coasts and seas to address ocean deoxygenation. Nature Climate Change. 5, 401-403 (2015).
- Diaz, R. J., Rosenberg, R. Marine benthic hypoxia: A review of its ecological effects and the behavioural responses of benthic macrofauna. Oceanography and Marine Biology: An annual Review. 33, 245-303 (1995).
- Patterson, H. K., Boettcher, A., Carmichael, R. H. Biomarkers of dissolved oxygen stress in oysters: a tool for restoration and management efforts. PLoS One. 9 (8), 104440 (2014).
- Altieri, A. H., Gedan, K. B. Climate change and dead zones. Global Change Biology. 21 (4), 1395-1406 (2015).
- Tyler, R. M., Brady, D. C., Targett, T. E. Temporal and spatial dynamics of diel-cycling hypoxia in estuarine tributaries. Estuaries and Coasts. 32 (1), 123-145 (2009).
- Breitburg, D. L., et al. Landscape-level variation in disease susceptibility related to shallow-water hypoxia. PLoS One. 10 (2), 0116223 (2015).
- Stickle, W. B., Kapper, M. A., Liu, L. -. L., Gnaiger, E., Wang, S. Y. Metabolic adaptations of several species of crustaceans and molluscs to hypoxia: toterance and microcalometric studies. Biological Bulletin. 177 (2), 303-312 (1989).
- Gamenick, I., Jahn, A., Vopel, K., Guiere, O. Hypoxia and sulphide as structuring factors in a macrozoobenthic community on the Baltic Sea shore: colonization studies and tolerance experiments. Marine Ecology Progress Series. , 73-85 (1996).
- Modig, H., Olafsson, E. Responses of Baltic benthic invertebrates to hypoxic events. Journal of Experimental Marine Biology and Ecology. 229 (1), 133-148 (1998).
- Riedel, B., Zuschin, M., Stachowitsch, M. Tolerance of benthic macrofauna to hypoxia and anoxia in shallow coastal seas: a realistic scenario. Marine Ecology Progress Series. 458, 39-52 (2012).
- Lombardi, S. A., Harlan, N. P., Paynter, K. T. Survival, acid-base balance, and gaping responses of the Asian Oyster C. ariakensis and the Eastern Oyster C. virginica during clamped emersion and hypoxic immersion. Journal of Shellfish Research. 32 (2), 409-415 (2013).
- Jansson, A., Norkko, J., Dupont, S., Norkko, A. Growth and survival in a changing environment: Combined effects of moderate hypoxia and low pH on juvenile bivalve Macoma balthica. Journal of Sea Research. 102, 41-47 (2015).
- Gooday, A. J., et al. Faunal responses to oxygen gradients on the Pakistan margin: A comparison of foraminiferans, macrofauna and megafauna. Deep Sea Research Part II: Topical Studies in Oceanography. 56 (6-7), 488-502 (2009).
- Montagna, P. A., Ritter, C. Direct and indirect effects of hypoxia on benthos in Corpus Christi Bay, Texas, U.S.A. Journal of Experimental Marine Biology and Ecology. 330 (1), 119-131 (2006).
- Villnas, A., Norkko, J., Lukkari, K., Hewitt, J., Norkko, A. Consequences of increasing hypoxic disturbance on benthic communities and ecosystem functioning. PLoS One. 7 (10), 44920 (2012).
- Breitburg, D. Effects of hypoxia, and the balance between hypoxia and enrichment on coastal fishes and fisheries. Estuaries. 25 (4), 767-781 (2002).
- Costantini, M., et al. Effect of hypoxia on habitat quality of striped bass (Morone saxatilis) in Chesapeake Bay. Canadian Journal of Fisheries and Aquatic Sciences. 65 (5), 989-1002 (2008).
- Ludsin, S. A., et al. Hypoxia-avoidance by planktivorous fish in Chesapeake Bay: Implications for food web interactions and fish recruitment. Journal of Experimental Marine Biology and Ecology. 381, 121-131 (2009).
- Zhang, H., et al. Hypoxia-driven changes in the behavior and spatial distribution of pelagic fish and mesozooplankton in the northern Gulf of Mexico. Journal of Experimental Marine Biology and Ecology. 381, 80-91 (2009).
- Sparks, B. L., Strayer, D. L. Effects of low dissolved oxygen on juvenile Elliptio complanata (Bivalvia:Unionidae). Journal of the Norther American Benthological Society. 17, 129-134 (1998).
- Llanso, R. J. Effects of hypoxia on estuarine benthos: the lower Rappahannock River (Chesapeake Bay), a case study. Estuarine, Coastal and Shelf Science. 35 (5), 491-515 (1992).
- Riedel, B., Zuschin, M., Haselmair, A., Stachowitsch, M. Oxygen depletion under glass: Behavioural responses of benthic macrofauna to induced anoxia in the Northern Adriatic. Journal of Experimental Marine Biology and Ecology. 367 (1), 17-27 (2008).
- Riedel, B., et al. Effect of hypoxia and anoxia on invertebrate behaviour: Ecological perspectives from species to community level. Biogeosciences. 11 (6), 1491-1518 (2014).
- Breitburg, D. L. Near-shore hypoxia in the Chesapeake Bay: Patterns and relationships among physical factors. Estuarine Coastal and Shelf Science. 30, 593-609 (1990).
- Baumann, H., Wallace, R. B., Tagliaferri, T., Gobler, C. J. Large natural pH, CO2 and O2 fluctuations in a temperate tidal salt marsh on diel, seasonal, and interannual time scales. Estuaries and Coasts. 38, 220-231 (2015).
- Breitburg, D. L., et al. Landscape-level variation in disease susceptibility related to shallow-water hypoxia. PLoS One. 10 (2), 0116223 (2015).
- de Zwart, D., Kramer, J. M., Jenner, H. A. Practical experiences with the biological early warning system “mosselmonitor”. Environmental Toxicology and Water Quality. 10 (4), 237-247 (1995).
- Kadar, E., et al. Avoidance responses to aluminum in the freshwater bivalve Anodonta cygnea. Aquatic Toxicology. 55, 137-148 (2001).
- Soliman, M. F. M., El-Shenawy, N. S., Tadros, M. M., Abd El-Azeez, A. A. Impaired behavior and changes in some biochemical markers of bivalve (Ruditapes decussatus) due to zinc toxicity. Toxicological & Environmental Chemistry. 97 (5), 674-686 (2015).
- Shumway, S. E., Cucci, T. L. The effects of the toxic dinoflagellate Protogonyaulax tamarensis on the feeding and behaviour of bivalve molluscs. Aquatic Toxicology. 10, 9-27 (1987).
- Basti, L., et al. Effects of the toxic dinoflagellate Heterocapsa circularisquama on the valve movement behaviour of the Manila clam Ruditapes philippinarum. Aquaculture. 291 (1-2), 41-47 (2009).
- Tran, D., Haberkorn, H., Soudant, P., Ciret, P., Massabuau, J. -. C. Behavioral responses of Crassostrea gigas exposed to the harmful algae Alexandrium minutum. Aquaculture. 298 (3-4), 338-345 (2010).
- Shumway, S. E., Koehn, R. K. Oxygen consumption in the American oyster Crassostrea virginica. Marine Ecology Progress Series. 9, 59-68 (1982).
- Nicastro, K. R., Zardi, G. I., McQuaid, C. D., Pearson, G. A., Serrao, E. A. Love thy neighbour: group properties of gaping behaviour in mussel aggregations. PLoS One. 7 (10), (2012).
- Dowd, W. W., Somero, G. N. Behavior and survival of Mytilus. congeners following episodes of elevated body temperature in air and seawater. Journal of Experimental Biology. 216 (3), 502-514 (2013).
- Higgins, P. J. Effects of food availability on the valve movements and feeding behavior of juvenile Crassostrea virginica (Gmelin). I. Valve movements and periodic activity. Journal of Experimental and Experimental Marine Biology and Ecology. 45, 229-244 (1980).
- Riisgård, H. U., Lassen, J., Kittner, C. Valve-gape response times in mussels (Mytilus edulis)-Effects of laboratory preceding-feeding conditions and in situ tidally induced variation in phytoplankton biomass. Journal of Shellfish Research. 25, 901-911 (2006).
- Robson, A. A., De Leaniz, C. G., Wilson, R. P., Halsey, L. G. Behavioural adaptations of mussels to varying levels of food availability and predation risk. Journal of Molluscan Studies. 76, 348-353 (2010).
- Robson, A. A., de Leaniz, C. G., Wilson, R. P., Halsey, L. G. Effect of anthropogenic feeding regimes on activity rhythms of laboratory mussels exposed to natural light. Hydrobiologia. 655, 197-204 (2010).
- Nicastro, K. R., Zardi, G. I., McQuaid, C. D., Stephens, L., Radloff, S., Blatch, G. L. The role of gaping behaviour in habitat partitioning between coexisting intertidal mussels. BMC Ecology. 10, 17 (2010).
- Loosanoff, V. S., Nomejko, C. A. Feeding of oysters in relation to tidal stages and to periods of light and darkness. Biological Bulletin. 90 (3), 244-264 (1946).
- Comeau, L. A., Mayrand, E., Mallet, A. Winter quiescence and spring awakening of the Eastern oyster Crassostrea virginica at its northernmost distribution limit. Marine Biology. 159 (10), 2269-2279 (2012).
- Pynonnen, K. S., Huebner, J. Effects of episodic low pH exposure on the valve movements of the freshwater bivalve Anodonta cygnea L. Water Research. 29 (11), 2579-2582 (1995).
- Jakubowska, M., Normant-Saremba, M. The effect of CO2-induced seawater acidification on the behaviour and metabolic rate of the baltic clam Macoma balthica. Annales Zoologici Fennici. 52 (5-6), 353-367 (2015).
- Jakubowska, M., Normant, M. Metabolic rate and activity of blue mussel Mytilus edulis trossulus.under short-term exposure to carbon dioxide-induced water acidification and oxygen deficiency. Marine and Freshwater Behaviour and Physiology. 48 (1), 25-39 (2015).
- Newell, C. R., Wildish, D. J., MacDonald, B. A. The effects of velocity and seston concentration on the exhalent siphon area, valve gape and filtration rate of the mussel Mytilus edulis. Journal of Experimental Marine Biology and Ecology. 262, 91-111 (2001).
- Maire, O., Amouroux, J. -. M., Duchene, J. -. C., Gremare, A. Relationship between filtration activity and food availability in the Mediterranean mussel Mytilus galloprovincialis. Marine Biology. 152 (6), 1293-1307 (2007).
- Borcherding, J. Ten years of practical experience with the Dreissena-monitor, a biological early warning system for continuous water quality monitoring. Hydrobiologia. 556 (1), 417-426 (2006).
- Frank, D. M., Hamilton, J. F., Ward, E. E., Shumway, S. E. A fiber optic sensor for high resolution measurement and continuous monitoring of valve gape in bivalve molluscs. Journal of Shellfish Research. 26 (2), 575-580 (2007).
- Wilson, R., Reuter, P., Wahl, M. Muscling in on mussels: New insights into bivalve behaviour using vertebrate remote-sensing technology. Marine Biology. 147 (5), 1165-1172 (2005).
- Nagai, K., Honjo, T., Go, J., Yamashita, H., Seok Jin, O. Detecting the shellfish killer Heterocapsa circularisquama (Dinophyceae) by measuring bivalve valve activity with a Hall element sensor. Aquaculture. 255 (1-4), 395-401 (2006).
- Robson, A., Wilson, R., de Leaniz, C. G. Mussels flexing their muscles: a new method for quantifying bivalve behaviour. Marine Biology. 151 (3), 1195-1204 (2007).
- Robson, A. A., Thomas, G. R., de Leaniz, C. G., Wilson, R. P. Valve gape and exhalant pumping in bivalves: optimization of measurement. Aquatic Biology. 6 (1-3), 191-200 (2009).
- de Zwart, D., Kramer, J. M., Jenner, H. A. Practical experiences with the biological early warning system “mosselmonitor”. Environmental Toxicology and Water Quality. 10 (4), 237-247 (1995).
- Jou, L. -. J., Lin, S. -. C., Chen, B. -. C., Chen, W. -. Y., Liao, C. -. M. Synthesis and measurement of valve activities by an improved online clam-based behavioral monitoring system. Computers and Electronics in Agriculture. 90, 106-118 (2013).
- Barile, N. B., Scopa, M., Recchi, S., Nerone, E. Biomonitoring of coastal marine waters subject to anthropogenic use: development and application of the biosensor Mosselmonitor. Ovidius University Annals of Chemistry. 27 (2), 81-86 (2016).
- Ballesta-Artero, I., Witbaard, R., Carroll, M. L., van der Meer, J. Environmental factors regulating gaping activity of the bivalve Arctica islandica in Northern Norway. Marine Biology. 164 (5), 116 (2017).
- Ekelof, S. The genesis of the Wheatstone bridge. Engineering Science and Education Journal. 10, 37-40 (2001).
- Keppel, A. G., Breitburg, D. L., Wikfors, G. H., Burrell, R. B., Clark, V. M. Effects of co-varying diel-cycling hypoxia and pH on disease susceptibility in the eastern oyster Crassostrea virginica. Marine Ecology Progress Series. 538, 169-183 (2015).
- Burrell, R. B., Keppel, A. G., Clark, V. M., Breitburg, D. L. An automated monitoring and control system for flow-through co-cycling hypoxia and pH experiments. Limnology and Oceanography: Methods. 14, 168-185 (2015).
- Porter, E. T., Breitburg, D. L. Eastern oyster Crassostrea virginica, valve gape behavior under diel-cycling hypoxia. Marine Biology. 163 (218), (2016).
- Bergeron, C. M. . The impact of sediment resuspension on mercury cycling and the bioaccumulation of methylmercury into benthic and pelagic organisms. , (2005).

