Un Monitor di Strain Gauge (SGM) per misurazioni continue di Gape valvola nei molluschi bivalvi in risposta all'ipossia laboratorio indotto Diel-ciclismo e pH
Summary
Comprendere le risposte comportamentali di bivalvi sospensione-alimentatori alle variabili ambientali, come l’ossigeno disciolto, può spiegare alcuni processi dell’ecosistema. Abbiamo sviluppato un monitor economico, basato sul laboratorio, strain-gauge (SGM) per misurare le risposte di gape valvola di ostriche, Crassostrea virginica, ipossia diel-ciclismo e pH ciclica.
Abstract
Un monitor di gape valvola poco costoso, basato sul laboratorio, strain-gauge (SGM) è stato sviluppato per monitorare il comportamento di gape valvola di molluschi bivalvi in risposta all’ipossia diel-escursioni in bicicletta. Un ponte di Wheatstone era collegato ad estensimetri che sono stati attaccati ai gusci di ostriche (Crassostrea virginica). I segnali registrati consentito per l’apertura e la chiusura dei bivalvi da registrare continuamente sopra due giorni periodi di ipossia di diel-ciclismo sperimentalmente indotta e diel-ciclismo variazioni di pH. Qui, descriviamo un protocollo per lo sviluppo di un monitor economico strain-gauge e descrivere, in un esperimento di laboratorio di esempio, come abbiamo usato per misurare il comportamento di gape valvola di orientale ostriche (c. virginica), in risposta all’ipossia diel-ciclismo e cicliche variazioni di pH. Gape valvola è stata misurata su ostriche sottoposte a ciclica severa ipossia (0,6 mg/L) dissolto condizioni di ossigeno con e senza cambiamenti ciclici in pH, condizioni cicliche mite hypoxic (1,7 mg/L) e condizioni di normossia (7,3 mg/L). Dimostriamo che quando ostriche incontrano diel ripetuti cicli, rapidamente chiudere loro gusci in risposta all’ipossia severa e chiudere con un ritardo lieve ipossia. Quando viene ripristinato il normoxia, hanno rapidamente aperto nuovamente. Le ostriche non hanno risposto alla condizioni di pH ciclica sovrapposte diel ciclismo ipossia severa. Alle condizioni di ridotta di ossigeno, più di un terzo delle ostriche chiusi contemporaneamente. Dimostriamo che ostriche rispondono all’ipossia diel-escursioni in bicicletta, che deve essere considerato quando valutare il comportamento di bivalvi di ossigeno disciolto. La valvola SGM può essere utilizzata per valutare le risposte dei molluschi bivalvi ai cambiamenti di ossigeno disciolto o contaminanti. Tecniche per migliore guarnizione di tenuta valvola gape estensimetri da acqua di mare hanno bisogno di ulteriore miglioramento per aumentare la longevità dei sensori.
Introduction
Ipossia, cioè, dissolto le concentrazioni ossigeno [] sufficientemente basso per influenzare negativamente biologico e processi ecologici ma spesso funzionalmente definita come [DO] < 2 mg / L1e anossia (funzionalmente definita come [DO] 0,0-0,2 mg/L) si verificano più frequentemente e gravemente in acque costiere del mondo, estuari e il profondo oceano2,3 e sono spesso aggravate dalla crescente eutrofizzazione4,5. Con un crescente estensione areale di ipossia e anossia, macrofauna sono influenzati negativamente e perdere la misura di habitat e qualità dell’habitat. Il cambiamento climatico è preveduto per peggiorare l’ipossia e anossia6.
In molti estuari stratificati, arricchita di sostanze nutritive come la Chesapeake Bay, Stati Uniti d’America, stagionalmente persistente ipossia può prevalere e può verificarsi anno dopo anno2. Inoltre, diel-ciclismo di ipossia è frequente negli estuari come la baia di Chesapeake e altri luoghi e si verifica tardi durante la notte o le prime ore del mattino in estate7,8.
Maggior parte degli studi si sono concentrati sull’effetto dell’esposizione continua di organismi a bassa [DO] e sulla loro tolleranza all’ipossia e anossia9,10,11,12,13,14 . Inoltre, gli studi hanno esaminato il cambiamento su larga scala nella composizione delle distribuzioni, abbondanze e specie specie in risposta a estesa [DO] basso4,15. Spesso specie che sono molto sensibili a bassa [], morire nelle masse,16 spostando le restanti specie di una fauna più giovane, più piccolo di dimensioni, di breve durata come, ad esempio, trovate sulla mensola Louisiana-Texas ecosistema4.
Cambiamenti comportamentali in genere precedono comunità crollo17 e gli studi hanno riferito sulle risposte comportamentali degli organismi a estesa basso [DO]4,16,17,18,19 ,20,21,22,23,24,25. Questi studi, tuttavia, non si concentrano sulle risposte degli organismi alle esposizioni diel-ciclismo di ipossia e la natura fluttuante di [DO] disponibilità negli estuari.
Diel-ciclismo ipossia negli estuari superficiali ha ricevuto crescente consapevolezza come studi monitorare [DO] più frequentemente nel corso dei giorni con sonde in estuari16,26. Acqua può rimanere ipossica per ore alla fine della notte o le prime ore del mattino in estate quando non c’è nessuna fotosintesi di generazione di ossigeno durante la notte, ma che consumano ossigeno alta respirazione aerobica7,16. Si è inoltre constatato che le maree influenzato il diel ciclismo condizioni basso con più estremi minimi osservati quando bassa marea ha coinciso con la fine della notte27. Solo dopo diverse ore di ipossia [DO] tornare a normoxia7,16,28 nel ciclo giornaliero.
Per determinare la risposta comportamentale di c. virginica diel-ciclismo ipossia e pH abbiamo monitorato l’apertura e la chiusura delle valvole di ostriche esposte al laboratorio indotto diel ciclica e ciclismo di [DO] pH. Gape risposte di bivalvi sono state utilizzate per rilevare condizioni ambientali avverse. Chiusure di valvola di molluschi bivalvi in risposta a contaminanti29,30,31, alghe tossiche32,33,34, l’inquinamento termico35,36 , 37,38,39,40, alimentazione regime39,41, emersione37,42, fotoperiodo43 diminuire la quantità di cibo , 44, pH45,46e combinato pH e ossigeno disciolto47 sono stati misurati. Gape tecniche hanno, ad esempio, incluso osservazioni dirette48,49,13, misurazioni continue utilizzando interruttori reed e magneti (Dreissena monitor)50o sensori in fibra ottica 51 che richiedono acqua limpida. Inoltre, sensori di Hall forza magneti e campi magnetici sono stati utilizzati per studiare la cozza gape angolo52,53,54,55e un sistema di induzione elettromagnetica ad alta frequenza che può misurare la distanza varia tra due bobine elettriche che sono incollati sulle valvole è stato utilizzato56,57,58,59. Una sorgente di alta tensione è necessaria per il sistema di induzione elettromagnetica e potenza deve essere consegnato ad entrambi i lati del guscio52. Questo sistema è anche disponibile nel commercio come il “MOSSELMONITOR” (http://mosselmonitor.nl/).
Un budget di ricerca stretto, abbiamo costruito un monitor economico strain-gauge (SGM) per misurare continuamente gape ostrica sopra indotta da laboratorio diel ciclismo di [DO] e pH, in condizioni di scarsa visibilità. Il nostro sistema è anche molto più semplice rispetto ai sistemi concorrenti, consentendo molti animali da instrumentare durante un esperimento. Abbiamo voluto determinare le risposte comportamentali di c. virginica diel ciclismo grave ([] = 0,6 mg/L) ipossia con pH di controllo (pH = 7.8) e ciclismo pH (pH = 7,8-7.0), rispettivamente e le risposte di gape al delicato ([] = 1,7 mg/L) ipossia. Inoltre, abbiamo voluto determinare se le ostriche sono in grado di rispondere rapidamente ai cambiamenti in [] sopra il diel ciclo e come reagire quando normoxia ritorna dopo un evento hypoxic. Forse le ostriche sono adattate all’ambiente rapidamente fluttuante che si trova in molti estuari16,27 dove vivono. Mentre più complessa valvola gape monitor sono disponibili, la SGM offre una tecnica poco costoso che consente misurazioni continue della valvola gape nelle acque anche in condizioni di scarsa visibilità.
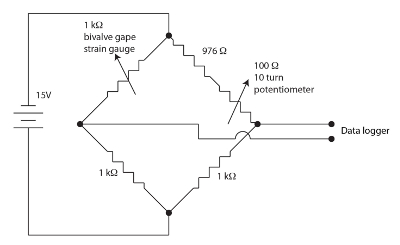
Figura 1. Ponte di Wheatstone per l’apparecchiatura di gape valvola. Clicca qui per visualizzare una versione più grande di questa figura.
I sensori dell’estensimetro utilizzati per il monitoraggio gape bivalvi sono film resistivo in un modello di meandro su un supporto di polyimide. Piccole quantità di sforzo modulano la resistenza del sensore. I bivalvi si flette l’estensimetro quando esso gapes causando un cambiamento nella resistenza del sensore. Abbiamo impiegato un ponte di Wheatstone Annulla, equilibrato, per ogni canale bivalvi come mostrato nella Figura 1 per misurare la variazione nella resistenza del sensore. Il ponte di Wheatstone è annullato dal potenziometro che permette un guadagno abbastanza alto essere impiegato dal datalogger. Un ponte di Wheatstone è un metodo standard per misurare con precisione una resistenza sconosciuta utilizzando un rapporto di un noto standard di resistenza e un voltmetro. La storia di questa antichissima tecnica è discussa in Ekelof (2001)60. Abbiamo integrato 12 canali, ognuno con il proprio ponte di Wheatstone e Annulla potenziometro, Strain Gauge Monitor (SGM).
Protocol
Representative Results
Discussion
Focus tipici studi su continuo, estesi periodi di condizioni di bassa dell’ossigeno e la risposta, spesso misurata come la sopravvivenza, degli animali. Tuttavia, allo stato attuale, la nostra comprensione delle risposte comportamentali degli animali all’ipossia diel-ciclismo è minimo63. Quindi, ulteriori studi dovrebbero concentrarsi sul comportamento degli organismi in risposta all’ipossia diel-escursioni in bicicletta, che si verifica regolarmente durante l’estate in molti estuari<sup class="x…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
Si ringrazia Melinda Forseth per scattare foto di ostriche e misurando la loro larghezza di gape in ImageJ. Ringraziamo Denise Breitburg per l’accesso per gli acquari con diel ciclismo ipossia e condizioni di pH ciclica. Si ringrazia il centro di ricerca ambientale Smithsonian, Edgewater, Maryland, per lo spazio per gli esperimenti. Gli esperimenti di ipossia sono stati finanziati da un National Oceanic and Atmospheric Administration – Center per sponsorizzato Coastal Ocean Research grant No. NA10NOS4780138 e il fondo di Hunterdon Smithsonian a Denise Breitburg. La valvola gape misurazioni durante l’ipossia esperimenti erano finanziati da una sovvenzione di potenziamento di facoltà di Washington College di Elka T. Porter.
Materials
| Campbell CR 10x data logger | Campbell Scientific, Logan, Utah | Or other data logger. At Campbell the CR 10X has been replaced with the CR 1000 | |
| Campbell CR 10x multiplexer | Campbell Scientific, Logan, Utah | Data logger needs to have space for 12 channels | |
| Dsub connector male crimp pins | TE Connectivity | 205089-1 | pins for gape sensor leads |
| PCA tape | Micro Measurements Corp, NC | To seal the strain gauge | |
| Duro Quick Gel | Ace Hardware | Superglue | |
| SG13/1000-LY43 or LY41 | Omega Engineering Inc., Stanford, CT | Strain gauges | |
| 32 AWG (7/40) teflon Alpha wires | AlphaWire, Elizabeth, NJ | 2840/7 | Sensor cables, different colors are available |
| 1/16" heat shrink tubing | Qualtek | B01A3QKKO6 | To seal the leads of the sensor cable |
| Weller WES51 Analog Soldering Station | Amazon | Lots of soldering, need a good soldering iron. https://www.amazon.com/Weller-WES51-Analog-Soldering-Station/dp/B000BRC2XU/ref=sr_1_23?s=hi&ie=UTF8&qid=1505654295 &sr=1-23&keywords=soldering+iron |
|
| Rosin Soldering Flux Paste | Amazon | Needed for soldering | |
| 60-40 Tin Lead Rosin Core Solder Wire | Amazon | Needed for soldering | |
| Aquarium sealant | Home Depot | Attach sensors to bivalve | |
| PC Laptop | Any old PC to run Campbell gape program | ||
| heat gun | Amazon | shrink shrink tubing | |
| Drill | Hardware store, Amazon | for twisting wires to make sensor cables | |
| AC to DC power module | Acopian | DB15-30 | Wheatstone bridge power supply |
| Poteniometer | Clarostat | 733A | Wheatsone bridge nulling |
| isolating BNC connector | Sterren Electronics | "200-148 | Wheatstone bridge output for multimeter |
| Fused AC receptical panel module | Adam technologies | IEC-GS-1-200 | Wheatstone bridge power supply connector |
| 976 ohm 1% resistor | Vishay Dale | CMF50976R00FHEB | Wheatstone bridge resistor |
| 1 kohm 1% resistor | Vishay Dale | CMF501K0000FHEB | Wheatstone bridge resistor |
| Potentiometer scale dial | Kilo International | 462 | 10 turn dial for nulling potentiometer |
| DB25 male panel connector | TE connectivity | 1757819-8 | Data logger connector on Wheatstone bridge |
| DB25 female panel connector | TE connectivity | 1757819-8 | Sensor connector to Wheatstone bridge |
| perforated circuit board | Vector electronics | 64P44WE | circuit board for mounting of bridge components |
| enclosure | Hammond Manufacturing | 1444-29 | Enclosure for sensor readout electronics |
Riferimenti
- Vaquer-Sunyer, R., Duarte, C. M. Thresholds of hypoxia for marine biodiversity. Proceedings of the National Academy of Sciences of the United States of America. 105 (40), 15452-15457 (2008).
- Diaz, R. J., Rosenberg, R. Spreading dead zones and consequences for marine ecosystems. Science. 321, 926-929 (2008).
- Levin, L. A., Breitburg, D. L. Linking coasts and seas to address ocean deoxygenation. Nature Climate Change. 5, 401-403 (2015).
- Diaz, R. J., Rosenberg, R. Marine benthic hypoxia: A review of its ecological effects and the behavioural responses of benthic macrofauna. Oceanography and Marine Biology: An annual Review. 33, 245-303 (1995).
- Patterson, H. K., Boettcher, A., Carmichael, R. H. Biomarkers of dissolved oxygen stress in oysters: a tool for restoration and management efforts. PLoS One. 9 (8), 104440 (2014).
- Altieri, A. H., Gedan, K. B. Climate change and dead zones. Global Change Biology. 21 (4), 1395-1406 (2015).
- Tyler, R. M., Brady, D. C., Targett, T. E. Temporal and spatial dynamics of diel-cycling hypoxia in estuarine tributaries. Estuaries and Coasts. 32 (1), 123-145 (2009).
- Breitburg, D. L., et al. Landscape-level variation in disease susceptibility related to shallow-water hypoxia. PLoS One. 10 (2), 0116223 (2015).
- Stickle, W. B., Kapper, M. A., Liu, L. -. L., Gnaiger, E., Wang, S. Y. Metabolic adaptations of several species of crustaceans and molluscs to hypoxia: toterance and microcalometric studies. Biological Bulletin. 177 (2), 303-312 (1989).
- Gamenick, I., Jahn, A., Vopel, K., Guiere, O. Hypoxia and sulphide as structuring factors in a macrozoobenthic community on the Baltic Sea shore: colonization studies and tolerance experiments. Marine Ecology Progress Series. , 73-85 (1996).
- Modig, H., Olafsson, E. Responses of Baltic benthic invertebrates to hypoxic events. Journal of Experimental Marine Biology and Ecology. 229 (1), 133-148 (1998).
- Riedel, B., Zuschin, M., Stachowitsch, M. Tolerance of benthic macrofauna to hypoxia and anoxia in shallow coastal seas: a realistic scenario. Marine Ecology Progress Series. 458, 39-52 (2012).
- Lombardi, S. A., Harlan, N. P., Paynter, K. T. Survival, acid-base balance, and gaping responses of the Asian Oyster C. ariakensis and the Eastern Oyster C. virginica during clamped emersion and hypoxic immersion. Journal of Shellfish Research. 32 (2), 409-415 (2013).
- Jansson, A., Norkko, J., Dupont, S., Norkko, A. Growth and survival in a changing environment: Combined effects of moderate hypoxia and low pH on juvenile bivalve Macoma balthica. Journal of Sea Research. 102, 41-47 (2015).
- Gooday, A. J., et al. Faunal responses to oxygen gradients on the Pakistan margin: A comparison of foraminiferans, macrofauna and megafauna. Deep Sea Research Part II: Topical Studies in Oceanography. 56 (6-7), 488-502 (2009).
- Montagna, P. A., Ritter, C. Direct and indirect effects of hypoxia on benthos in Corpus Christi Bay, Texas, U.S.A. Journal of Experimental Marine Biology and Ecology. 330 (1), 119-131 (2006).
- Villnas, A., Norkko, J., Lukkari, K., Hewitt, J., Norkko, A. Consequences of increasing hypoxic disturbance on benthic communities and ecosystem functioning. PLoS One. 7 (10), 44920 (2012).
- Breitburg, D. Effects of hypoxia, and the balance between hypoxia and enrichment on coastal fishes and fisheries. Estuaries. 25 (4), 767-781 (2002).
- Costantini, M., et al. Effect of hypoxia on habitat quality of striped bass (Morone saxatilis) in Chesapeake Bay. Canadian Journal of Fisheries and Aquatic Sciences. 65 (5), 989-1002 (2008).
- Ludsin, S. A., et al. Hypoxia-avoidance by planktivorous fish in Chesapeake Bay: Implications for food web interactions and fish recruitment. Journal of Experimental Marine Biology and Ecology. 381, 121-131 (2009).
- Zhang, H., et al. Hypoxia-driven changes in the behavior and spatial distribution of pelagic fish and mesozooplankton in the northern Gulf of Mexico. Journal of Experimental Marine Biology and Ecology. 381, 80-91 (2009).
- Sparks, B. L., Strayer, D. L. Effects of low dissolved oxygen on juvenile Elliptio complanata (Bivalvia:Unionidae). Journal of the Norther American Benthological Society. 17, 129-134 (1998).
- Llanso, R. J. Effects of hypoxia on estuarine benthos: the lower Rappahannock River (Chesapeake Bay), a case study. Estuarine, Coastal and Shelf Science. 35 (5), 491-515 (1992).
- Riedel, B., Zuschin, M., Haselmair, A., Stachowitsch, M. Oxygen depletion under glass: Behavioural responses of benthic macrofauna to induced anoxia in the Northern Adriatic. Journal of Experimental Marine Biology and Ecology. 367 (1), 17-27 (2008).
- Riedel, B., et al. Effect of hypoxia and anoxia on invertebrate behaviour: Ecological perspectives from species to community level. Biogeosciences. 11 (6), 1491-1518 (2014).
- Breitburg, D. L. Near-shore hypoxia in the Chesapeake Bay: Patterns and relationships among physical factors. Estuarine Coastal and Shelf Science. 30, 593-609 (1990).
- Baumann, H., Wallace, R. B., Tagliaferri, T., Gobler, C. J. Large natural pH, CO2 and O2 fluctuations in a temperate tidal salt marsh on diel, seasonal, and interannual time scales. Estuaries and Coasts. 38, 220-231 (2015).
- Breitburg, D. L., et al. Landscape-level variation in disease susceptibility related to shallow-water hypoxia. PLoS One. 10 (2), 0116223 (2015).
- de Zwart, D., Kramer, J. M., Jenner, H. A. Practical experiences with the biological early warning system “mosselmonitor”. Environmental Toxicology and Water Quality. 10 (4), 237-247 (1995).
- Kadar, E., et al. Avoidance responses to aluminum in the freshwater bivalve Anodonta cygnea. Aquatic Toxicology. 55, 137-148 (2001).
- Soliman, M. F. M., El-Shenawy, N. S., Tadros, M. M., Abd El-Azeez, A. A. Impaired behavior and changes in some biochemical markers of bivalve (Ruditapes decussatus) due to zinc toxicity. Toxicological & Environmental Chemistry. 97 (5), 674-686 (2015).
- Shumway, S. E., Cucci, T. L. The effects of the toxic dinoflagellate Protogonyaulax tamarensis on the feeding and behaviour of bivalve molluscs. Aquatic Toxicology. 10, 9-27 (1987).
- Basti, L., et al. Effects of the toxic dinoflagellate Heterocapsa circularisquama on the valve movement behaviour of the Manila clam Ruditapes philippinarum. Aquaculture. 291 (1-2), 41-47 (2009).
- Tran, D., Haberkorn, H., Soudant, P., Ciret, P., Massabuau, J. -. C. Behavioral responses of Crassostrea gigas exposed to the harmful algae Alexandrium minutum. Aquaculture. 298 (3-4), 338-345 (2010).
- Shumway, S. E., Koehn, R. K. Oxygen consumption in the American oyster Crassostrea virginica. Marine Ecology Progress Series. 9, 59-68 (1982).
- Nicastro, K. R., Zardi, G. I., McQuaid, C. D., Pearson, G. A., Serrao, E. A. Love thy neighbour: group properties of gaping behaviour in mussel aggregations. PLoS One. 7 (10), (2012).
- Dowd, W. W., Somero, G. N. Behavior and survival of Mytilus. congeners following episodes of elevated body temperature in air and seawater. Journal of Experimental Biology. 216 (3), 502-514 (2013).
- Higgins, P. J. Effects of food availability on the valve movements and feeding behavior of juvenile Crassostrea virginica (Gmelin). I. Valve movements and periodic activity. Journal of Experimental and Experimental Marine Biology and Ecology. 45, 229-244 (1980).
- Riisgård, H. U., Lassen, J., Kittner, C. Valve-gape response times in mussels (Mytilus edulis)-Effects of laboratory preceding-feeding conditions and in situ tidally induced variation in phytoplankton biomass. Journal of Shellfish Research. 25, 901-911 (2006).
- Robson, A. A., De Leaniz, C. G., Wilson, R. P., Halsey, L. G. Behavioural adaptations of mussels to varying levels of food availability and predation risk. Journal of Molluscan Studies. 76, 348-353 (2010).
- Robson, A. A., de Leaniz, C. G., Wilson, R. P., Halsey, L. G. Effect of anthropogenic feeding regimes on activity rhythms of laboratory mussels exposed to natural light. Hydrobiologia. 655, 197-204 (2010).
- Nicastro, K. R., Zardi, G. I., McQuaid, C. D., Stephens, L., Radloff, S., Blatch, G. L. The role of gaping behaviour in habitat partitioning between coexisting intertidal mussels. BMC Ecology. 10, 17 (2010).
- Loosanoff, V. S., Nomejko, C. A. Feeding of oysters in relation to tidal stages and to periods of light and darkness. Biological Bulletin. 90 (3), 244-264 (1946).
- Comeau, L. A., Mayrand, E., Mallet, A. Winter quiescence and spring awakening of the Eastern oyster Crassostrea virginica at its northernmost distribution limit. Marine Biology. 159 (10), 2269-2279 (2012).
- Pynonnen, K. S., Huebner, J. Effects of episodic low pH exposure on the valve movements of the freshwater bivalve Anodonta cygnea L. Water Research. 29 (11), 2579-2582 (1995).
- Jakubowska, M., Normant-Saremba, M. The effect of CO2-induced seawater acidification on the behaviour and metabolic rate of the baltic clam Macoma balthica. Annales Zoologici Fennici. 52 (5-6), 353-367 (2015).
- Jakubowska, M., Normant, M. Metabolic rate and activity of blue mussel Mytilus edulis trossulus.under short-term exposure to carbon dioxide-induced water acidification and oxygen deficiency. Marine and Freshwater Behaviour and Physiology. 48 (1), 25-39 (2015).
- Newell, C. R., Wildish, D. J., MacDonald, B. A. The effects of velocity and seston concentration on the exhalent siphon area, valve gape and filtration rate of the mussel Mytilus edulis. Journal of Experimental Marine Biology and Ecology. 262, 91-111 (2001).
- Maire, O., Amouroux, J. -. M., Duchene, J. -. C., Gremare, A. Relationship between filtration activity and food availability in the Mediterranean mussel Mytilus galloprovincialis. Marine Biology. 152 (6), 1293-1307 (2007).
- Borcherding, J. Ten years of practical experience with the Dreissena-monitor, a biological early warning system for continuous water quality monitoring. Hydrobiologia. 556 (1), 417-426 (2006).
- Frank, D. M., Hamilton, J. F., Ward, E. E., Shumway, S. E. A fiber optic sensor for high resolution measurement and continuous monitoring of valve gape in bivalve molluscs. Journal of Shellfish Research. 26 (2), 575-580 (2007).
- Wilson, R., Reuter, P., Wahl, M. Muscling in on mussels: New insights into bivalve behaviour using vertebrate remote-sensing technology. Marine Biology. 147 (5), 1165-1172 (2005).
- Nagai, K., Honjo, T., Go, J., Yamashita, H., Seok Jin, O. Detecting the shellfish killer Heterocapsa circularisquama (Dinophyceae) by measuring bivalve valve activity with a Hall element sensor. Aquaculture. 255 (1-4), 395-401 (2006).
- Robson, A., Wilson, R., de Leaniz, C. G. Mussels flexing their muscles: a new method for quantifying bivalve behaviour. Marine Biology. 151 (3), 1195-1204 (2007).
- Robson, A. A., Thomas, G. R., de Leaniz, C. G., Wilson, R. P. Valve gape and exhalant pumping in bivalves: optimization of measurement. Aquatic Biology. 6 (1-3), 191-200 (2009).
- de Zwart, D., Kramer, J. M., Jenner, H. A. Practical experiences with the biological early warning system “mosselmonitor”. Environmental Toxicology and Water Quality. 10 (4), 237-247 (1995).
- Jou, L. -. J., Lin, S. -. C., Chen, B. -. C., Chen, W. -. Y., Liao, C. -. M. Synthesis and measurement of valve activities by an improved online clam-based behavioral monitoring system. Computers and Electronics in Agriculture. 90, 106-118 (2013).
- Barile, N. B., Scopa, M., Recchi, S., Nerone, E. Biomonitoring of coastal marine waters subject to anthropogenic use: development and application of the biosensor Mosselmonitor. Ovidius University Annals of Chemistry. 27 (2), 81-86 (2016).
- Ballesta-Artero, I., Witbaard, R., Carroll, M. L., van der Meer, J. Environmental factors regulating gaping activity of the bivalve Arctica islandica in Northern Norway. Marine Biology. 164 (5), 116 (2017).
- Ekelof, S. The genesis of the Wheatstone bridge. Engineering Science and Education Journal. 10, 37-40 (2001).
- Keppel, A. G., Breitburg, D. L., Wikfors, G. H., Burrell, R. B., Clark, V. M. Effects of co-varying diel-cycling hypoxia and pH on disease susceptibility in the eastern oyster Crassostrea virginica. Marine Ecology Progress Series. 538, 169-183 (2015).
- Burrell, R. B., Keppel, A. G., Clark, V. M., Breitburg, D. L. An automated monitoring and control system for flow-through co-cycling hypoxia and pH experiments. Limnology and Oceanography: Methods. 14, 168-185 (2015).
- Porter, E. T., Breitburg, D. L. Eastern oyster Crassostrea virginica, valve gape behavior under diel-cycling hypoxia. Marine Biology. 163 (218), (2016).
- Bergeron, C. M. . The impact of sediment resuspension on mercury cycling and the bioaccumulation of methylmercury into benthic and pelagic organisms. , (2005).

