ひずみゲージ モニター (SGM) 研究室による日周サイクリング酸素分圧および pH 応答の二枚貝軟体動物の連続弁 Gape 測定
Summary
二枚貝の懸濁液の送り装置の溶存酸素などの環境変数への行動応答を理解することはいくつかの生態系のプロセスを説明できます。安価な実験室ベースのひずみゲージ モニター (SGM) カキ、マガキ virginicaバルブ、ぼうぜんとしている応答を測定する日周サイクリング低酸素と循環 pH を開発しました。
Abstract
安価な実験室ベースのひずみゲージ弁 gape モニター (SGM) は、日周サイクリング低酸素に対する反応で二枚貝のバルブ口を大きく開ける動作を監視するため開発されました。ホイートストン ブリッジは、牡蠣 (マガキ virginica) のシェルに接続されているひずみゲージに接続されました。記録された信号許可を継続的に記録する二枚貝の開閉実験による日周サイクリングの低酸素と pH の変化を日周サイクリング 2 日間の期間。ここで、我々 は安価なひずみゲージ モニターを開発するためのプロトコルを記述する例の実験に記述して、東が日周サイクリング低酸素に対する反応で (C. virginica) を牡蠣のバルブ口を大きく開ける動作を測定するために使用私たちどのようにとpH の周期的変化。バルブ、ぼうぜんとしている循環的な重篤な低酸素 (0.6 mg/L) を受けるにカキに測定した溶存酸素条件と pH、循環的な軽度低酸素 (1.7 mg/L) 条件と平地 (7.3 mg/L) 条件の周期的な変化なし。示すカキには、繰り返される日周サイクルが発生した、彼ら急速に重度の低酸素に対する反応で自分の殻を閉じて軽度低酸素のタイムラグを閉じます。常が回復すると、彼らは急速に再度開きます。カキは、重度の低酸素症をサイクリング日周の上に重ね循環 pH 条件に応答しませんでした。低酸素条件下でカキの 3 分の 1 以上を同時に閉じる。カキ対応日周サイクリング低酸素症、酸素溶解する二枚貝の挙動を評価するとき考慮しなければならないことを示します。バルブ SGM は、溶存酸素や汚染物質の変化に二枚貝の応答を評価するために使用できます。技術より良いシールをシール海の水からバルブ gape ひずみゲージはセンサーの寿命を増加するそれ以上の改善を必要があります。
Introduction
低酸素症、すなわち、溶存酸素濃度 [] 十分に低を行う生物に悪影響を生態学的プロセスが、しばしば機能的に定義されたとして [行う] < 2 mg/L の1、および無酸素症の (機能的 [DO] として定義されている 0.0 0.2 mg/L)世界の沿岸水域、河口および海洋深層2,3でより頻繁に、深刻なを発生しているし、しばしば富栄養化4、5の増加によって悪化させます。低酸素血症と低酸素の増加面積程度、大型動物が悪影響を受けるし、生息地の範囲や生息場所の質を失います。気候変動は、低酸素、無酸素6を悪化させると予測されます。
チェサピーク湾、アメリカなど多くの成層、栄養強化河口で季節持続的な低酸素症勝つことができるし、2年後に起こります。さらに、低酸素の日周サイクリングはチェサピーク湾そして他の場所などの河口に頻繁に、夜や早朝時間の夏7,8の後期に起こる。
ほとんどの研究は、[は] を低に生物の連続的な露出の効果と低酸素と無酸素9,10、11,12,13,14 への耐性に焦点を当てています。.また、研究は、拡張低 [は]4,15に応えて種分布、組成、および種組成の大規模な変化を見てきました。しばしば種低固まりで死ぬ [行う] に非常に敏感な16ルイジアナ州、テキサス州棚生態系4として、たとえば、若い、小さいサイズ、短命の相に残りの種をシフトします。
行動の変化は通常コミュニティ崩壊17を前し、拡張低 [は]4,16,17,18,19 への生物の行動応答が報告されて ,,2021,22,23,24,25。しかし、これらの研究は、低酸素症の日周サイクリング エクスポー ジャーと河口では可用性の変動の性質への生物の応答にフォーカスしていません。
浅い河口域で日周サイクリング低酸素を受けている意識の高まり研究モニター詳細を行う頻繁ゾンデ河口16,26日間にわたって。水は夜の終わりに時間や夏の早朝時間に低酸素に残ることができる夜が高酸素消費の中に酸素を生成する光合成が無い場合好気呼吸7,16。また、日周が潮の干満に影響を受けることがわかりました低潮が夜27の終わりと重なったとき観測された最も極端な極小の低か条件のサイクリングします。[か] 低酸素症のいくつかの時間後にのみ毎日のサイクルに常7,16,28に帰ってくる。
日周サイクリング酸素分圧および pH 我々 は研究室にさらされるカキのバルブの開閉監視c. virginicaの行動応答を判断する誘導日周 [は] のサイクリングと循環 pH。二枚貝の gape 応答は、不利な環境条件を検出するために使用されています。汚染物質29,30,31, 有毒藻類32,33,34, 熱汚染35,36の応答における二枚貝類の弁閉鎖,37食べ物の量を減らす38,39,40, 供給体制39,41, エマーション37,42, 日長43,44、pH45,46, と結合された pH と溶存酸素47を測定しました。口を大きく開ける技術にはなどが含まれている直接観察48,49,13, リード スイッチと磁石 (Dreissena モニター)50、または光ファイバーセンサーを用いた連続測定には51澄んだ水を必要とします。さらに、磁石と磁場強度のホール センサーは、ムール貝、ぼうぜんとしている角度52,53,54,55, 高周波電磁誘導システムの検討に使用されています。ことができます測定バルブに接着されて 2 つの電気コイル間距離を変化させるされていること56,57,58,59を使用します。高電圧源は電磁誘導システムに必要な電源シェル52の両側に配信されます。このシステムは「MOSSELMONITOR」(http://mosselmonitor.nl/) として市販も。
研究室による日周以上安価なひずみゲージ モニター (SGM) オイスター gape を連続測定するタイトな研究予算で構築した [は] のサイクリング、pH、低い可視性の条件の下で。我々 のシステムも多くの動物実験中に計測する、競合するシステムよりもはるかに簡単です。日周深刻なサイクリングにC. virginicaの行動対応を決定したい ([行う] = 0.6 mg/L) pH コントロールと低酸素症 (pH = 7.8) とサイクリングの pH (pH = 7.8 7.0) をそれぞれと gape に対する軽度 ([行う] = 1.7 mg/L) 低酸素。また、カキあるサイクル、日周上 [か] と低酸素イベント後常が返されるときの対処方法の変化に迅速に対応することができるかどうかと考えました。おそらくカキは、彼らが住んでいる最適多く河口16,27は、「急速に変動の環境に適応されます。複雑なバルブ、ぼうぜんとしているモニターが利用可能な SGM は低視程条件でも水のバルブ gape の連続測定を可能にする安価な方法を提供しています。
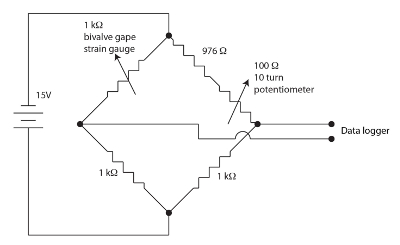
図 1。バルブ gape 用ホイートストン ブリッジします。この図の拡大版を表示するのにはここをクリックしてください。
二枚貝 gape の監視用ひずみゲージ センサーは、バックアップ ポリイミド蛇行パターンで抵抗膜です。歪み量が少ないセンサーの抵抗を調節します。二枚貝は、それはセンサーの抵抗の変化をもたらす口をあけるときにひずみゲージを折り曲げ。センサーの抵抗の変化を測定する図 1に示すように、二枚貝のチャネルごとにヌル、バランスの取れた、ホイートス トーン ブリッジを採用しました。ホイートス トーン ブリッジはかなりハイゲイン データロガーに雇用されることを許可するポテンショメータによって null します。ホイートストン ブリッジは、標準的な既知抵抗と電圧計に比を用いた未知抵抗の正確な測定のための標準的な方法です。この非常に古い技術の歴史は、Ekelof (2001 年)60で論議されます。ひずみゲージ モニター (SGM) ユニットに 12 チャンネル、それぞれ独自のホイートストン ブリッジとヌルのポテンショメータを統合されています。
Protocol
Representative Results
Discussion
典型的な研究焦点、連続拡張低酸素条件の期間と応答は、しばしば動物の生存として測定します。ただし、現時点では、日周サイクリング低酸素に対する動物の行動応答の私達の理解は、最小限63です。したがってより多くの研究は多く河口7,8で夏に定期的に発生する日周サイクリングの低酸素に対する反応で有機体の行動に焦点…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
牡蠣の写真を撮る、ImageJ でぼうぜんとしている幅を測定、メリンダ ・ Forseth に感謝します。サイクリング低酸素と循環 pH 条件日周と、水槽へのアクセス、デニス Breitburg に感謝しますエッジウォーター, メリーランド州, スミソニアン環境研究センターは、実験スペースを感謝いたします。低酸素症実験された no.、国立海洋大気圏局 – 沿岸海洋研究のスポンサー助成センターによって資金を供給NA10NOS4780138 し、スミソニアン Hunterdon 基金デニス Breitburg します。バルブは、実験 Elka t. ポーターにワシントン大学によって学部強化助成金によって資金が供給された低酸素吸入時の測定をぼうぜんと。
Materials
| Campbell CR 10x data logger | Campbell Scientific, Logan, Utah | Or other data logger. At Campbell the CR 10X has been replaced with the CR 1000 | |
| Campbell CR 10x multiplexer | Campbell Scientific, Logan, Utah | Data logger needs to have space for 12 channels | |
| Dsub connector male crimp pins | TE Connectivity | 205089-1 | pins for gape sensor leads |
| PCA tape | Micro Measurements Corp, NC | To seal the strain gauge | |
| Duro Quick Gel | Ace Hardware | Superglue | |
| SG13/1000-LY43 or LY41 | Omega Engineering Inc., Stanford, CT | Strain gauges | |
| 32 AWG (7/40) teflon Alpha wires | AlphaWire, Elizabeth, NJ | 2840/7 | Sensor cables, different colors are available |
| 1/16" heat shrink tubing | Qualtek | B01A3QKKO6 | To seal the leads of the sensor cable |
| Weller WES51 Analog Soldering Station | Amazon | Lots of soldering, need a good soldering iron. https://www.amazon.com/Weller-WES51-Analog-Soldering-Station/dp/B000BRC2XU/ref=sr_1_23?s=hi&ie=UTF8&qid=1505654295 &sr=1-23&keywords=soldering+iron |
|
| Rosin Soldering Flux Paste | Amazon | Needed for soldering | |
| 60-40 Tin Lead Rosin Core Solder Wire | Amazon | Needed for soldering | |
| Aquarium sealant | Home Depot | Attach sensors to bivalve | |
| PC Laptop | Any old PC to run Campbell gape program | ||
| heat gun | Amazon | shrink shrink tubing | |
| Drill | Hardware store, Amazon | for twisting wires to make sensor cables | |
| AC to DC power module | Acopian | DB15-30 | Wheatstone bridge power supply |
| Poteniometer | Clarostat | 733A | Wheatsone bridge nulling |
| isolating BNC connector | Sterren Electronics | "200-148 | Wheatstone bridge output for multimeter |
| Fused AC receptical panel module | Adam technologies | IEC-GS-1-200 | Wheatstone bridge power supply connector |
| 976 ohm 1% resistor | Vishay Dale | CMF50976R00FHEB | Wheatstone bridge resistor |
| 1 kohm 1% resistor | Vishay Dale | CMF501K0000FHEB | Wheatstone bridge resistor |
| Potentiometer scale dial | Kilo International | 462 | 10 turn dial for nulling potentiometer |
| DB25 male panel connector | TE connectivity | 1757819-8 | Data logger connector on Wheatstone bridge |
| DB25 female panel connector | TE connectivity | 1757819-8 | Sensor connector to Wheatstone bridge |
| perforated circuit board | Vector electronics | 64P44WE | circuit board for mounting of bridge components |
| enclosure | Hammond Manufacturing | 1444-29 | Enclosure for sensor readout electronics |
Riferimenti
- Vaquer-Sunyer, R., Duarte, C. M. Thresholds of hypoxia for marine biodiversity. Proceedings of the National Academy of Sciences of the United States of America. 105 (40), 15452-15457 (2008).
- Diaz, R. J., Rosenberg, R. Spreading dead zones and consequences for marine ecosystems. Science. 321, 926-929 (2008).
- Levin, L. A., Breitburg, D. L. Linking coasts and seas to address ocean deoxygenation. Nature Climate Change. 5, 401-403 (2015).
- Diaz, R. J., Rosenberg, R. Marine benthic hypoxia: A review of its ecological effects and the behavioural responses of benthic macrofauna. Oceanography and Marine Biology: An annual Review. 33, 245-303 (1995).
- Patterson, H. K., Boettcher, A., Carmichael, R. H. Biomarkers of dissolved oxygen stress in oysters: a tool for restoration and management efforts. PLoS One. 9 (8), 104440 (2014).
- Altieri, A. H., Gedan, K. B. Climate change and dead zones. Global Change Biology. 21 (4), 1395-1406 (2015).
- Tyler, R. M., Brady, D. C., Targett, T. E. Temporal and spatial dynamics of diel-cycling hypoxia in estuarine tributaries. Estuaries and Coasts. 32 (1), 123-145 (2009).
- Breitburg, D. L., et al. Landscape-level variation in disease susceptibility related to shallow-water hypoxia. PLoS One. 10 (2), 0116223 (2015).
- Stickle, W. B., Kapper, M. A., Liu, L. -. L., Gnaiger, E., Wang, S. Y. Metabolic adaptations of several species of crustaceans and molluscs to hypoxia: toterance and microcalometric studies. Biological Bulletin. 177 (2), 303-312 (1989).
- Gamenick, I., Jahn, A., Vopel, K., Guiere, O. Hypoxia and sulphide as structuring factors in a macrozoobenthic community on the Baltic Sea shore: colonization studies and tolerance experiments. Marine Ecology Progress Series. , 73-85 (1996).
- Modig, H., Olafsson, E. Responses of Baltic benthic invertebrates to hypoxic events. Journal of Experimental Marine Biology and Ecology. 229 (1), 133-148 (1998).
- Riedel, B., Zuschin, M., Stachowitsch, M. Tolerance of benthic macrofauna to hypoxia and anoxia in shallow coastal seas: a realistic scenario. Marine Ecology Progress Series. 458, 39-52 (2012).
- Lombardi, S. A., Harlan, N. P., Paynter, K. T. Survival, acid-base balance, and gaping responses of the Asian Oyster C. ariakensis and the Eastern Oyster C. virginica during clamped emersion and hypoxic immersion. Journal of Shellfish Research. 32 (2), 409-415 (2013).
- Jansson, A., Norkko, J., Dupont, S., Norkko, A. Growth and survival in a changing environment: Combined effects of moderate hypoxia and low pH on juvenile bivalve Macoma balthica. Journal of Sea Research. 102, 41-47 (2015).
- Gooday, A. J., et al. Faunal responses to oxygen gradients on the Pakistan margin: A comparison of foraminiferans, macrofauna and megafauna. Deep Sea Research Part II: Topical Studies in Oceanography. 56 (6-7), 488-502 (2009).
- Montagna, P. A., Ritter, C. Direct and indirect effects of hypoxia on benthos in Corpus Christi Bay, Texas, U.S.A. Journal of Experimental Marine Biology and Ecology. 330 (1), 119-131 (2006).
- Villnas, A., Norkko, J., Lukkari, K., Hewitt, J., Norkko, A. Consequences of increasing hypoxic disturbance on benthic communities and ecosystem functioning. PLoS One. 7 (10), 44920 (2012).
- Breitburg, D. Effects of hypoxia, and the balance between hypoxia and enrichment on coastal fishes and fisheries. Estuaries. 25 (4), 767-781 (2002).
- Costantini, M., et al. Effect of hypoxia on habitat quality of striped bass (Morone saxatilis) in Chesapeake Bay. Canadian Journal of Fisheries and Aquatic Sciences. 65 (5), 989-1002 (2008).
- Ludsin, S. A., et al. Hypoxia-avoidance by planktivorous fish in Chesapeake Bay: Implications for food web interactions and fish recruitment. Journal of Experimental Marine Biology and Ecology. 381, 121-131 (2009).
- Zhang, H., et al. Hypoxia-driven changes in the behavior and spatial distribution of pelagic fish and mesozooplankton in the northern Gulf of Mexico. Journal of Experimental Marine Biology and Ecology. 381, 80-91 (2009).
- Sparks, B. L., Strayer, D. L. Effects of low dissolved oxygen on juvenile Elliptio complanata (Bivalvia:Unionidae). Journal of the Norther American Benthological Society. 17, 129-134 (1998).
- Llanso, R. J. Effects of hypoxia on estuarine benthos: the lower Rappahannock River (Chesapeake Bay), a case study. Estuarine, Coastal and Shelf Science. 35 (5), 491-515 (1992).
- Riedel, B., Zuschin, M., Haselmair, A., Stachowitsch, M. Oxygen depletion under glass: Behavioural responses of benthic macrofauna to induced anoxia in the Northern Adriatic. Journal of Experimental Marine Biology and Ecology. 367 (1), 17-27 (2008).
- Riedel, B., et al. Effect of hypoxia and anoxia on invertebrate behaviour: Ecological perspectives from species to community level. Biogeosciences. 11 (6), 1491-1518 (2014).
- Breitburg, D. L. Near-shore hypoxia in the Chesapeake Bay: Patterns and relationships among physical factors. Estuarine Coastal and Shelf Science. 30, 593-609 (1990).
- Baumann, H., Wallace, R. B., Tagliaferri, T., Gobler, C. J. Large natural pH, CO2 and O2 fluctuations in a temperate tidal salt marsh on diel, seasonal, and interannual time scales. Estuaries and Coasts. 38, 220-231 (2015).
- Breitburg, D. L., et al. Landscape-level variation in disease susceptibility related to shallow-water hypoxia. PLoS One. 10 (2), 0116223 (2015).
- de Zwart, D., Kramer, J. M., Jenner, H. A. Practical experiences with the biological early warning system “mosselmonitor”. Environmental Toxicology and Water Quality. 10 (4), 237-247 (1995).
- Kadar, E., et al. Avoidance responses to aluminum in the freshwater bivalve Anodonta cygnea. Aquatic Toxicology. 55, 137-148 (2001).
- Soliman, M. F. M., El-Shenawy, N. S., Tadros, M. M., Abd El-Azeez, A. A. Impaired behavior and changes in some biochemical markers of bivalve (Ruditapes decussatus) due to zinc toxicity. Toxicological & Environmental Chemistry. 97 (5), 674-686 (2015).
- Shumway, S. E., Cucci, T. L. The effects of the toxic dinoflagellate Protogonyaulax tamarensis on the feeding and behaviour of bivalve molluscs. Aquatic Toxicology. 10, 9-27 (1987).
- Basti, L., et al. Effects of the toxic dinoflagellate Heterocapsa circularisquama on the valve movement behaviour of the Manila clam Ruditapes philippinarum. Aquaculture. 291 (1-2), 41-47 (2009).
- Tran, D., Haberkorn, H., Soudant, P., Ciret, P., Massabuau, J. -. C. Behavioral responses of Crassostrea gigas exposed to the harmful algae Alexandrium minutum. Aquaculture. 298 (3-4), 338-345 (2010).
- Shumway, S. E., Koehn, R. K. Oxygen consumption in the American oyster Crassostrea virginica. Marine Ecology Progress Series. 9, 59-68 (1982).
- Nicastro, K. R., Zardi, G. I., McQuaid, C. D., Pearson, G. A., Serrao, E. A. Love thy neighbour: group properties of gaping behaviour in mussel aggregations. PLoS One. 7 (10), (2012).
- Dowd, W. W., Somero, G. N. Behavior and survival of Mytilus. congeners following episodes of elevated body temperature in air and seawater. Journal of Experimental Biology. 216 (3), 502-514 (2013).
- Higgins, P. J. Effects of food availability on the valve movements and feeding behavior of juvenile Crassostrea virginica (Gmelin). I. Valve movements and periodic activity. Journal of Experimental and Experimental Marine Biology and Ecology. 45, 229-244 (1980).
- Riisgård, H. U., Lassen, J., Kittner, C. Valve-gape response times in mussels (Mytilus edulis)-Effects of laboratory preceding-feeding conditions and in situ tidally induced variation in phytoplankton biomass. Journal of Shellfish Research. 25, 901-911 (2006).
- Robson, A. A., De Leaniz, C. G., Wilson, R. P., Halsey, L. G. Behavioural adaptations of mussels to varying levels of food availability and predation risk. Journal of Molluscan Studies. 76, 348-353 (2010).
- Robson, A. A., de Leaniz, C. G., Wilson, R. P., Halsey, L. G. Effect of anthropogenic feeding regimes on activity rhythms of laboratory mussels exposed to natural light. Hydrobiologia. 655, 197-204 (2010).
- Nicastro, K. R., Zardi, G. I., McQuaid, C. D., Stephens, L., Radloff, S., Blatch, G. L. The role of gaping behaviour in habitat partitioning between coexisting intertidal mussels. BMC Ecology. 10, 17 (2010).
- Loosanoff, V. S., Nomejko, C. A. Feeding of oysters in relation to tidal stages and to periods of light and darkness. Biological Bulletin. 90 (3), 244-264 (1946).
- Comeau, L. A., Mayrand, E., Mallet, A. Winter quiescence and spring awakening of the Eastern oyster Crassostrea virginica at its northernmost distribution limit. Marine Biology. 159 (10), 2269-2279 (2012).
- Pynonnen, K. S., Huebner, J. Effects of episodic low pH exposure on the valve movements of the freshwater bivalve Anodonta cygnea L. Water Research. 29 (11), 2579-2582 (1995).
- Jakubowska, M., Normant-Saremba, M. The effect of CO2-induced seawater acidification on the behaviour and metabolic rate of the baltic clam Macoma balthica. Annales Zoologici Fennici. 52 (5-6), 353-367 (2015).
- Jakubowska, M., Normant, M. Metabolic rate and activity of blue mussel Mytilus edulis trossulus.under short-term exposure to carbon dioxide-induced water acidification and oxygen deficiency. Marine and Freshwater Behaviour and Physiology. 48 (1), 25-39 (2015).
- Newell, C. R., Wildish, D. J., MacDonald, B. A. The effects of velocity and seston concentration on the exhalent siphon area, valve gape and filtration rate of the mussel Mytilus edulis. Journal of Experimental Marine Biology and Ecology. 262, 91-111 (2001).
- Maire, O., Amouroux, J. -. M., Duchene, J. -. C., Gremare, A. Relationship between filtration activity and food availability in the Mediterranean mussel Mytilus galloprovincialis. Marine Biology. 152 (6), 1293-1307 (2007).
- Borcherding, J. Ten years of practical experience with the Dreissena-monitor, a biological early warning system for continuous water quality monitoring. Hydrobiologia. 556 (1), 417-426 (2006).
- Frank, D. M., Hamilton, J. F., Ward, E. E., Shumway, S. E. A fiber optic sensor for high resolution measurement and continuous monitoring of valve gape in bivalve molluscs. Journal of Shellfish Research. 26 (2), 575-580 (2007).
- Wilson, R., Reuter, P., Wahl, M. Muscling in on mussels: New insights into bivalve behaviour using vertebrate remote-sensing technology. Marine Biology. 147 (5), 1165-1172 (2005).
- Nagai, K., Honjo, T., Go, J., Yamashita, H., Seok Jin, O. Detecting the shellfish killer Heterocapsa circularisquama (Dinophyceae) by measuring bivalve valve activity with a Hall element sensor. Aquaculture. 255 (1-4), 395-401 (2006).
- Robson, A., Wilson, R., de Leaniz, C. G. Mussels flexing their muscles: a new method for quantifying bivalve behaviour. Marine Biology. 151 (3), 1195-1204 (2007).
- Robson, A. A., Thomas, G. R., de Leaniz, C. G., Wilson, R. P. Valve gape and exhalant pumping in bivalves: optimization of measurement. Aquatic Biology. 6 (1-3), 191-200 (2009).
- de Zwart, D., Kramer, J. M., Jenner, H. A. Practical experiences with the biological early warning system “mosselmonitor”. Environmental Toxicology and Water Quality. 10 (4), 237-247 (1995).
- Jou, L. -. J., Lin, S. -. C., Chen, B. -. C., Chen, W. -. Y., Liao, C. -. M. Synthesis and measurement of valve activities by an improved online clam-based behavioral monitoring system. Computers and Electronics in Agriculture. 90, 106-118 (2013).
- Barile, N. B., Scopa, M., Recchi, S., Nerone, E. Biomonitoring of coastal marine waters subject to anthropogenic use: development and application of the biosensor Mosselmonitor. Ovidius University Annals of Chemistry. 27 (2), 81-86 (2016).
- Ballesta-Artero, I., Witbaard, R., Carroll, M. L., van der Meer, J. Environmental factors regulating gaping activity of the bivalve Arctica islandica in Northern Norway. Marine Biology. 164 (5), 116 (2017).
- Ekelof, S. The genesis of the Wheatstone bridge. Engineering Science and Education Journal. 10, 37-40 (2001).
- Keppel, A. G., Breitburg, D. L., Wikfors, G. H., Burrell, R. B., Clark, V. M. Effects of co-varying diel-cycling hypoxia and pH on disease susceptibility in the eastern oyster Crassostrea virginica. Marine Ecology Progress Series. 538, 169-183 (2015).
- Burrell, R. B., Keppel, A. G., Clark, V. M., Breitburg, D. L. An automated monitoring and control system for flow-through co-cycling hypoxia and pH experiments. Limnology and Oceanography: Methods. 14, 168-185 (2015).
- Porter, E. T., Breitburg, D. L. Eastern oyster Crassostrea virginica, valve gape behavior under diel-cycling hypoxia. Marine Biology. 163 (218), (2016).
- Bergeron, C. M. . The impact of sediment resuspension on mercury cycling and the bioaccumulation of methylmercury into benthic and pelagic organisms. , (2005).

