En töjningsmätaren Monitor (SGM) för kontinuerlig ventil gapa mätningar i tvåskaliga blötdjur som svar på laboratoriet inducerad Diel-cykling hypoxi och pH
Summary
Förstå de beteendemässiga Svaren tvåskaliga suspension-matare till miljövariabler, till exempel löst syre, kan förklara vissa ekosystem processer. Vi har utvecklat en billig, laboratoriebaserade, töjningsmätaren monitor (SGM) att mäta ventil gapa Svaren av ostron, Crassostrea virginica, diel-cykling hypoxi och cykliska pH.
Abstract
En billig, laboratoriebaserade, töjningsmätaren ventil gapa monitor (SGM) utvecklades för att övervaka beteendet ventil gapa av tvåskaliga blötdjur i svar till diel-cykling hypoxi. En Wheatstone bridge var ansluten till trådtöjningsgivare som kopplats till skal av ostron (Crassostrea virginica). De inspelade signalerna får för öppning och stängning av musslor registreras kontinuerligt under två dagars perioder av experimentellt inducerad diel-cykling hypoxi och diel-cykling förändringar i pH. Här, vi beskriver ett protokoll för att utveckla en billig töjningsmätaren monitor och beskriver, i ett exempel laboratorium experiment, hur vi använde det för att mäta ventil gapa beteende östra ostron (C. virginica), svar till diel-cykling hypoxi och cykliska förändringar i pH. Ventil gapa mättes på ostron utsätts för cykliska svår hypoxisk (0,6 mg/L) upplöst syre villkor med och utan cykliska förändringar i pH, cykliska mild hypoxisk (1,7 mg/L) villkor och normoxic (7,3 mg/L). Vi visar att när ostron möter upprepade diel cykler, de snabbt stänga sina skal svar på svår hypoxi och Stäng med fördröjning till lindrig hypoxi. När normoxia återställs öppna de snabbt igen. Ostron svarade inte på cykliska pH förhållanden ovanpå diel cykling svår hypoxi. Vid minskad Syreförhållandena, mer än en tredjedel av ostronen stängda samtidigt. Vi visar att ostron bemöta diel-cykling hypoxi, vilket måste beaktas när bedömningen av beteendet hos musslor till upplöst syre. Ventilens SGM kan användas för att bedöma svaren av tvåskaliga blötdjur till förändringar i upplöst syrgas eller föroreningar. De ventilen gapa töjningsgivare från havsvatten tätning tekniker för att bättre tätning och krävdes ytterligare förbättringar att öka livslängden på sensorerna.
Introduction
Hypoxi, dvs upplöst syre koncentrationer [göra] tillräckligt lågt för att negativt påverka biologiska och ekologiska processer men ofta funktionellt definierade som [göra] < 2 mg / L1och anoxia (funktionellt definierade som [DO] 0,0-0,2 mg/L) sker oftare och hårdare i världens kustvatten, flodmynningar och den djupa hav2,3 och förvärras ofta av ökande eutrofiering4,5. Med en ökande areal grad av hypoxi och anoxi, makrofauna påverkas negativt och förlora livsmiljö omfattning och livsmiljö kvalitet. Klimatförändringarna förutspås för att förvärra hypoxi och anoxi6.
I många stratifierat, näringsämne-berikad flodmynningar som Chesapeake Bay, USA, säsongsmässigt ihållande hypoxi kan segra och kan uppstå efter år2. Dessutom diel-cykling av hypoxi är frekventerar i flodmynningar som de Chesapeake Bay och andra platser och uppstår sent under natten eller tidigt på morgonen i sommar7,8.
De flesta studier har fokuserat på effekten av kontinuerlig exponering av organismer till låg [DO] och deras tolerans till hypoxi och anoxi9,10,11,12,13,14 . Studier har dessutom tittat på storskalig förändring i artsammansättningen distributioner, sammansättning och arter som svar på utökade låg [DO]4,15. Ofta arter som är mycket känsliga för lågt [göra], dö i massor,16 skiftande övriga arter till en yngre, mindre och medelstora, kortlivade fauna som till exempel, hittade på Louisiana-Texas hylla ekosystem4.
Beteendeförändringar vanligtvis föregår gemenskapens kollaps17 och studier har rapporterat på beteendemässiga Svaren av organismer till utökade låg [DO]4,16,17,18,19 ,20,21,22,23,24,25. Dessa studier, dock fokuserar inte på svaren från organismer till diel-cykling exponeringar av hypoxi och fluktuerande natur [DO] tillgänglighet i flodmynningar.
Diel-cykling hypoxi i grunt flodmynningar har fått ökande medvetenhet som studier övervaka [göra] mer ofta under loppet av dagar med Kerstin i flodmynningar16,26. Vatten kan förbli hypoxisk för timmar i slutet av natten eller tidigt på morgonen på sommaren när det finns ingen genererar syre fotosyntesen under natten men hög syreförbrukande aerob respiration7,16. Det konstaterades också att tidvattnet påverkas diel cykling låg villkor med de mest extrema minima observerade när lågvatten sammanföll med avsluta av natten27. Först efter flera timmar av hypoxi [gör] komma tillbaka till normoxia7,16,28 i dagligt cykeln.
Att bestämma C. virginica beteendemässiga svar på diel-cykling hypoxi och pH vi övervakade öppning och stängning av ventiler av ostron utsätts för laboratoriet inducerad diel cykling [Do] och cykliska pH. Gapa Svaren av musslor har använts för att upptäcka skadliga miljöförhållanden. Ventil nedläggningar av musslor som svar på föroreningar29,30,31, giftiga alger32,33,34, termisk förorening35,36 , 37, mat kvantitet minska38,39,40, utfodring regimen39,41, emersion37,42, fotoperiod43 , 44, pH45,46, och kombinerade pH och löst syre47 har mätts. Gapa tekniker har, till exempel ingår direkta observationer48,49,13, kontinuerliga mätningar med reed switchar och magneter (Dreissena monitor)50eller fiberoptiska sensorer 51 som kräver klart vatten. Dessutom har magnet och magnetfält styrka hallgivare använts för att studera mussla gapa vinkel52,53,54,55och ett högfrekvent elektromagnetisk induktion system att kan mäta varierande avståndet mellan två elektriska spolar som är limmade på ventilerna har varit används56,57,58,59. En hög spänningskälla krävs för elektromagnetisk induktion system och makt måste levereras till båda sidor av shell52. Detta system är också kommersiellt tillgängliga som den ”MOSSELMONITOR” (http://mosselmonitor.nl/).
På en tight forskningsbudget, konstruerade vi en billig töjningsmätaren monitor (SGM) att kontinuerligt mäta oyster gapa över laboratorium-inducerad diel cykling [Do] och pH, låga siktvärden villkor. Vårt system är också mycket enklare än konkurrerande system, vilket möjliggör många djur att vara instrumenterad under ett experiment. Vi ville bestämma de beteendemässiga svar på C. virginica diel cykling svår ([göra] = 0,6 mg/L) hypoxi med kontroll pH (pH = 7,8) och cykling pH (pH = 7,8-7.0), respektive, och gapa Svaren till mild ([göra] = 1,7 mg/L) hypoxi. Dessutom ville vi avgöra om ostron är kunna svara snabbt på förändringar i [göra] över diel cykel och hur de reagerar när normoxia återgår efter en hypoxisk händelse. Kanske är ostron optimalt anpassade till snabbt fluktuerande miljö som finns i många flodmynningar16,27 där de lever. Medan mer komplexa ventil gapa bildskärmar finns, erbjuder SGM en billig teknik som tillåter kontinuerliga mätningar av ventilen gapa i vatten även i låga siktvärden förhållanden.
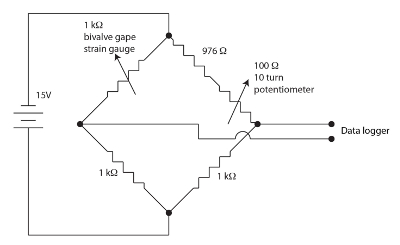
Figur 1. Wheatstone bridge för ventil gapa apparatur. Klicka här för att se en större version av denna siffra.
Anstränga mätinstrumentet sensorerna används för övervakning av tvåskaliga gapa är resistiv filmer i en meander mönster på en polyimid bakningen. Små mängder stam modulera motståndet av sensorn. Tvåskaligt flexar stam nivåglaset när det gapar orsakar en förändring i sensorns motstånd. Vi anställt en ogyltig, balanserad, Wheatstone-brygga för varje tvåskaliga kanal som visas i figur 1 att mäta förändringen i temperatursensor motståndet. Wheatstone överbrygga är nulled av potentiometern tillåter en ganska hög vinst att vara anställd av en datalogger. En Wheatstone bridge är en standardmetod för att exakt mäta en okänd motstånd med hjälp av ett förhållande till en känd motstånd som standard och en voltmeter. Historien om denna mycket gamla teknik diskuteras i Ekelof (2001)60. Vi integrerat 12 kanaler, alla med sin egen Wheatstone bridge och ogyltig potentiometer, töjningsmätaren Monitor (SGM) enheten.
Protocol
Representative Results
Discussion
Typiska studier fokus på kontinuerlig, utökade tidsperioder av låg syrehalt villkor och svaret, ofta mätt som överlevnad, djur. För närvarande är dock vår förståelse av de beteendemässiga svar på djur diel-cykling hypoxi minimal63. Fler studier bör således fokusera på beteendet hos organismer som svar på diel-cykling hypoxi som sker regelbundet över sommaren i många flodmynningar7,8.
Här pres…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
Vi tackar Melinda Forseth för att ta bilder av ostron och mäta deras gapa bredd i ImageJ. Vi tackar Denise Breitburg för tillgång till aquaria med diel cykling hypoxi och cykliska pH förhållanden. Vi tackar Smithsonian Environmental Research Center, Edgewater, Maryland, för utrymme för experiment. Hypoxi experimenten finansierades av en National Oceanic and Atmospheric Administration – Center för sponsrade Coastal Ocean forskningsbidrag nej. NA10NOS4780138 och Smithsonian Hunterdon fonden till Denise Breitburg. Ventilen gapa mätningar under den hypoxi experimenten finansierades av fakulteten Enhancement bidrag av Washington College till Elka T. Porter.
Materials
| Campbell CR 10x data logger | Campbell Scientific, Logan, Utah | Or other data logger. At Campbell the CR 10X has been replaced with the CR 1000 | |
| Campbell CR 10x multiplexer | Campbell Scientific, Logan, Utah | Data logger needs to have space for 12 channels | |
| Dsub connector male crimp pins | TE Connectivity | 205089-1 | pins for gape sensor leads |
| PCA tape | Micro Measurements Corp, NC | To seal the strain gauge | |
| Duro Quick Gel | Ace Hardware | Superglue | |
| SG13/1000-LY43 or LY41 | Omega Engineering Inc., Stanford, CT | Strain gauges | |
| 32 AWG (7/40) teflon Alpha wires | AlphaWire, Elizabeth, NJ | 2840/7 | Sensor cables, different colors are available |
| 1/16" heat shrink tubing | Qualtek | B01A3QKKO6 | To seal the leads of the sensor cable |
| Weller WES51 Analog Soldering Station | Amazon | Lots of soldering, need a good soldering iron. https://www.amazon.com/Weller-WES51-Analog-Soldering-Station/dp/B000BRC2XU/ref=sr_1_23?s=hi&ie=UTF8&qid=1505654295 &sr=1-23&keywords=soldering+iron |
|
| Rosin Soldering Flux Paste | Amazon | Needed for soldering | |
| 60-40 Tin Lead Rosin Core Solder Wire | Amazon | Needed for soldering | |
| Aquarium sealant | Home Depot | Attach sensors to bivalve | |
| PC Laptop | Any old PC to run Campbell gape program | ||
| heat gun | Amazon | shrink shrink tubing | |
| Drill | Hardware store, Amazon | for twisting wires to make sensor cables | |
| AC to DC power module | Acopian | DB15-30 | Wheatstone bridge power supply |
| Poteniometer | Clarostat | 733A | Wheatsone bridge nulling |
| isolating BNC connector | Sterren Electronics | "200-148 | Wheatstone bridge output for multimeter |
| Fused AC receptical panel module | Adam technologies | IEC-GS-1-200 | Wheatstone bridge power supply connector |
| 976 ohm 1% resistor | Vishay Dale | CMF50976R00FHEB | Wheatstone bridge resistor |
| 1 kohm 1% resistor | Vishay Dale | CMF501K0000FHEB | Wheatstone bridge resistor |
| Potentiometer scale dial | Kilo International | 462 | 10 turn dial for nulling potentiometer |
| DB25 male panel connector | TE connectivity | 1757819-8 | Data logger connector on Wheatstone bridge |
| DB25 female panel connector | TE connectivity | 1757819-8 | Sensor connector to Wheatstone bridge |
| perforated circuit board | Vector electronics | 64P44WE | circuit board for mounting of bridge components |
| enclosure | Hammond Manufacturing | 1444-29 | Enclosure for sensor readout electronics |
Riferimenti
- Vaquer-Sunyer, R., Duarte, C. M. Thresholds of hypoxia for marine biodiversity. Proceedings of the National Academy of Sciences of the United States of America. 105 (40), 15452-15457 (2008).
- Diaz, R. J., Rosenberg, R. Spreading dead zones and consequences for marine ecosystems. Science. 321, 926-929 (2008).
- Levin, L. A., Breitburg, D. L. Linking coasts and seas to address ocean deoxygenation. Nature Climate Change. 5, 401-403 (2015).
- Diaz, R. J., Rosenberg, R. Marine benthic hypoxia: A review of its ecological effects and the behavioural responses of benthic macrofauna. Oceanography and Marine Biology: An annual Review. 33, 245-303 (1995).
- Patterson, H. K., Boettcher, A., Carmichael, R. H. Biomarkers of dissolved oxygen stress in oysters: a tool for restoration and management efforts. PLoS One. 9 (8), 104440 (2014).
- Altieri, A. H., Gedan, K. B. Climate change and dead zones. Global Change Biology. 21 (4), 1395-1406 (2015).
- Tyler, R. M., Brady, D. C., Targett, T. E. Temporal and spatial dynamics of diel-cycling hypoxia in estuarine tributaries. Estuaries and Coasts. 32 (1), 123-145 (2009).
- Breitburg, D. L., et al. Landscape-level variation in disease susceptibility related to shallow-water hypoxia. PLoS One. 10 (2), 0116223 (2015).
- Stickle, W. B., Kapper, M. A., Liu, L. -. L., Gnaiger, E., Wang, S. Y. Metabolic adaptations of several species of crustaceans and molluscs to hypoxia: toterance and microcalometric studies. Biological Bulletin. 177 (2), 303-312 (1989).
- Gamenick, I., Jahn, A., Vopel, K., Guiere, O. Hypoxia and sulphide as structuring factors in a macrozoobenthic community on the Baltic Sea shore: colonization studies and tolerance experiments. Marine Ecology Progress Series. , 73-85 (1996).
- Modig, H., Olafsson, E. Responses of Baltic benthic invertebrates to hypoxic events. Journal of Experimental Marine Biology and Ecology. 229 (1), 133-148 (1998).
- Riedel, B., Zuschin, M., Stachowitsch, M. Tolerance of benthic macrofauna to hypoxia and anoxia in shallow coastal seas: a realistic scenario. Marine Ecology Progress Series. 458, 39-52 (2012).
- Lombardi, S. A., Harlan, N. P., Paynter, K. T. Survival, acid-base balance, and gaping responses of the Asian Oyster C. ariakensis and the Eastern Oyster C. virginica during clamped emersion and hypoxic immersion. Journal of Shellfish Research. 32 (2), 409-415 (2013).
- Jansson, A., Norkko, J., Dupont, S., Norkko, A. Growth and survival in a changing environment: Combined effects of moderate hypoxia and low pH on juvenile bivalve Macoma balthica. Journal of Sea Research. 102, 41-47 (2015).
- Gooday, A. J., et al. Faunal responses to oxygen gradients on the Pakistan margin: A comparison of foraminiferans, macrofauna and megafauna. Deep Sea Research Part II: Topical Studies in Oceanography. 56 (6-7), 488-502 (2009).
- Montagna, P. A., Ritter, C. Direct and indirect effects of hypoxia on benthos in Corpus Christi Bay, Texas, U.S.A. Journal of Experimental Marine Biology and Ecology. 330 (1), 119-131 (2006).
- Villnas, A., Norkko, J., Lukkari, K., Hewitt, J., Norkko, A. Consequences of increasing hypoxic disturbance on benthic communities and ecosystem functioning. PLoS One. 7 (10), 44920 (2012).
- Breitburg, D. Effects of hypoxia, and the balance between hypoxia and enrichment on coastal fishes and fisheries. Estuaries. 25 (4), 767-781 (2002).
- Costantini, M., et al. Effect of hypoxia on habitat quality of striped bass (Morone saxatilis) in Chesapeake Bay. Canadian Journal of Fisheries and Aquatic Sciences. 65 (5), 989-1002 (2008).
- Ludsin, S. A., et al. Hypoxia-avoidance by planktivorous fish in Chesapeake Bay: Implications for food web interactions and fish recruitment. Journal of Experimental Marine Biology and Ecology. 381, 121-131 (2009).
- Zhang, H., et al. Hypoxia-driven changes in the behavior and spatial distribution of pelagic fish and mesozooplankton in the northern Gulf of Mexico. Journal of Experimental Marine Biology and Ecology. 381, 80-91 (2009).
- Sparks, B. L., Strayer, D. L. Effects of low dissolved oxygen on juvenile Elliptio complanata (Bivalvia:Unionidae). Journal of the Norther American Benthological Society. 17, 129-134 (1998).
- Llanso, R. J. Effects of hypoxia on estuarine benthos: the lower Rappahannock River (Chesapeake Bay), a case study. Estuarine, Coastal and Shelf Science. 35 (5), 491-515 (1992).
- Riedel, B., Zuschin, M., Haselmair, A., Stachowitsch, M. Oxygen depletion under glass: Behavioural responses of benthic macrofauna to induced anoxia in the Northern Adriatic. Journal of Experimental Marine Biology and Ecology. 367 (1), 17-27 (2008).
- Riedel, B., et al. Effect of hypoxia and anoxia on invertebrate behaviour: Ecological perspectives from species to community level. Biogeosciences. 11 (6), 1491-1518 (2014).
- Breitburg, D. L. Near-shore hypoxia in the Chesapeake Bay: Patterns and relationships among physical factors. Estuarine Coastal and Shelf Science. 30, 593-609 (1990).
- Baumann, H., Wallace, R. B., Tagliaferri, T., Gobler, C. J. Large natural pH, CO2 and O2 fluctuations in a temperate tidal salt marsh on diel, seasonal, and interannual time scales. Estuaries and Coasts. 38, 220-231 (2015).
- Breitburg, D. L., et al. Landscape-level variation in disease susceptibility related to shallow-water hypoxia. PLoS One. 10 (2), 0116223 (2015).
- de Zwart, D., Kramer, J. M., Jenner, H. A. Practical experiences with the biological early warning system “mosselmonitor”. Environmental Toxicology and Water Quality. 10 (4), 237-247 (1995).
- Kadar, E., et al. Avoidance responses to aluminum in the freshwater bivalve Anodonta cygnea. Aquatic Toxicology. 55, 137-148 (2001).
- Soliman, M. F. M., El-Shenawy, N. S., Tadros, M. M., Abd El-Azeez, A. A. Impaired behavior and changes in some biochemical markers of bivalve (Ruditapes decussatus) due to zinc toxicity. Toxicological & Environmental Chemistry. 97 (5), 674-686 (2015).
- Shumway, S. E., Cucci, T. L. The effects of the toxic dinoflagellate Protogonyaulax tamarensis on the feeding and behaviour of bivalve molluscs. Aquatic Toxicology. 10, 9-27 (1987).
- Basti, L., et al. Effects of the toxic dinoflagellate Heterocapsa circularisquama on the valve movement behaviour of the Manila clam Ruditapes philippinarum. Aquaculture. 291 (1-2), 41-47 (2009).
- Tran, D., Haberkorn, H., Soudant, P., Ciret, P., Massabuau, J. -. C. Behavioral responses of Crassostrea gigas exposed to the harmful algae Alexandrium minutum. Aquaculture. 298 (3-4), 338-345 (2010).
- Shumway, S. E., Koehn, R. K. Oxygen consumption in the American oyster Crassostrea virginica. Marine Ecology Progress Series. 9, 59-68 (1982).
- Nicastro, K. R., Zardi, G. I., McQuaid, C. D., Pearson, G. A., Serrao, E. A. Love thy neighbour: group properties of gaping behaviour in mussel aggregations. PLoS One. 7 (10), (2012).
- Dowd, W. W., Somero, G. N. Behavior and survival of Mytilus. congeners following episodes of elevated body temperature in air and seawater. Journal of Experimental Biology. 216 (3), 502-514 (2013).
- Higgins, P. J. Effects of food availability on the valve movements and feeding behavior of juvenile Crassostrea virginica (Gmelin). I. Valve movements and periodic activity. Journal of Experimental and Experimental Marine Biology and Ecology. 45, 229-244 (1980).
- Riisgård, H. U., Lassen, J., Kittner, C. Valve-gape response times in mussels (Mytilus edulis)-Effects of laboratory preceding-feeding conditions and in situ tidally induced variation in phytoplankton biomass. Journal of Shellfish Research. 25, 901-911 (2006).
- Robson, A. A., De Leaniz, C. G., Wilson, R. P., Halsey, L. G. Behavioural adaptations of mussels to varying levels of food availability and predation risk. Journal of Molluscan Studies. 76, 348-353 (2010).
- Robson, A. A., de Leaniz, C. G., Wilson, R. P., Halsey, L. G. Effect of anthropogenic feeding regimes on activity rhythms of laboratory mussels exposed to natural light. Hydrobiologia. 655, 197-204 (2010).
- Nicastro, K. R., Zardi, G. I., McQuaid, C. D., Stephens, L., Radloff, S., Blatch, G. L. The role of gaping behaviour in habitat partitioning between coexisting intertidal mussels. BMC Ecology. 10, 17 (2010).
- Loosanoff, V. S., Nomejko, C. A. Feeding of oysters in relation to tidal stages and to periods of light and darkness. Biological Bulletin. 90 (3), 244-264 (1946).
- Comeau, L. A., Mayrand, E., Mallet, A. Winter quiescence and spring awakening of the Eastern oyster Crassostrea virginica at its northernmost distribution limit. Marine Biology. 159 (10), 2269-2279 (2012).
- Pynonnen, K. S., Huebner, J. Effects of episodic low pH exposure on the valve movements of the freshwater bivalve Anodonta cygnea L. Water Research. 29 (11), 2579-2582 (1995).
- Jakubowska, M., Normant-Saremba, M. The effect of CO2-induced seawater acidification on the behaviour and metabolic rate of the baltic clam Macoma balthica. Annales Zoologici Fennici. 52 (5-6), 353-367 (2015).
- Jakubowska, M., Normant, M. Metabolic rate and activity of blue mussel Mytilus edulis trossulus.under short-term exposure to carbon dioxide-induced water acidification and oxygen deficiency. Marine and Freshwater Behaviour and Physiology. 48 (1), 25-39 (2015).
- Newell, C. R., Wildish, D. J., MacDonald, B. A. The effects of velocity and seston concentration on the exhalent siphon area, valve gape and filtration rate of the mussel Mytilus edulis. Journal of Experimental Marine Biology and Ecology. 262, 91-111 (2001).
- Maire, O., Amouroux, J. -. M., Duchene, J. -. C., Gremare, A. Relationship between filtration activity and food availability in the Mediterranean mussel Mytilus galloprovincialis. Marine Biology. 152 (6), 1293-1307 (2007).
- Borcherding, J. Ten years of practical experience with the Dreissena-monitor, a biological early warning system for continuous water quality monitoring. Hydrobiologia. 556 (1), 417-426 (2006).
- Frank, D. M., Hamilton, J. F., Ward, E. E., Shumway, S. E. A fiber optic sensor for high resolution measurement and continuous monitoring of valve gape in bivalve molluscs. Journal of Shellfish Research. 26 (2), 575-580 (2007).
- Wilson, R., Reuter, P., Wahl, M. Muscling in on mussels: New insights into bivalve behaviour using vertebrate remote-sensing technology. Marine Biology. 147 (5), 1165-1172 (2005).
- Nagai, K., Honjo, T., Go, J., Yamashita, H., Seok Jin, O. Detecting the shellfish killer Heterocapsa circularisquama (Dinophyceae) by measuring bivalve valve activity with a Hall element sensor. Aquaculture. 255 (1-4), 395-401 (2006).
- Robson, A., Wilson, R., de Leaniz, C. G. Mussels flexing their muscles: a new method for quantifying bivalve behaviour. Marine Biology. 151 (3), 1195-1204 (2007).
- Robson, A. A., Thomas, G. R., de Leaniz, C. G., Wilson, R. P. Valve gape and exhalant pumping in bivalves: optimization of measurement. Aquatic Biology. 6 (1-3), 191-200 (2009).
- de Zwart, D., Kramer, J. M., Jenner, H. A. Practical experiences with the biological early warning system “mosselmonitor”. Environmental Toxicology and Water Quality. 10 (4), 237-247 (1995).
- Jou, L. -. J., Lin, S. -. C., Chen, B. -. C., Chen, W. -. Y., Liao, C. -. M. Synthesis and measurement of valve activities by an improved online clam-based behavioral monitoring system. Computers and Electronics in Agriculture. 90, 106-118 (2013).
- Barile, N. B., Scopa, M., Recchi, S., Nerone, E. Biomonitoring of coastal marine waters subject to anthropogenic use: development and application of the biosensor Mosselmonitor. Ovidius University Annals of Chemistry. 27 (2), 81-86 (2016).
- Ballesta-Artero, I., Witbaard, R., Carroll, M. L., van der Meer, J. Environmental factors regulating gaping activity of the bivalve Arctica islandica in Northern Norway. Marine Biology. 164 (5), 116 (2017).
- Ekelof, S. The genesis of the Wheatstone bridge. Engineering Science and Education Journal. 10, 37-40 (2001).
- Keppel, A. G., Breitburg, D. L., Wikfors, G. H., Burrell, R. B., Clark, V. M. Effects of co-varying diel-cycling hypoxia and pH on disease susceptibility in the eastern oyster Crassostrea virginica. Marine Ecology Progress Series. 538, 169-183 (2015).
- Burrell, R. B., Keppel, A. G., Clark, V. M., Breitburg, D. L. An automated monitoring and control system for flow-through co-cycling hypoxia and pH experiments. Limnology and Oceanography: Methods. 14, 168-185 (2015).
- Porter, E. T., Breitburg, D. L. Eastern oyster Crassostrea virginica, valve gape behavior under diel-cycling hypoxia. Marine Biology. 163 (218), (2016).
- Bergeron, C. M. . The impact of sediment resuspension on mercury cycling and the bioaccumulation of methylmercury into benthic and pelagic organisms. , (2005).

