En kolorimetriske metode til måling af jernindhold i planter
Summary
Vi præsenterer en enkel og pålidelige protokol til måling af jernindhold i plantevæv ved hjælp af metoden kolorimetriske preussiske Blue.
Abstract
Jern, en af de vigtigste mikronæringsstoffer i levende organismer, er involveret i grundlæggende processer, såsom respiration og fotosyntese. Jernindholdet er temmelig lav i alle organismer, beløber sig i planter til omkring 0,009% af tørvægt. Til dato, er en af de mest præcise metoder til måling af koncentrationen af jern i plantevæv flamme absorption atomic spektroskopi. Men denne fremgangsmåde er tidskrævende og dyrt og kræver specifikke udstyr ikke almindeligt forekommende i anlægget laboratorier. Derfor er der behov for en enklere, men nøjagtige metode, som kan anvendes rutinemæssigt. Metoden kolorimetriske preussiske Blue bruges regelmæssigt til kvalitative jern farvning i dyre- og plantearter histologiske sektioner. I denne undersøgelse tilpasset vi den preussiske blå metode for kvantitative målinger af jern i tobak blade. Vi valideret rigtigheden af denne metode, ved hjælp af både atomare spektroskopi og preussiske Blue farvning for at måle jernindhold i de samme prøver og fundet en lineær regression (R2 = 0,988) mellem de to procedurer. Vi konkludere, at den preussiske Blue metode til kvantitativ jern måling i plantevæv er præcise, enkel og billig. Den lineære regression præsenteres her kan imidlertid ikke være hensigtsmæssigt for andre plantearter på grund af potentielle vekselvirkninger mellem prøven og reagenset. Etablering af en regression kurve er således nødvendig for forskellige plantearter.
Introduction
Jern (Fe) er et vigtigt mikronæringsstof i alle levende organismer. I planter er det et essentielt mikronæringsstof1 på grund af sit engagement i grundlæggende processer, såsom respiration, fotosyntese og klorofyl biosyntesen. Høj ophobning af frit jern ioner er skadeligt at plante celler på grund af reaktioner fører til frigivelse af frie radikaler forårsager oxidativ stress. For at fastholde jern homøostase inden for plante celle, ioner gemmes i vacuoles og afsondret inden for ferritins, protein bure direkte involveret i jern homøostase2 og de vigtigste lagerstrukturen af jern i alle levende organismer. På samme tid påvirker jernmangelanæmi en væsentlig del af den menneskelige befolkning, hvilket resulterer i et stigende behov for anlæg Fe biofortification. På grund af de unikke egenskaber af anlægget ferritin tilbyder mad berigelse med ferritin-jern en lovende strategi for at bekæmpe problemet med fejlernæring3.
Jern ioner er hovedsageligt fundet i to oxidation stater, nemlig den jernholdige (divalent Fe2 + eller jern (II)) og jern (trivalent Fe3 + eller jern (III)) former. Flere andre former for jern, såsom jern klynger4, findes også i celler. Fe er gemt som jernoxid i celle og naturligvis former hematites (Fe2O3) og ferryhidrites ((Fe3 +)2O3•0.5 H2O) under fysiologiske forhold5. Hydroxider dannet i disse reaktioner, især jern form, har meget lav opløselighed. Opbevaring af jern påvirkes derfor af pH af løsningen og er i vid udstrækning i en solid state over pH 56.
I betragtning af de fattige opløselighed og høj reaktivitet af Fe, skal overførsel blandt plantevæv og organer være forbundet med egnet chelaterende molekyler. Desuden skal sin redox stater mellem jern og jern skemaer1 kontrolleres. Inden for blade, omkring 80% af jern findes i fotosyntetiserende celler, på grund af dens afgørende roller i elektronen transportsystem, i biosyntesen af cytokromer, der, klorofyl og andre hæm molekyler, og i dannelsen af Fe-S klynger7. For jern overskud i cellen, er overskuddet omplantes til vacuole hvor metallet er gemt i ferritin molekyler8.
Jern kan måles i plantevæv ved flere metoder, herunder flamme atomic absorption spektroskopi9 (Frederiksen) eller kolorimetriske assays10, førstnævnte er langt mere præcis end sidstnævnte. Frederiksen er en meget præcis teknik, der gør det muligt at bestemme den elementære sammensætning af en stikprøve på grundlag af elektromagnetisk emission af de enkelte elementer. Frederiksen konverterer metalioner til atomic stater ved flamme-opvarmning af stikprøven, fører til ion excitations- og af en bestemt bølgelængde, når en given ion vender tilbage til sin grundtilstand. Emissioner fra de forskellige ioner er adskilt af en monochromator og opdaget af en absorption sensor11. Frederiksen dermed tjener til at sætte direkte tal jern koncentrationer. Andre teknikker til at visualisere jern i biologisk væv er dog tilgængelige. Induktivt koblet plasma-masse spektroskopi (ICP-MS)12 er en meget præcis teknik til måling af jern og andre sporstoffer, men manglen på udstyr, både for Frederiksen og ICP-MS, er et fælles problem. På den anden side jern måling af kaliumthiocyanat kolorimetri13 mangler præcision og ikke at afsløre små variationer mellem prøver. Preussiske blå farvning14,15,16,17 er en indirekte metode baseret på reaktion af jern kaliumferrocyanid (K4Fe(CN)6) med Fe kationer, producerer en stærke blå farve, og bruges til registrering af kvalitative jern i histologiske sektioner af dyre- og plantearter væv.
Metalliske (nul-Valente) jern er sjældne i lithosfæren. Dominerende ikke-kompleksbundet ionisk form af jern i miljøet er hovedsagelig dikteret af mængden af ilt i omgivelserne, med jern jern er relativt mere rigelige i iltfattige miljøer og jern jern overvejende i aerob websteder. Denne sidstnævnte form er også dominerende i meget sure miljøer, selvom de agenser af jernholdige jern oxidation ofte afviger i iltfattige og sure omgivelser18. Når jern er oploeses i 4% HCl (pH 0) i en aerob miljø, den største del af den fortyndede jern findes som den jern danner (Fe3 +)19,20.
Reaktioner mellem Fe ioner og K4Fe(CN)6 er som følger:
Fe3 +: FeCl3 + K4Fe(CN)6 = KFe(III)Fe(II)(CN)6¯ + 3KCl
Fe2 +: 4 FeCl2 + 2 K4Fe(CN)6 = Fe4(Fe(CN)6)2 + 8 KCl
I den foreliggende undersøgelse spurgte vi om preussiske blå farvning kan være nyttige til måling af jern niveauer i løsning.
I første omgang har vi bekræftet sammenhængen mellem koncentrationen af Fe i vandig opløsning og preussiske blue farvning. Fe (som FeCl2, FeCl3 eller en 1:1 blanding af to) koncentration i vandige opløsninger blev målt både atomare spektroskopi og absorbans (OD) efter tilsætning af preussiske blue. Figur 1 viser de lineære regression kurver til målinger ved hver metode. Vi konkluderede, at den preussiske blue metode kan anvendes til kvantitativ analyse af jern koncentration i opløsning.
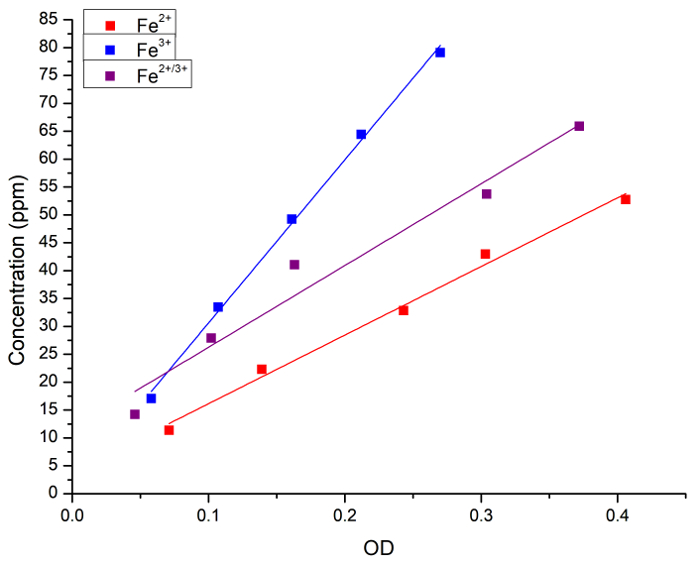
Figur 1: lineær regressionsanalyse mellem Fe koncentration målt ved Frederiksen og lys absorbans (OD, 715 nm) fremstillet ved den preussiske blue metode. De blå firkanter og linje repræsenterer Fe2 + løsningen, røde firkanter og linje repræsenterer Fe3 + løsning og de sorte firkanter og linje repræsenterer en 1:1 blanding mellem Fe2 + og Fe3 +. De følgende regressioner blev indhentet: [Fe2 +] = 3 + 123 x OD, r = 0.996, R2 = 0.989; [Fe3 +] = 1 + 292 x OD, r = 0.999, R2 = 0.997; og [Fe2 / 3 +] = 11 + 146 x OD, r = 0.983, R2 = 0.956. Fe2 + donor var FeCl2 og Fe3 + donor FeCl3. Venligst klik her for at se en større version af dette tal.
For at tilpasse de kolorimetriske preussiske blue metode til kvantitativ jern analyse af plantevæv, blev jernindhold af tobak blad aske målt af flamme absorption atomic spektroskopi og preussiske blue farvning. Der var god korrelation mellem resultaterne fra de to teknikker.
Protocol
Representative Results
Discussion
Jern måling i plantevæv er meget vigtige for at vurdere virkningerne af kunstvanding eller andre miljøforhold. Her, beskrev vi en nem og præcis kolorimetriske metode til Fe indhold måling i tobaksblade, der let kan tilpasses til andre plantearter og væv.
I at optimere betingelserne for den kolorimetriske metode, brugte vi en lav pH medium (pH < 1,0) for at tillade jern opløselighed. Brændingen var udført at frigive alle former for jern og sikre, at ingen forurenende stoffer i prøvern…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
Dette arbejde blev støttet af Israel Ministeriet for videnskab, teknologi og Spaceand af et tilskud fra chefforsker af den israelske landbrugsministerium (#16-16-0003).
Materials
| Potassium Hexacyanoferrate(II) | Fisher Chemical | 14459-95-1 | Reagent for the Pussian Blue |
| Millex Syringe Filter Unit, Vial Vent 0.22 μm | Millec | SLGP033RS | Filter used to filter the ashes + 4% HCl Solution |
| Scintillation Vials | Fisherbrand | 03-337-4 | Used to keep the dry powdered plant material during the burning procedure. |
| Disposable Syringe 10 ml | Medi-Plus | 1931 | Syringe used during the filtration |
| Hydrochloric acid | Sigma-Aldrich | 231-595-7 | Used in the 4% HCl solution to dilute the ashes and clean the materials |
| Tobacco, Nicotiana tabacum cv. Samsun NN | Obtained from Prof. Simon Barak and routinely used in the Zaccai Lab | Barak S, Nejidat A, Heimer Y, Volokita M. Transcriptional and posttranscriptional regulation of the glycolate oxidase gene in tobacco seedlings. Plant Molecular Biology. 2001 Mar 1;45(4):399-407. | Tobacco cultivar used in this protocol |
| Glass Wool (Rock Wool) | Sigma-Aldrich | 659997-17-3 | Used in the procedure of burning samples in the furnace. |
Riferimenti
- Kobayashi, T., Nishizawa, N. K. Iron uptake, translocation, and regulation in higher plants. Annual Review of Plant Biology. 63 (1), 131-152 (2012).
- Bradley, J. M., Le Brun, N. E., Moore, G. R. Ferritins: Furnishing proteins with iron. Journal of Biological Inorganic Chemistry. 21 (1), 13-28 (2012).
- Zielińska-Dawidziak, M. Plant ferritin – a source of iron to prevent its deficiency. Nutrients. 7 (2), 1184-1201 (2015).
- Johnson, D. C., Dean, D. R., Smith, A. D., Johnson, M. K. Structure, function, and formation of biological iron-sulfur clusters. Annual Review of Biochemistry. 74 (1), 247-281 (2015).
- Guo, H., Barnard, A. S. Naturally occurring iron oxide nanoparticles: morphology, surface chemistry and environmental stability. Journal of Materials Chemistry A. 1 (1), 27-42 (2013).
- Hem, J. D., Cropper, W. H. Chemistry of iron in natural water. Report US Geological Survey. , 1-31 (1962).
- Rout, G. R., Sahoo, S. Role of iron in plant growth and metabolism. Reviews in Agricultural Science. 3, 1-24 (2015).
- Speretto, R. A., Ricachenevsky, F. K., Stein, R. J., de Abreu Waldow, V., Fett, J. P. Iron stress in plants Dealing with deprivation and overload. Plant Stress. 4, 57-69 (2010).
- Tautkus, S., Steponeniene, L., Kazlauskas, R. Determination of iron in natural and mineral waters by flame atomic absorption spectrometry. Journal of the Serbian Chemical Society. 69 (5), 393-402 (2006).
- Braunschweig, J., Bosch, J., Heister, K., Kuebeck, C., Meckenstock, R. U. Reevaluation of colorimetric iron determination methods commonly used in geomicrobiology. Journal of Microbiological Methods. 89 (1), 41-48 (2012).
- PerkinElmer. . Atomic Spectroscopy – Guide to Selecting the Appropriate Technique and System. 16, (2011).
- Wachasunder, S. D., Nafade, A. Precision and accuracy control in the determination of heavy metals by atomic absorption spectrometry. Science. 58, 517-528 (2001).
- Woods, J. T., Mellon, M. G. Thiocyanate method for iron. A spectrophotometric study. Industrial & Engineering Chemistry Analytical Edition. 13 (8), 551-554 (1941).
- Perls, M. Nachweis von Eisenoxyd in gewissen Pigmenten. Virchows Archiv Fur Pathologische Anatomie Und Physiologie Und Fur Klinische Medizin. 39 (1), 42-48 (1867).
- Connorton, J. M., Jones, E. R., Rodriguez-Ramiro, I., Fairweather-Tait, S., Uauy, C., Balk, J. Altering expression of a vacuolar iron transporter doubles iron content in white wheat flour. bioRxiv. , 1-25 (2017).
- de la Fuente, V., Rufo, L., Rodríguez, N., Franco, A., Amils, R. Comparison of iron localization in wild plants and hydroponic cultures of Imperata cylindrica (L.) P. Beauv. Plant Soil. 418 (1-2), 25-35 (2017).
- Hsiao, P. Y., Cheng, C. P., Koh, K. W., Chan, M. T. The Arabidopsis defensin gene, AtPDF1.1, mediates defence against Pectobacterium carotovorum subsp. carotovorum via an iron-withholding defence system. Science Reports. 7 (1), 1-14 (2017).
- Johnson, D. B., Kanao, T., Hedrich, S. Redox transformations of iron at extremely low pH: Fundamental and applied aspects. Frontiers in Microbiology. 3, 1-13 (2012).
- Stumm, W., Lee, G. F. Oxygenation of ferrous iron. Industrial & Engineering Chemistry. 53 (2), 143-146 (1961).
- Jones, A. M., Griffin, P. J., Collins, R. N., Waite, T. D. Ferrous iron oxidation under acidic conditions – The effect of ferric oxide surfaces. Geochimica et Cosmochimica Acta. 145, 1-12 (2014).
- Hawkesworth, C. J., Kemp, A. I. S. Evolution of the continental crust. Nature. 443 (7113), (2006).
- Thompson, L. M., Louis, M., Troeh, F. R., Thompson, L. M. . Soils and soil fertility. , (1973).
- Krueger, B. J., Grassian, V. H., Cowin, J. P., Laskin, A. Heterogeneous chemistry of individual mineral dust particles from different dust source regions: The importance of particle mineralogy. Atmospheric Environment. 38 (36), 6253-6261 (2004).
- Bewick, V., Cheek, L., Ball, J. Statistics review 7: Correlation and regression. Journal of Critical Care. 7 (6), 451-459 (2003).
- Asuero, A. G., Sayago, A., González, A. G. The correlation coefficient: An overview. Critical Reviews in Analytical Chemistry. 36 (1), 41-59 (2006).
- . Analytical Chemistry. Calibration Curves Available from: https://www.jove.com/science-education/10188/calibration-curves (2018)

