Immagine-Guida di resezione del Glioblastoma e l'impianto intracranico di terapeutica delle cellule staminali-seminato ponteggi
Summary
Alla ricerca di tumore terapeutiche cellule staminali mesenchimali (MSCs) mostrano la promessa come trattamento per glioblastoma dilagante. Trapianto ottimo coinvolge consegna delle MSC in cavità di resezione del tumore su ponteggi. Qui, preclinici tecniche per studiare il trattamento del MSC di glioblastoma sono forniti tra cui: resezione del tumore immagine-guida; impianto di scaffold MSC-seminato; e terapia postoperatoria di rilevamento.
Abstract
Glioblastoma (GBM), il tumore cerebrale primario più comune e più aggressivo, trasporta un’aspettativa di vita di 12-15 mesi. La breve aspettativa di vita è dovuto in parte all’incapacità del trattamento attuale, che consiste della resezione chirurgica seguita da radioterapia e chemioterapia, per eliminare i focolai di tumore invasivo. Trattamento di questi focolai può essere migliorato con tumoricidal umano cellule staminali mesenchimali (MSCs). MSCs esibiscono tropismo potente del tumore e possono essere ingegnerizzate per esprimere terapeutiche proteine che uccidono le cellule del tumore. Avanzamenti in modelli preclinici indicano che la resezione chirurgica induce la perdita prematura di MSC e riduce l’efficacia terapeutica. Efficacia del trattamento del MSC può essere migliorata da semina MSCs su un’impalcatura biodegradabile poly(lactic acid) (PLA). Consegna MSC nella cavità di resezione chirurgica su un’impalcatura PLA Ripristina di uccisione del tumore, la persistenza e la conservazione delle cellule. Per studiare gli effetti dell’impianto di PLA MSC-seminato il GBM, è necessario un accurato modello preclinico. Qui forniamo un protocollo chirurgico preclinico per resezione del tumore di immagine-Guida di GBM in topi immune-carenti ha seguito da impianto di impalcatura MSC-seminato. MSCs sono progettati con costrutti lentivirali costitutivamente esprimere e secernono terapeutico TNFα-correlati apoptosis-inducing ligand (TRAIL), come pure la proteina fluorescente verde (GFP) per consentire la registrazione fluorescente. Allo stesso modo, le cellule del tumore U87 sono progettate per espresso mCherry e luciferasi di lucciola, fornendo dual fluorescente/luminescenti di rilevamento. Mentre attualmente utilizzato per lo studio di cellule staminali mediate consegna di terapeutica, questo protocollo potrebbe essere modificato per studiare l’impatto della resezione chirurgica sugli altri interventi GBM.
Introduction
Glioblastoma (GBM) è il tumore cerebrale primario più comune negli adulti, con una misera sopravvivenza mediana di soli 12-15 mesi1,2,3,4,5. Sopravvivenza non è significativamente migliorata poiché 2005 quando l’attuale standard clinici di massima resezione chirurgica seguita da radioterapia e chemioterapia temozolomide concomitante e adiuvante è stato adottato6,7. Mentre questo trattamento fornisce ai pazienti un sollievo temporaneo dei sintomi, standard di trattamento cura risultati invariabilmente in ricorrenza come fuochi del cancro invasivo eludere la resezione e sono protetti dalle terapie sistemiche da emato – encefalica (BBB). Strategie i focolai di tumore invasivo di destinazione mentre eludere la BBB sono urgentemente necessarie per guadagnare trazione contro questa malattia debilitante e aggressiva.
Cellule staminali mesenchimali (MSCs) mostrano la promessa come droga veicoli di consegna per GBM a causa del loro tumore nativo tropismo8,9. MSCs possiedono i ricevitori per e migrare verso fattori solubili che tumori secernono, compreso 1 α fattore derivato da cellule stromali (SDF-1 α), matrix metalloproteinase-1 (MMP-1) e monocyte chemoattractant protein-1 (MCP-1) tra gli altri10, 11 , 12 , 13. ingegneria MSCs per esprimere e secernono farmaci citotossici permette loro di essere sfruttato come veicoli di consegna di droga tumore-homing. MSCs derivati dal muoversi verso i fuochi del tumore invasivo e fornire proteine terapeutiche. Questo approccio ha dimostrato la fattibilità in una varietà di preclinici GBM modelli9,14. Tuttavia, la maggior parte di questi modelli non includono la resezione chirurgica nonostante la rilevanza clinica di questo componente. Emergendo studi utilizzando nuovi modelli di resezione ha rivelato che la rimozione chirurgica del tumore riduce la persistenza di cellule staminali che vengono iniettate direttamente nella cavità chirurgica15. Perdita di attuabilità ha provocato ridotta efficacia, probabilmente a causa di diminuzioni nella dose e la durata del farmaco consegnato ai fuochi del tumore invasivo.
Per aumentare la vitalità delle cellule staminali e drug delivery, MSCs possono essere seminate su impalcature prima dell’impianto. In questo protocollo, biocompatibili e riassorbibili elettrofilate nanofibrous poly(lactic acid) (PLA) viene utilizzato come ponteggio per MSCs. PLA si flette e si adatta alla forma della cavità di resezione al momento dell’impianto, che massimizza la copertura terapeutica e riduce al minimo il distanza MSCs deve percorrere per raggiungere le cellule del tumore. MSCs rimangono sul patibolo durante l’impianto e quindi migrare fuori il patibolo verso le cellule del tumore dopo l’impianto16,17. MSCs e i farmaci citotossici che trasportano quindi si accumulano i focolai di tumore. Consegna della droga citotossica al tumore richiede MSC vitalità e persistenza, entrambi i quali sono aiutati da impianto su ponteggi.
In questa procedura vengono utilizzati vettori lentivirali di indurre l’espressione stabile di (fluorescentein vitro di rilevamento) e bioluminescenti (in vivo di rilevamento) marcatori nelle linee di cancro e di cellule staminali. La linea GBM umana U87 è infettata di mCherry e firefly luciferase (U87 mCh-Fl) e il MSCs non terapeutico con GFP e renilla luciferasi (MSC GFP-Rluc). La variante terapeutica delle MSC express TNFα-correlati apoptosis inducing ligand (MSC-TRAIL). SENTIERO, una proteina secernuta costitutivamente, associa a nelle vicinanze di recettori di morte sul cancro cellule e avvia gli apoptosi caspase-mediati18.
Qui, forniamo un protocollo per resezione chirurgica GBM preclinica immagine-guida e l’impianto di scaffold MSC-seminato. In breve, i topi nudi sono dato un craniotomy seguito tre giorni dopo da iniezione stereotactic ortotopico di U87 mCh-Fl per stabilire il tumore primario. Il tumore engrafted cresce per un periodo di circa una settimana. Impalcature PLA sono seminate con MSCs 48h prima dell’intervento chirurgico di resezione. Il tumore è quindi resecato sotto guida fluorescente e l’impalcatura MSC-caricato viene impiantato nella cavità di resezione. Sopravvivenza di onere e mouse di tumore sono quindi monitorati postoperatorio con bioluminescenza imaging (BLI). Una sequenza temporale di queste procedure è fornita qui sotto (Figura 1).
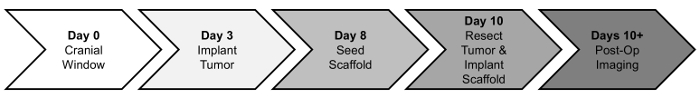
Figura 1: sequenza temporale delle procedure. Topi inizialmente ricevano una finestra cranica (giorno 0). Dopo un periodo di recupero di tre giorni, i tumori sono impiantati (giorno 3) e crescere per circa una settimana. Impalcature sono seminate con MSCs (giorno 8) due giorni in anticipo la procedura di resezione e l’impianto del tumore (giorno 10). Progressione del tumore ed efficacia terapeutica vengono valutati tramite post-operatorio in seguito di imaging (giorno 10 +). Clicca qui per visualizzare una versione più grande di questa figura.
Protocol
Representative Results
Discussion
Chirurgia in genere può essere completata entro 30 min per topo, dato che i punti seguenti sono presi in considerazione per massimizzare la precisione ed evitare insidie che richiede tempo. Innanzitutto, assicurarsi che il mouse è posizionato correttamente nello strumento stereotassica prima di iniziare la procedura. Movimenti indesiderati della testa limiterà la precisione chirurgica del craniotomy, Ubicazione dell’impianto del tumore e del livello di resezione del tumore. Prima di resezione, rimuovere completamente …
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
Gli autori riconoscono contributi editoriali da Dr. Kathryn Pietrosimone. Impalcature PLA sono stati prodotti da laboratorio del Dr. Elizabeth Loboa alla North Carolina State University. Questo lavoro è stato supportato dal Università Cancer Research Fund dell’UNC Lineberger Comprehensive Cancer Center e UNC traslazionale e clinica Sciences Institute (KL2TR001109, UL1TR001111).
Materials
| Just for mouse stereotaxic instrument | Stoelting | 51730 | Maintains steady head positioning during surgery |
| Fluorescence dissecting stereomicroscope | Leica | M165 FC | Allows real-time imaging of tumor during resection |
| Motorized integrated stereotaxic injector (ISI) system | Stoelting | 53315 | Allows precise tumor cell injection volume and rate |
| Vetbond tissue adhesive | 3M | 1469 | Sugical glue to close skin wound |
| Artificial tears | Akorn | 664268 | Prevents eyes from drying during surgery |
| Webcol alcohol preps | Covidien | 6818 | Sterilize incision site |
| Betadine surgical scrub | Purdue Fredick Company | 6761815117 | Sterilize incision site |
| Cotton-tipped applicators | Fisherbrand | 23-400-115 | Surgery tool |
| E-vac aspirating system | Argos | EV310 | Vacuum pump used to resect tumor |
| Fibrinogen and thrombin extracted from as-received TISSEEL | Baxter | To temporarily secure the scaffold in the resection cavity | |
| IVIS Kinetic in vivo optical imaging system | Caliper Life Science | Bioluminescent Imager | |
| D-Luciferin potassium salt | PerkinElmer | 122799 | In vivo imaging agent |
Riferimenti
- Adamson, C., et al. Glioblastoma multiforme: a review of where we have been and where we are going. Expert opinion on investigational drugs. 18 (8), 1061-1083 (2009).
- Asthagiri, A. R., Pouratian, N., Sherman, J., Ahmed, G., Shaffrey, M. E. Advances in Brain Tumor Surgery. Neurologic Clinics. 25 (4), 975-1003 (2007).
- Affronti, M., et al. Overall survival of newly diagnosed glioblastoma patients receiving carmustine wafers followed by radiation and concurrent temozolomide plus rotational multiagent chemotherapy. Cancer. 115 (15), 3501-3511 (2009).
- Erpolat, O., Akmansu, M., Goksel, F., Bora, H., Yaman, E., Büyükberber, S. Outcome of newly diagnosed glioblastoma patients treated by radiotherapy plus concomitant and adjuvant temozolomide: a long-term analysis. Tumori. 95 (2), 191-197 (2009).
- Minniti, G., et al. Radiotherapy plus concomitant and adjuvant temozolomide for glioblastoma in elderly patients. Journal of Neuro-Oncology. 88 (1), 97-103 (2008).
- Stupp, R., et al. Radiotherapy plus concomitant and adjuvant temozolomide for glioblastoma. The New England Journal of Medicine. 352 (10), 987-996 (2005).
- Delgado-López, P., Corrales-García, E. Survival in glioblastoma: a review on the impact of treatment modalities. Clinical and Translational Oncology. 18 (11), 1062-1071 (2016).
- Wu, X., et al. In vivo tracking of superparamagnetic iron oxide nanoparticle-labeled mesenchymal stem cell tropism to malignant gliomas using magnetic resonance imaging. Laboratory investigation. Journal of Neurosurgery. 108 (2), 320-329 (2008).
- Nakamizo, A., et al. Human bone marrow-derived mesenchymal stem cells in the treatment of gliomas. Ricerca sul cancro. 65 (8), 3307-3318 (2005).
- Xu, F., Shi, J., Yu, B., Ni, W., Wu, X., Gu, Z. Chemokines mediate mesenchymal stem cell migration toward gliomas in vitro. Oncology Reports. 23 (6), 1561-1567 (2010).
- Park, S., et al. CXCR4-transfected human umbilical cord blood-derived mesenchymal stem cells exhibit enhanced migratory capacity toward gliomas. International Journal of Oncology. 38 (1), 97-103 (2011).
- Ho, I., et al. Matrix Metalloproteinase 1 Is Necessary for the Migration of Human Bone Marrow-Derived Mesenchymal Stem Cells Toward Human Glioma. STEM CELLS. 27 (6), 1366-1375 (2009).
- Bexell, D., Svensson, A., Bengzon, J. Stem cell-based therapy for malignant glioma. Cancer Treatment Reviews. 39 (4), (2012).
- Nouri, F., Wang, X., Hatefi, A. Genetically engineered theranostic mesenchymal stem cells for the evaluation of the anticancer efficacy of enzyme/prodrug systems. Journal of Controlled Release. 200, 179-187 (2015).
- Kauer, T., Figueiredo, J. -. L., Hingtgen, S., Shah, K. Encapsulated therapeutic stem cells implanted in the tumor resection cavity induce cell death in gliomas. Nature Neuroscience. 15 (2), 197-204 (2011).
- Bagó, J., Pegna, G., Okolie, O., Hingtgen, S. Fibrin matrices enhance the transplant and efficacy of cytotoxic stem cell therapy for post-surgical cancer. Biomaterials. 84, 42-53 (2016).
- Bagó, J., Pegna, G., Okolie, O., Mohiti-Asli, M., Loboa, E., Hingtgen, S. Electrospun nanofibrous scaffolds increase the efficacy of stem cell-mediated therapy of surgically resected glioblastoma. Biomaterials. 90, 116-125 (2016).
- Loebinger, M., Eddaoudi, A., Davies, D., Janes, S. Mesenchymal Stem Cell Delivery of TRAIL Can Eliminate Metastatic Cancer. Ricerca sul cancro. 69 (10), 4134-4142 (2009).
- Mostany, R., Portera-Cailliau, C. A Craniotomy Surgery Procedure for Chronic Brain Imaging. J. Vis. Exp. (12), e680 (2008).
- Ozawa, T., James, C. D. Establishing Intracranial Brain Tumor Xenografts With Subsequent Analysis of Tumor Growth and Response to Therapy using Bioluminescence Imaging. J. Vis. Exp. (41), e1986 (2010).

