Microscopia spettrale riflettometrica su assoni Myelinated In Situ
Summary
Qui, presentiamo un protocollo passo-passo per l’imaging di assoni myelinated in una fetta di cervello fisso utilizzando una scala nanometrica privo di etichetta tecnica basato su riflettometria spettrale di imaging.
Abstract
In un sistema nervoso dei mammiferi, mielina fornisce un isolamento elettrico da avviluppando le fibre dell’assone in una spirale multistrata. Ispirato dalla sua architettura subcellulare altamente organizzato, abbiamo recentemente sviluppato una nuova modalità di imaging, denominata riflettometria spettrale (isotropi), che permette l’imaging senza precedenti su scala nanometrica privo di etichetta degli assoni myelinated live in situ. Il principio di fondo è quello di ottenere informazioni nanostrutturale analizzando lo spettro di riflettanza della struttura subcellulare multistrato. In questo articolo, descriviamo un protocollo dettagliato passo-passo per l’esecuzione di un imaging di SpeRe base dei tessuti nervosi utilizzando un sistema al microscopio confocale commerciale, dotato di un laser a luce bianca e un filtro sintonizzabile. Copriamo le procedure di preparazione del campione, acquisizione di dati spettrali e di elaborazione delle immagini per ottenere informazioni nanostrutturale.
Introduction
Nel sistema nervoso dei mammiferi, mielina fornisce integrità assonale e conduzione nervosa rapida avviluppando le fibre dell’assone con guaine membranose multistrate. La sua struttura multistrato è composto da alternando film sottili su scala nanometrica composto da membrane plasmatiche (~ 5 nm), cytosol (~ 3 nm) e spazi extracellulari (7 ~ nm)1,2. Microscopia ottica, compreso il recente microscopia di Super-risoluzione, non sono adatti per l’osservazione delle dinamiche di mielina su scala nanometrica a causa della loro risoluzione insufficiente a causa della diffrazione ottica3,4,5. Sebbene la microscopia elettronica può fornire dettagli della nanostruttura mielina, non è compatibile con i sistemi biologici viventi a causa della preparazione del campione altamente invasive che coinvolgono la fissazione chimica e ultrasectioning6,7 . Fino a poco tempo, c’ non è stata nessuna tecnica applicabile per osservare la dinamica su scala nanometrica di assoni myelinated in situ.
Schain et al ha segnalato in precedenza che gli assoni myelinated esibiscono la riflessione della luce colorata8. Adottando l’analisi spettroscopica sulla luce riflessa, abbiamo messo a punto una nuova modalità di imaging per l’imaging su scala nanometrica di assoni myelinated, denominata riflettometria spettrale (isotropi)9. Bullonerie si basa sull’interferenza di film sottile che si verificano nella struttura multistrata della guaina mielinica (Figura 1). Di simulazione ottica su vari assoni, abbiamo rivelato che lo spettro di riflettanza è una funzione periodica del numero d’onda e la sua periodicità (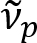 ) è inversamente proporzionale al diametro dell’assone (d). Questa semplice relazione (
) è inversamente proporzionale al diametro dell’assone (d). Questa semplice relazione (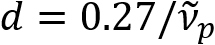 ) offre facile quantificazione del diametro dell’assone dai dati isotropi. Utilizzando questo, abbiamo rivelato l’assone prevalente sporgenti sotto la ferita traumatica delicata del cervello nella nostra precedente relazione.
) offre facile quantificazione del diametro dell’assone dai dati isotropi. Utilizzando questo, abbiamo rivelato l’assone prevalente sporgenti sotto la ferita traumatica delicata del cervello nella nostra precedente relazione.
Il sistema di SpeRe si basa su microscopia confocal e consiste di una sorgente laser specializzate e filtri (Figura 2). La sorgente di ingresso è un laser a luce bianca, fornendo a banda larga output spettrale visibile alle regioni a infrarossi. Per l’analisi spettrale, il sistema è dotato di due dispositivi acusto-ottico: un filtro sintonizzabile acusto-ottico (AOTF) per la distribuzione una lunghezza d’onda selezionata la sorgente di ingresso a banda larga e un divisore di fascio acusto-ottico (AOBS) per guidare il selezionato riflette lunghezza d’onda al rivelatore. Il software per microscopia confocale iperspettrale (Vedi Tabella materiali) offre un’opzione di analisi spettrale personalizzabile di acquisire in sequenza le immagini di riflettanza a varie lunghezze d’onda di input. Inoltre, l’aberrazione cromatica criticamente possono interferire nella misurazione spettrale; Pertanto, l’uso di un obiettivo apocromatico è raccomandato.
Della nota, bianco-luce laser produce un output spettrale irregolare e i componenti ottici influiscono anche sul profilo spettrale. Di conseguenza, gli spettri acquisiti devono essere calibrate per la successiva analisi quantitativa. Uno specchio d’argento protetto viene in genere utilizzato come riferimento, che fornisce un grado di riflessione quasi costante (> 97%) sopra la regione piena e visibile. Gli spettri acquisiti sono poi diviso per gli spettri di riferimento dallo specchio.
Le dimensioni di passaggio spettrale per l’analisi spettrale determinano la velocità di acquisizione; così, ha bisogno di essere ottimizzato. Come un assone più grande ha un maggiore periodo spettrale, richiede più fine spettrale campionamento. Ad esempio, un assone con un diametro di 10 µm, uno dei più grandi assoni fisiologici, ha un periodo spettrale di ~ 8 nm. Applicando criteri di campionamento di Nyquist, abbiamo impiegato l’intervallo di campionamento spettrale di 4 nm a coprire tutti gli assoni fisiologici nei tessuti nervosi del mouse. Questo approccio assume in genere alcuni secondi per una scansione completa spettrale e pertanto non è adatto per applicazioni in vivo , dove il movimento fisiologico (ad es. respirazione e battito cardiaco) interferisce stabile acquisizione spettrale. In precedenza abbiamo risolto questo problema tramite la strumentazione di un microscopio dritto su misura, progettato per acquisire l’intero spettro per ogni punto utilizzando uno spettrometro di matrice (acquisizione velocità ≈ 30 ms per ogni pixel).
In questo rapporto, descriviamo un protocollo dettagliato sull’imaging di SpeRe su una fetta di cervello fisso, che può essere eseguita in un microscopio commerciale iperspettrale (Vedi Tabella materiali). Così, il protocollo può essere completato da sperimentatori senza esperienza nella strumentazione ottica. Copriamo anche i potenziali problemi e risoluzione dei problemi per acquisizione e analisi dei dati di Bullonerie.
Protocol
Representative Results
Discussion
Bullonerie è una nuova modalità imaging privo di etichetta basata su interferometria spettrale, che per la prima volta, offre le informazioni su scala nanometrica in assoni myelinated dal vivo. L’attuale protocollo di acquisizione, la risoluzione spaziale per il diametro dell’assone è dell’ordine di 10 nm. Inoltre, SpeRe utilizza gli ordini di grandezza più bassa dose di luce rispetto ad altri microscopie di Super-risoluzione; così, è esente da fototossicità e photobleaching. Bullonerie fornirebbe una nuova strada…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
Questo lavoro è stato supportato dall’Istituto di scienze fondamentali (IBS-R015-D1) e dal programma di base scienza ricerca attraverso la nazionale Ricerca Fondazione della Corea (NRF) finanziato dal Ministero dell’istruzione (2017R1A6A1A03015642).
Materials
| Glass cutter | – | – | Can be purchased in a local convenience store or online stores. |
| Nail polish | – | – | Can be purchased in a local convenience store or online stores. |
| Apochromat objective 40×, NA 1.1 | Leica Microsystems | 15506357 | Water-immersion type |
| Fluoromyelin Green | Thermo Fisher | F34651 | Alternatively, Fluoromyelin Red (F34652) can be used. |
| Leica SP8 TCS microscope | Leica Microsystems | SP8 | Refer to the "Configuration of microscope" in Introduction Section for details. |
| Imaging software | Leica Microsystems | LAS-X | – |
| Matlab | MathWorks | – | – |
| Mirror | Thorlabs | PF10-03-P01 | Coated with protected silver. |
| Phosphate-buffered saline (PBS) | Life technologies | 14190-136 | – |
| Paraformaldehyde | Biosolution | BP031a | 4% v/v in PBS |
| Cover slip | Thermo Fisher | 3306 | Thickness: #1 (0.13 to 0.17 mm) |
| Slide glass | Muto Pure Chemicals | 5116-20F | Thickness: ~1 mm |
| Super glue | Henkel | Loctite 406 | Use a dispensing equipment to avoid skin or eye contact. |
| Syringe pump | Brainetree Scientific | BS-8000 DUAL | – |
| Vibratome | Leica Biosystems | VT1200S | – |
| White-light laser | NKT photonics | EXB-6 | EXB-6 was discontinued and replaced by EXU-6. |
Riferimenti
- Fernandez-Moran, H., Finean, J. B. Electron microscope and low-angle x-ray diffraction studies of the nerve myelin sheath. Journal of Cell Biology. 3, (1957).
- Blaurock, A. E. The spaces between membrane bilayers within PNS myelin as characterized by X-ray diffraction. Brain Research. 210, 383-387 (1981).
- Shim, S. -. H., et al. Super-resolution fluorescence imaging of organelles in live cells with photoswitchable membrane probes. Proceedings of the National Academy of Sciences. , 13978-13983 (2012).
- Urban, N. T., Willig, K. I., Hell, S. W., Nägerl, U. V. STED nanoscopy of actin dynamics in synapses deep inside living brain slices. Biophysics Journal. 101, 1277-1284 (2011).
- Manley, S., et al. High-density mapping of single-molecule trajectories with photoactivated localization microscopy. Nature Methods. 5, 155-157 (2008).
- Peters, A., Sethares, C. Is there remyelination during aging of the primate central nervous system?. Journal of Comparative Neurology. 460, 238-254 (2003).
- De Campos Vidal, B., Silveira Mello, M. L., Caseiro-Filho, A. C., Godo, C. Anisotropic properties of the myelin sheath. Acta Histochemica. 66, 32-39 (1980).
- Schain, A. J., Hill, R. A., Grutzendler, J. Label-free in vivo imaging of myelinated axons in health and disease with spectral confocal reflectance microscopy. Nature Medicine. 20, 443-449 (2014).
- Kwon, J., et al. Label-free nanoscale optical metrology on myelinated axons in vivo. Nature Communication. 8, 1832 (2017).
- Gage, G. J., Kipke, D. R., Shain, W. Whole Animal Perfusion Fixation for Rodents. JoVE. (65), e3564 (2012).
- Segev, A., Garcia-Oscos, F., Kourrich, S. Whole-cell Patch-clamp Recordings in Brain Slices. JoVE. (112), e54024 (2016).
- Waldchen, S., Lehmann, J., Klein, T., Van De Linde, S., Sauer, M. Light-induced cell damage in live-cell super-resolution microscopy. Scientific Reports. 5, 15348 (2015).
- Chang, J. B., et al. Iterative expansion microscopy. Nature Methods. 14, 593-599 (2017).
- Polishchuk, R. S., et al. Correlative light-electron microscopy reveals the tubular-saccular ultrastructure of carriers operating between Golgi apparatus and plasma membrane. Journal of Cell Biology. 148, 45-58 (2000).

