Identifisering og isolering av Oligopotent og avstamning forpliktet myelogen Progenitors fra musen benmarg
Summary
Vi viser hvordan å identifisere og isolere 6 delsett av myelogen progenitors fra murine benmarg bruker en kombinasjon av magnetiske og fluorescens sortering (Mac og FACS). Denne protokollen kan brukes i vitro kultur analyser (methylcellulose eller væske kulturer), i vivo adoptivforeldre overføring eksperimenter og RNA/protein analyser.
Abstract
Myeloid progenitors som gir nøytrofile og monocytter dendrittiske celler (DCs) kan identifiseres i og isolert fra benmargen av mus for Hematologisk og immunologiske analyser. For eksempel kan studier av mobilnettet og molekylære egenskapene myeloid progenitor befolkninger avsløre mekanismene bak leukemic transformasjon, eller vise hvordan immunsystem reagerer på patogen eksponering. Tidligere beskrevet flyt cytometri strategier for myeloid progenitor identifikasjon har aktivert betydelige fremskritt på mange felt, men fraksjoner de identifiserer er svært uensartet. De vanligste gating strategiene definere benmarg brøker som er beriket for ønsket befolkningen, men også inneholde store mengder “forurensende” progenitors. Våre studier har løst mye av denne heterogenitet, og protokollen vi presenterer her tillater isolering av 6 subpopulasjoner av oligopotent og avstamning forpliktet myelogen progenitors 2 beskrevet tidligere benmarg fraksjoner. Protokollen beskriver 3 faser: 1) isolering av bein margtransplantasjon celler, 2) berikelse for blodkreft progenitors av magnetiske-aktivert celle sortering (avstamning uttømming av Mac) og 3) identifikasjon av myeloid progenitor delsett av flowcytometri (inkludert fluorescens-aktivert celle sortering, FACS, om ønskelig). Denne tilnærmingen tillater stamfar kvantifisering og isolasjon for en rekke i vitro og i vivo , og har allerede gitt romanen innsikt stier og mekanismer av nøytrofile, monocyte og DC differensiering.
Introduction
Monocytter og nøytrofile dendrittiske celler (DCs) er myeloide celler som oppstår fra blodkreft progenitors, hovedsakelig i benmargen, ved en prosess kalt myelopoiesis. Vanlige myelogen progenitors (CMPs) har muligheten å tilvirke myeloide celler, samt megakaryocytes og erytrocytter, men ikke lymfoide celler. Granulocytt-monocytt progenitors (GMPs), som er avledet fra CMPs, produserer granulocytter og monocytter, men har mistet megakaryocyte og røde blodlegemer potensielle. Monocytter og klassisk og presenterer antigener DCs (cDCs/PDC) er også tenkt å oppstå fra vanlige progenitors kalles monocytt-DC progenitors (MDPs), som er produsert av CMPs. gradvis begrensning avstamning potensial til slutt resulterer i avstamning forpliktet progenitors: granulocytt progenitors og monocytt progenitors dendrittiske celle progenitors (figur 1).
Weissman og kolleger rapporterte at CMPs er funnet i Lin– c-Kit+ Sca-1– (LKS–) CD34+ FcγRlo brøkdel av musen benmargen, mens GMPs finnes i LKS– -CD34+ FcγR Hei del1. Men er disse “CMP” og “GMP” fraksjoner svært uensartet. For eksempel inneholder “GMP” delen også avstamning forpliktet granulocytt progenitors og monocytt progenitors1,2. MDPs separat rapportert å være CX3CR1+ Flt3+ CD115+ progenitors som uttrykker også CD34 og FcγR3,4. MDPs gi opphav til cDC/pDC-produserende felles DC progenitors (CDPs), som har blitt rapportert å uttrykke lavere nivåer av c-Kit (CD117) og er ikke inkludert i LKS– brøkdel5.
Det var tidligere antatt at monocytter oppstå via en enkelt sti (CMP-GMP-MDP-monocytt). Samsvar med denne modell, monocyte forpliktet progenitors produsert av GMPs (heter monocyte progenitors, MPs)2 og MDPs (kalt felles monocytt progenitors, cMoPs)6 synes å være de samme cellene på grunnlag av delte overflaten markør uttrykk . Men vi nylig vist at monocytter produseres uavhengig av GMPs og MDPs, og kunne skille mellom MPs og cMoPs av encellede RNA sekvensering7.
Vi har nylig endret Weissman “CMP” og “GMP” gating strategi for å identifisere 6 subfractions av C57BL/6J musen benmarg som inneholder forskjellige oligopotent og avstamning forpliktet myeloid progenitor delsett. Vi først rapportert at flekker for Ly6C og CD115 tillater isolering av oligopotent GMPs, samt granulocytt progenitors (GPs) og monocytt progenitors (MPs og cMoPs, som vi ikke skille) fra “GMP” del2 (LKS – CD34+ FcγRHei gate; Figur 1). Vi senere viste at MDPs er hovedsakelig funnet i “CMP” fraksjonen (LKS– CD34+ FcγRlo gate), som også inneholder Flt3+ CD115lo og Flt3– delsett7 (figur 1 ). CMP-Flt3+ CD115lo brøkdel gir både GMPs og MDPs ved adopsjon overføring. CMP-Flt3– delsettet inneholder progenitors som synes å være mellomprodukter mellom CMP-Flt3+ CD115lo celler og GMPs. I motsetning til MDPs har både CMP-Flt3+ CD115lo og CMP-Flt3– brøker megakaryocyte og røde blodlegemer potensielle.
Det er viktig å merke seg at det er foreløpig uklart om “CMP” fraksjoner inneholder progenitors som virkelig oligopotent (f.eks enkeltceller i CMP-Flt3+ CD115lo brøkdel har nøytrofile, monocytt, DC, megakaryocyte og røde blodlegemer potensielle), eller eventuelt består av en blanding av progenitors med mer begrenset avstamning potensial. Kolonien danner analyser (methylcellulose kulturer) avslørte celler med granulocytt (nøytrofile), røde blodlegemer, monocyte og megakaryocyte potensielle (GEMM celler) i “CMP”, CMP-Flt3+ CD115lo og CMP-Flt3– fraksjoner1 ,7, men tillater ikke vurdering av DC potensial. Derimot kolonien danner analyser viste eksistensen av oligopotent GMPs (progenitors med både nøytrofile og monocytt potensielle) i “GMP” brøkdel1,2, og dette er støttet av siste encellede transcriptomic analyse8. Det kjent ikke er, men om disse oligopotent GMPs produserer også andre granulocytter (eosinofile, basofile og mastceller).
Basert på disse studiene har vi nå viser kan hvordan 7 overflate markører (c-utstyr, Sca-1, CD34, FcγR, Flt3, Ly6C og CD115) brukes til å identifisere og isolere disse 6 delsett av oligopotent og avstamning forpliktet myelogen progenitors. Protokollen beskrevet her kan brukes for i vitro kultur analyser (methylcellulose eller flytende kulturer), i vivo adoptivforeldre overføring eksperimenter i mus og molekylære analyse (bulk og encellede RNA sekvensering, vestlige blotting, etc.).
Protokollen består av 3 faser: 1) utarbeidelse av en enkelt celle suspensjon av bein margtransplantasjon celler, 2) berikelse blodkreft progenitors (magnetisk-aktivert celle sortering), og 3) identifisering og isolering eventuelt av stamfar undergrupper av flyt cytometri (med en analyserer eller sortering, avhengig). Det første trinnet er isolering av bein margtransplantasjon celler fra femurs og tibias av euthanized mus og ligner andre beskrevet tidligere protokoller9. Deretter er prøven beriket for stammen og stamfar celler ved hjelp av en cocktail av antistoffer mot celle overflate markører erytrocytter, nøytrofile, monocytter, lymfocytter, etc., til deplete differensierte celler. Dette er ikke obligatorisk, men anbefales sterkt å optimalisere oppdagelsen stamfar delsettene og redusere mengden av antistoffer nødvendig for stamfar identifikasjon og tiden som kreves for flowcytometri. Avstamning uttømming protokollen nedenfor beskriver Magnetic-Activated celle sortering (Mac) bruker en mus avstamning celle uttømming Kit (som inneholder biotinylated antistoffer mot CD5, CD45R (B220), CD11b, Gr-1 (Ly6G/C), 7-4 og Ter-119, pluss anti-biotin microbeads) og en automatisert magnetiske skilletegnet. Det siste trinnet er identifikasjonen (og sortering, hvis ønskelig) stamfar delsettene av flowcytometri. Antistoff panelet beskrevet nedenfor (se tabell 1) er utformet for å brukes i en flyt cytometer (analyzer eller sorter) med 4 lasere (405 nm, 488 nm, 561 nm, 640 nm).
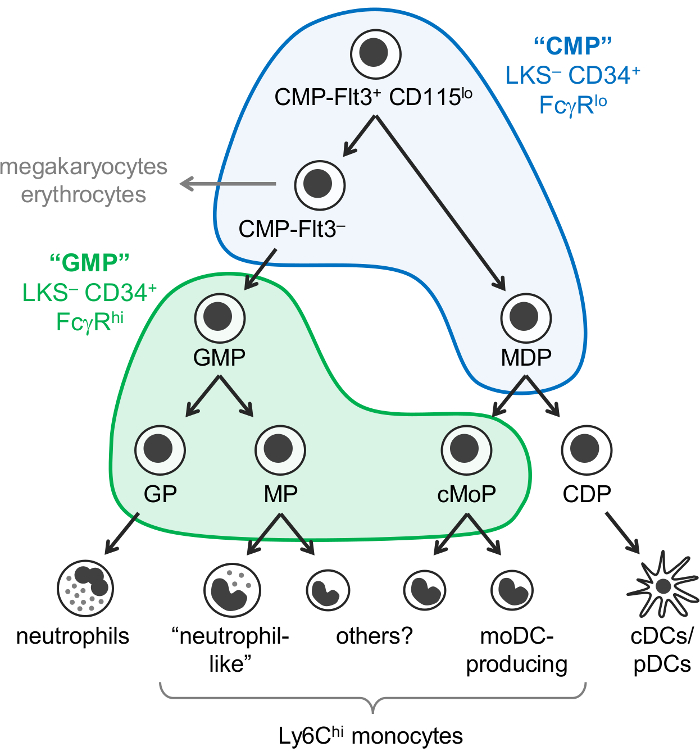
Figur 1: nøytrofile, monocyte og DC progenitors og differensiering trasé. Nylig revidert modell av myelopoiesis7 er illustrert med Weissman portene for “CMPs” (blå) og “GMPs” (grønn)1 kledde. Dette tallet er endret fra Yanez et al. 20177. Klikk her for å se en større versjon av dette tallet.
Protocol
Representative Results
Discussion
Weissman gating strategi for musen myeloid progenitor identifikasjon1 har vært gullstandarden for immunologists og hematologists i nesten 20 år, men det er nå klart at “CMP” og “GMP” portene er svært heterogen og mer presis gating strategier er nødvendig. Protokollen som vi har beskrevet her tillater identifisering av oligopotent og avstamning forpliktet delsett i C57BL/6J mus for mer presise kvantifisering av bestemte myelogen progenitors og kartlegging av myelopoiesis, samt undersøkelse av…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
Denne protokollen ble utviklet ved hjelp av midler fra styret i guvernører regenerativ medisin Institute ved Cedars-Sinai Medical Center (til HSG), en karriere innen immunologi fellesskap fra den amerikanske foreningen Immunologists (til AY og HSG) og en Scholar Award fra American Society for hematologi (å Ja). Vi takker Flow cytometri kjernen ved Cedars-Sinai Medical Center for hjelp med FACS sortering.
Materials
| Mouse: Wild-type C57BL/6J (CD45.2) | The Jackson Laboratories | Cat#JAX:000664 | |
| Lineage Cell Depletion Kit, mouse | Miltenyi Biotec | Cat#130-090-858 | |
| Rat anti-mouse CD34 (clone RAM34) FITC | BD Biosciences | Cat#553733 | |
| Rat anti-mouse CD16/CD32 (FcγR; clone 93) APC-Cy7 | BioLegend | Cat#101327 | |
| Rat anti-mouse Ly6A/E (Sca-1; clone 108113) PE-Cy7 | BioLegend | Cat#108114 | |
| Rat anti-mouse CD117 (c-Kit; clone 2B8) Pacific Blue | BioLegend | Cat#105820 | |
| Rat anti-mouse Ly6C (clone HK1.4) PerCP-Cy5.5 | BioLegend | Cat#128012 | |
| Rat anti-mouse CD115 (clone AFS98) PE | BioLegend | Cat#135506 | |
| Rat anti-mouse CD135 (Flt3; clone A2F10.1) APC | BD Biosciences | Cat#560718 | |
| CountBright Absolute Counting Beads | Thermo Fisher Scientific | Cat#C36950 | |
| AutoMACS Separator | Miltenyi Biotec | N/A | Use the "deplete" program |
| BD LSRFortessa | BD Biosciences | N/A | 5 lasers, 15 colors |
| BD FACS Aria III cell sorter | BD Biosciences | N/A | 5 lasers, 13 colors |
| FlowJo | FlowJo, LLC | https://www.flowjo.com | For further analysis of the .fcs files |
Riferimenti
- Akashi, K., Traver, D., Miyamoto, T., Weissman, I. L. A clonogenic common myeloid progenitor that gives rise to all myeloid lineages. Nature. 404 (6774), 193-197 (2000).
- Yáñez, A., Ng, M. Y., Hassanzadeh-Kiabi, N., Goodridge, H. S. IRF8 acts in lineage-committed rather than oligopotent progenitors to control neutrophil vs monocyte production. Blood. 125 (9), 1452-1459 (2015).
- Auffray, C., et al. CX3CR1+ CD115+ CD135+ common macrophage/DC precursors and the role of CX3CR1 in their response to inflammation. Journal of Experimental Medicine. 206 (3), 595-606 (2009).
- Fogg, D. K., et al. A clonogenic bone marrow progenitor specific for macrophages and dendritic cells. Science. 311 (5757), 83-87 (2006).
- Onai, N., et al. Identification of clonogenic common Flt3+M-CSFR+ plasmacytoid and conventional dendritic cell progenitors in mouse bone marrow. Nature Immunology. 8 (11), 1207-1216 (2007).
- Hettinger, J., et al. Origin of monocytes and macrophages in a committed progenitor. Nature Immunology. 14 (8), 821-830 (2013).
- Yáñez, A., et al. Granulocyte-monocyte progenitors and monocyte-dendritic cell progenitors independently produce functionally distinct monocytes. Immunity. 47 (5), 890-902 (2017).
- Olsson, A., et al. Single-cell analysis of mixed-lineage states leading to a binary cell fate choice. Nature. 537 (7622), 698-702 (2016).
- Amend, S. R., Valkenburg, K. C., Pienta, K. J. Murine hind limb long bone dissection and bone marrow isolation. Journal of Visualized Experiments. (110), (2016).
- Yáñez, A., Goodridge, H. S. Interferon regulatory factor 8 and the regulation of neutrophil, monocyte, and dendritic cell production. Current Opinion in Hematology. 23 (1), 11-17 (2016).
- Manz, M. G., Miyamoto, T., Akashi, K., Weissman, I. L. Prospective isolation of human clonogenic common myeloid progenitors. Proceedings of the National Academy of Sciences of the United States of America. 99 (18), 11872-11877 (2002).

