Kimlik ve yalıtım Oligopotent ve Lineage için kabul edilen miyeloid ataları fare kemik iliği dan
Summary
Biz nasıl tanımlanmasını ve yalıtılmasını miyeloid ataları fare kemik iliği bir manyetik kombinasyonu ve floresan (MAC’ler ve FACS) sıralama kullanarak üzerinden 6 alt kümelerini göstermek. Bu iletişim kuralı vitro kültürü deneyleri (methylcellulose ya da sıvı kültürleri), in vivo evlat edinen transfer deneyler ve RNA/protein analizleri için kullanılabilir.
Abstract
Nötrofiller, monosit ve dendritik hücreler (DC) verim miyeloid ataları tespit ve hematolojik ve immünolojik analizleri farelerin kemik iliği dan izole. Örneğin, uygulama miyeloid progenitör nüfus hücresel ve moleküler özelliklerinin lösemik dönüştürme altında yatan mekanizmaları ortaya veya patojen maruz bağışıklık sistemin nasıl yanıt vereceğini gösterir. Daha önce açıklanan akış sitometresi stratejileri miyeloid progenitör tanımlama için birçok alanda önemli gelişmeler etkinleştirdim, ancak onlar tespit kesirler çok heterojen bulunmaktadır. En sık kullanılan gating stratejileri için istenen nüfus zenginleştirilmiş, ama aynı zamanda “bulaşıcı” ataları çok sayıda içeren kemik iliği kesirler tanımlayın. Bizim son yıllarda yapılan çalışmalarda bu heterojenlik çoğunu çözmüş ve ruhsatı burada mevcut protokol oligopotent 6 altgrupları yalıtım ve soy için kabul edilen miyeloid ataları 2 daha önce kemik iliği kesirler açıklanan. 3 kademeli protokolünü açıklar: 1) yalıtım kemik iliği hücreleri, hematopoetik ataları tarafından manyetik aktif hücre (soy tükenmesi MAC’ler tarafından) sıralama ve 3) akış sitometresi (dahil tarafından miyeloid progenitör alt kümeleri tanımlaması için zenginleştirme 2) floresans aktif hücre), sıralama FACS, isterseniz. Bu yaklaşım progenitör miktar ve yalıtım uygulamaları içinde in vitro ve in vivo çeşitli için izin verir ve zaten yolları ve nötrofil ve monosit DC farklılaşma mekanizmalarının içine roman fikir vermiştir.
Introduction
Monosit, nötrofil ve dendritik hücreler (DC) esas olarak kemik iliği hematopoetik ataları myelopoiesis adı verilen bir işlem tarafından ortaya miyeloid hücrelerdir. Ortak miyeloid ataları (CMPs) myeloid hücrelerin yanı sıra megakaryocytes ve eritrositler ama değil lenfoid hücre üretmek potansiyeline sahip. CMPs türetilmiştir, granülosit-monosit ataları (GMPs), granülosit ve monosit üretmek, ama megakaryocyte ve eritrosit potansiyel kaybettik. Monosit ve klasik ve plazmasitoid DCs (KGK/PDC’ler) da ortak ataları CMPs. kademeli kısıtlama lineage potansiyel sonuçta sonuçları lineage kaydedilmiş tarafından üretilen monosit-DC ataları (MDP’ler) olarak bilinen kaynaklanan için düşündüm ataları: granülosit ataları, monosit ataları ve dendritik hücre ataları (Şekil 1).
Weissman ve meslektaşları bildirdi CMPs Lin– c-Kit ile+ ani kalp durması-1– (LKS–) CD34 bulunur+ FcγRlo kısmını fare kemik iliği GMPs LKS– CD34 yer alır iken,+ FcγR Merhaba Kesir1. Ancak, bu “Cumhuriyetçi millet partisi” ve “GMP” kesirler çok heterojen bulunmaktadır. Örneğin, “GMP” kesir Ayrıca lineage için kabul edilen granülosit ataları ve monosit ataları1,2içerir. MDP’ler ayrı ayrı CX3CR1 olmak rapor+ Flt3+ CD115+ da CD34 ve FcγR3,4ifade ataları. MDP’ler ortaya çıkmasına neden olan c-Kit (CD117) düzeyi düşük hızlı bildirilmiştir cDC/pDC-üreten ortak DC ataları için (CDP) ve LKS– Kesir5dahil değil.
Monosit bir tek yol (CMP-GMP-MDP-monosit) yolu ile ortaya daha önce kabul edildi. (Monosit ataları, MPs adlı) GMPs tarafından üretilen bu model, monosit olarak kaydedilmiş ataları ile tutarlı2 ve MDP’ler (ortak monosit ataları, cMoPs adlı)6 gibi görünüyor aynı hücre temelinde paylaşılan yüzey marker ifade . Ancak, biz son zamanlarda monosit bağımsız olarak GMPs ve MDP’ler tarafından üretilmektedir gösterdi ve MPs ve cMoPs tek hücreli RNA sıralama7tarafından ayırt başardık.
Weissman “Cumhuriyetçi millet partisi” ve “GMP” perdeleme strateji C57BL/6J fare kemik iliği farklı oligopotent ve myeloid progenitör lineage için kabul edilen alt kümeleri içeren 6 subfractions tanımlamak için değiştirilen. Biz ilk Ly6C ve CD115 boyama oligopotent GMPs, hem de granülosit ataları (GPs) ve monosit ataları (MPs ve ayırmak Şu anda açamayacaklar cMoPs) yalıtım izin verir rapor “GMP” Kesir2 (LKS – CD34+ FcγRMerhaba kapısı; Şekil 1). Daha sonra MDP’ler ağırlıklı olarak “CMP” kesir bulundu gösterdi (LKS– CD34+ FcγRlo kapısı), ayrıca Flt3 içeren+ CD115lo ve Flt3– alt kümeleri7 (resim 1 ). CMP Flt3+ CD115lo kesir GMPs ve MDP’ler evlatlık transfer verimleri. Cumhuriyetçi millet partisi-Flt3– alt CMP-Flt3+ CD115lo hücreler ve GMPs arasındaki ara ürün olarak görünmesini ataları içerir. MDP’ler farklı olarak, hem Cumhuriyetçi millet partisi-Flt3+ CD115lo ve Cumhuriyetçi millet partisi-Flt3– kesirler de megakaryocyte ve eritrosit potansiyel bulunmamaktadır.
Ancak, ister gerçekten oligopotent (nötrofil, sahipÖrneğin, tek tek hücreleri içinde CMP Flt3+ CD115lo kesir vardır ataları “CMP” kesirler içeren şu anda belirsiz olduğuna dikkat etmek önemlidir monosit, DC, megakaryocyte ve eritrosit potansiyel), veya alternatif olarak, CSF’den daha sınırlı lineage potansiyeli olan karışımı kapsayabilir. Deneyleri (methylcellulose kültürleri) oluşturan colony CMP-Flt3+ CD115lo ve Cumhuriyetçi millet partisi-Flt3– kesirler1 hücreler granülosit (nötrofil), eritrosit, monosit ve megakaryocyte potansiyel (et hücreleri) “CMP”, içinde olduğu ortaya çıktı ,7, ama DC potansiyeli değerlendirmesi izin vermez. Buna ek olarak, deneyleri oluşturan colony “GMP” Kesir1,2oligopotent GMPs (nötrofil ve monosit potansiyel ile ataları) varlığını gösterdi ve bu son tek hücre tarafından desteklenmektedir transcriptomic analiz8. Bu oligopotent GMPs da diğer granülosit (eozinofil, bazofil ve mast hücreleri) üretmek olup olmadığını şu anda, ancak, bilinmemektedir.
Bu çalışmalar, biz şimdi göstermek dayalı nasıl 7 işaretleri (c-Kit, ani kalp durması-1, CD34, FcγR, Flt3, Ly6C ve CD115) yüzey tanımlanmasını ve yalıtılmasını oligopotent ve soy için kabul edilen miyeloid ataları 6 Bu alt kümeleri kullanılabilir. Burada açıklanan protokol vitro kültürü deneyleri (kültür) methylcellulose ya da sıvı, uygulanabilir vivo içinde evlat edinen transfer deneylerde fare ve moleküler analiz (toplu ve tek hücreli RNA sıralama, Western blot, vb).
İletişim kuralı 3 etap oluşur: 1) hazırlanması bir tek hücre süspansiyon kemik iliği hücreleri, 2) zenginleştirme hematopoetik ataları (manyetik aktif hücre sıralama) ve 3) tanıma ve istenirse progenitör alt kümeleri akımını, yalıtım sitometresi (bir çözümleyici veya bir sıralayıcısı uygun şekilde kullanarak). İlk adım kalça kemik iliği hücre izolasyon ve ötenazi farelerin yırtılmalarıteşhis ve diğer yukarıda açıklanan protokoller9‘ a benzer. Daha sonra örnek farklılaşmış hücreler tüketmek için bir kokteyl hücre yüzey işaretleyicileri, eritrositler, nötrofiller, monosit, lenfositler, vb karşı antikorların kullanarak kök ve progenitör hücreler için zenginleştirilmiştir. Bu, ancak önerilir hafiye-in yaratıcı alt kümelerini en iyi duruma getirme ve progenitör kimlik için gerekli antikor ve akış sitometresi için gereken süre miktarını azaltmak için zorunlu değildir. Soy tükenmesi iletişim kuralı aşağıdaki Magnetic-Activated hücre sıralama (Mac) bir fare Lineage hücre tükenmesi Kit kullanarak açıklar (CD5, CD45R karşı biotinylated antikor içeren (B220), CD11b, Gr-1 (Ly6G/C), 7-4 ve Ter-119, artı Anti-biotin lastikteki) ve otomatik bir manyetik ayırıcı. Son adım tanımlamasıdır (ve sıralama, istenirse) akış sitometresi tarafından progenitör alt kümeleri olan. Aşağıda açıklanan antikor paneli (Ayrıca bkz: Tablo 1) bir akış sitometresi (Analyzer’ı veya Sıralayıcı) 4 lazerler ile kullanılmak üzere tasarlanmıştır (405 nm, 488 nm, 561 nm, 640 nm).
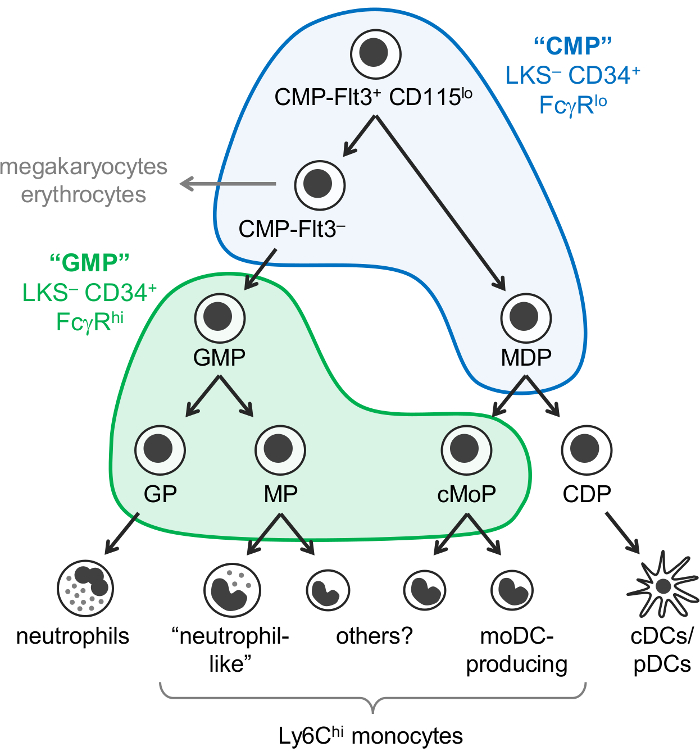
Şekil 1: nötrofil, monosit ve DC ataları ve ayırt etme yolları. Myelopoiesis7 ‘ nin son zamanlarda gözden geçirilmiş modeli “CMPs” (mavi) ve “GMPs” (yeşil)1 overlaid Weissman gates ile gösterilmektedir. Bu rakam Yáñez vd 20177‘ den değiştirildi. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
Protocol
Representative Results
Discussion
Fare miyeloid progenitör kimlik1 için strateji çoğunluğuna Weissman immunologists için altın standart ve hematologlar yaklaşık 20 yıl olmuştur, ama şimdi “Cumhuriyetçi millet partisi” ve “GMP” kapıları çok heterojen ve daha kesin belirgin Perdeleme stratejileri ihtiyaç vardır. Burada tarif var Protokolü oligopotent ve soy için kabul edilen alt kümeleri belirli miyeloid CSF’den daha kesin miktar ve eşleme myelopoiesis yollar, hem de incelenmesi için C57BL/6J farelerde izin ve…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
Bu iletişim kuralı bir Amerikan Immunologists Derneği (için AY ve HSG) İmmünoloji dostluk kariyer ve bilim adamı Ödülü’bir para yönetim kurulu, Vali Rejeneratif Tıp Enstitüsü Cedars-Sinai Tıp Merkezi (HSG), kullanılarak geliştirilen Hematoloji (AY için) American Society. Akış Sitometresi çekirdek Cedars-Sinai Tıp Merkezi FACS sıralama ile yardım için teşekkür.
Materials
| Mouse: Wild-type C57BL/6J (CD45.2) | The Jackson Laboratories | Cat#JAX:000664 | |
| Lineage Cell Depletion Kit, mouse | Miltenyi Biotec | Cat#130-090-858 | |
| Rat anti-mouse CD34 (clone RAM34) FITC | BD Biosciences | Cat#553733 | |
| Rat anti-mouse CD16/CD32 (FcγR; clone 93) APC-Cy7 | BioLegend | Cat#101327 | |
| Rat anti-mouse Ly6A/E (Sca-1; clone 108113) PE-Cy7 | BioLegend | Cat#108114 | |
| Rat anti-mouse CD117 (c-Kit; clone 2B8) Pacific Blue | BioLegend | Cat#105820 | |
| Rat anti-mouse Ly6C (clone HK1.4) PerCP-Cy5.5 | BioLegend | Cat#128012 | |
| Rat anti-mouse CD115 (clone AFS98) PE | BioLegend | Cat#135506 | |
| Rat anti-mouse CD135 (Flt3; clone A2F10.1) APC | BD Biosciences | Cat#560718 | |
| CountBright Absolute Counting Beads | Thermo Fisher Scientific | Cat#C36950 | |
| AutoMACS Separator | Miltenyi Biotec | N/A | Use the "deplete" program |
| BD LSRFortessa | BD Biosciences | N/A | 5 lasers, 15 colors |
| BD FACS Aria III cell sorter | BD Biosciences | N/A | 5 lasers, 13 colors |
| FlowJo | FlowJo, LLC | https://www.flowjo.com | For further analysis of the .fcs files |
Riferimenti
- Akashi, K., Traver, D., Miyamoto, T., Weissman, I. L. A clonogenic common myeloid progenitor that gives rise to all myeloid lineages. Nature. 404 (6774), 193-197 (2000).
- Yáñez, A., Ng, M. Y., Hassanzadeh-Kiabi, N., Goodridge, H. S. IRF8 acts in lineage-committed rather than oligopotent progenitors to control neutrophil vs monocyte production. Blood. 125 (9), 1452-1459 (2015).
- Auffray, C., et al. CX3CR1+ CD115+ CD135+ common macrophage/DC precursors and the role of CX3CR1 in their response to inflammation. Journal of Experimental Medicine. 206 (3), 595-606 (2009).
- Fogg, D. K., et al. A clonogenic bone marrow progenitor specific for macrophages and dendritic cells. Science. 311 (5757), 83-87 (2006).
- Onai, N., et al. Identification of clonogenic common Flt3+M-CSFR+ plasmacytoid and conventional dendritic cell progenitors in mouse bone marrow. Nature Immunology. 8 (11), 1207-1216 (2007).
- Hettinger, J., et al. Origin of monocytes and macrophages in a committed progenitor. Nature Immunology. 14 (8), 821-830 (2013).
- Yáñez, A., et al. Granulocyte-monocyte progenitors and monocyte-dendritic cell progenitors independently produce functionally distinct monocytes. Immunity. 47 (5), 890-902 (2017).
- Olsson, A., et al. Single-cell analysis of mixed-lineage states leading to a binary cell fate choice. Nature. 537 (7622), 698-702 (2016).
- Amend, S. R., Valkenburg, K. C., Pienta, K. J. Murine hind limb long bone dissection and bone marrow isolation. Journal of Visualized Experiments. (110), (2016).
- Yáñez, A., Goodridge, H. S. Interferon regulatory factor 8 and the regulation of neutrophil, monocyte, and dendritic cell production. Current Opinion in Hematology. 23 (1), 11-17 (2016).
- Manz, M. G., Miyamoto, T., Akashi, K., Weissman, I. L. Prospective isolation of human clonogenic common myeloid progenitors. Proceedings of the National Academy of Sciences of the United States of America. 99 (18), 11872-11877 (2002).

