Subtype-specifieke optische actiepotentiaal opnamen in mens geïnduceerde pluripotente stamcel afkomstige ventriculaire Cardiomyocytes
Summary
Hier presenteren we een methode om optisch beeld actie potentieel, specifiek in ventriculaire-achtige geïnduceerde pluripotente stamcel afkomstige cardiomyocytes. De methode is gebaseerd op de promotor-gedreven uitdrukking van een spanning-gevoelige fluorescent proteïne.
Abstract
Cardiomyocytes gegenereerd op basis van menselijke geïnduceerde pluripotente stamcellen (iPSC-CMs) zijn een opkomende hulpmiddel bij cardiovasculair onderzoek. In plaats van een homogene bevolking van cellen, de iPSC-CMs gegenereerd door huidige differentiatie protocollen vertegenwoordigen een mengsel van cellen met ventriculaire-, atriale-, en knooppunten-achtige fenotypen, die compliceert fenotypische analyses. Hier, wordt een methode om optisch record actie potentials specifiek van ventriculaire-achtige iPSC-CMs gepresenteerd. Dit wordt bereikt door lentivirale transductie met een constructie waarin een genetisch-gecodeerde voltage-indicator onder de controle van een ventriculaire-specifieke promotor-element is. Wanneer iPSC-CMs zijn getransduceerde met deze constructie, wordt de voltage-sensor uitgedrukt uitsluitend in ventriculaire-achtige cellen, waardoor potentiële opnames subtype-specifieke optische membraan met behulp van time-lapse fluorescentie microscopie.
Introduction
Cardiomyocytes (CMs) afgeleid van geïnduceerde pluripotente stamcellen (iPSCs) zijn een opkomende hulpmiddel om te ontleden van moleculaire mechanismen van hart-en vaatziekten, onderzoeken van nieuwe therapieën, en scherm voor bijwerkingen van geneesmiddelen cardiale effecten1,2 ,3. Vanaf het begin zijn arrhythmogenic ziekten zoals channelopathies een belangrijk aandachtspunt van dit onderzoek gebied4. Daarom zijn de methoden te onderzoeken elektrische fenotypes van CMs, zoals hartritmestoornissen of veranderingen in actiepotentiaal (AP) morphologies, in het hart van deze technologie.
Een belangrijke overweging bij de toepassing van iPSC-CMs is dat huidige cardiale differentiatie protocollen niet leiden een homogene bevolking van cellen tot. Integendeel, ze zijn eerder een mengsel van cellen die lijkt op de sinusknoop, atriale, en ventriculaire CMs op verschillende niveaus van rijping5,,6,,7,8. Deze heterogeniteit kunnen een relevante bron van experimentele variabiliteit, vooral als parameters zoals AP duur (APD) worden onderzocht, die intrinsiek verschillen tussen CM subtypen (bijvoorbeeldde APD is korter in atriale dan in ventriculaire CMs). De conventionele aanpak van dit probleem is te onderzoeken enkele iPSC-CMs met behulp van de methode van de klem patch en classificeren van elke cel als knooppunten-, atriale-, of ventriculaire-achtige, gebaseerd op de AP morfologie9. Een latere analyse kan vervolgens worden beperkt tot de cellen vertegenwoordigt het CM-subtype van belang. Het grote nadeel van deze strategie is de beperkte gegevensdoorvoer en de afwezigheid van schaalbaarheid. Het invasieve karakter van patch klem electrofysiologie staat bovendien geen de beeldvorming van dezelfde cellen sequentieel over langere tijd.
Wij bieden hier, experimentele details op een10 van de methode ontwikkeld om het beeld optisch APs in specifieke subtypen van iPSC-CMs. Dit overwint het probleem van de subtype heterogeniteit en drastisch verhoogt de doorvoer in vergelijking met conventionele methoden, zodat de snelle fenotypering voor iPSC-CMs uitvoering van genetische varianten of worden blootgesteld aan farmacologische agenten.
Overzicht van de subtype-specifieke optische beeldvorming aanpak
Een genetisch-gecodeerde voltage indicator (GEVI), waarvan fluorescentie-eigenschappen op de depolarisatie en repolarisatie van de celmembraan wijzigen, wordt gebruikt om het beeld optisch veranderingen van het membraanpotentiaal van CMs. De hier toegepast GEVI is de spanning detecterende fluorescent proteïne VSFP-CR11, die uit een spanning-sensing transmembraan domein gesmolten aan een combinatie van een groene (klaver) en een rode (mRuby2) TL proteïne (figuur 1A bestaat). Als gevolg van de nabijheid van de twee fluorophores, de excitatie van de groen fluorescente proteïne in een fractie van de energie van de excitatie worden overgebracht naar de rode fluorescerende eiwit via Förster resonance energy transfer (FRET) resultaten. Daarom is de excitatie van de groen fluorescente proteïne resulteert in een emissie van zowel de groene en de rode fluorescerende eiwitten (figuur 1A, bovenste deelvenster). Wanneer de cel depolarizes, een structurele omlegging van de voltage-sensor gebeurt dat vertaalt zich in een heroriëntering van de twee fluorescente proteïnen, verhoging van de efficiëntie van de FRET. Dus wordt nog meer van de excitatie-energie overgebracht van het groen aan de rode fluorescente proteïne (figuur 1A, lagere paneel). Dientengevolge, in een depolarized cel, de uitstoot van groene fluorescentie is minder scherp, en de rode fluorescentie-emissie is helderder dan in een cel in rust membraanpotentiaal (figuur 1B).
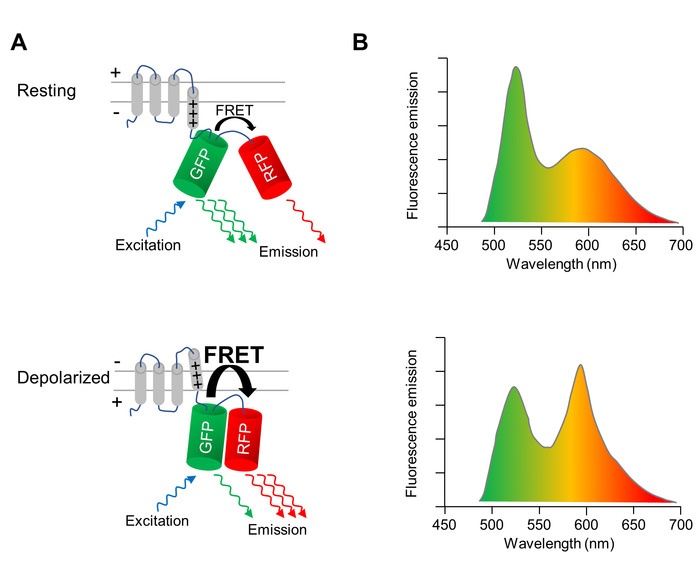
Figuur 1: optische beeldvorming van de membraanpotentiaal met VSFP-CR. (A) A schematische voorstelling afgebeeld van de actie van de spanning-gevoelige fluorescent proteïne DIE VSFP-CR wordt weergegeven. Bij de depolarisatie van de celmembraan, een structurele herschikking in het spanning-sensing transmembraan domein vertaalt zich in een heroriëntering van de groene (GFP) en rode (RFP) TL proteïne, verhoging van de efficiëntie van de intramoleculaire Förster resonance energy transfer (FRET). (B) de emissie spectra van een VSFP op de excitatie van de GFP in cellen bij de rustpotentiaal membraan (bovenste deelvenster) en depolarized cellen (lagere paneel) worden afgebeeld. De spectrale verandering op depolarisatie is overdreven voor de duidelijkheid. Klik hier voor een grotere versie van dit cijfer.
De veranderingen in de efficiëntie van de FRET spiegeling van de schommelingen van de membraanpotentiaal zijn beeld met behulp van een fluorescentie Microscoop voorzien van een afbeelding splitter, die scheidt van de rode en groene fluorescentie emissies en projecteert ze op twee aangrenzende gebieden van de chip van een sCMOS camera (Figuur 2). Met deze set-up, kan de emissie van de fluorescentie bij twee verschillende golflengte bands opgenomen worden gelijktijdig, waardoor de berekening van een ratio van rood-tot-groen fluorescentie na te denken van de membraanpotentiaal in elk beeld van een time-lapse serie.
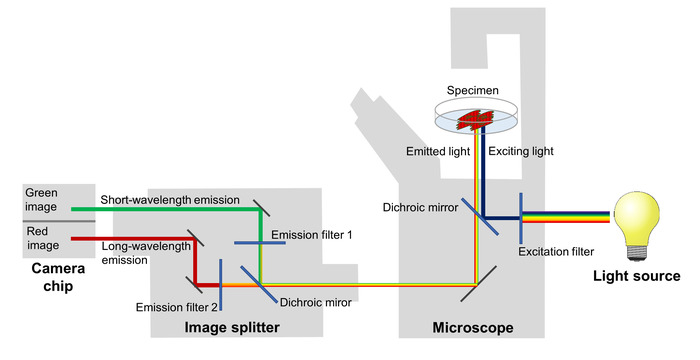
Figuur 2: configuratie van het imaging systeem. De belangrijkste componenten van de imaging systeem gebruikt om te afbeelding de spectrale veranderingen van de spanning-gevoelige fluorescent proteïne spiegeling van de mogelijke wijzigingen van de membraan met een hoge temporele resolutie worden afgebeeld. Klik hier voor een grotere versie van dit cijfer.
De expressie van VSFP-CR in CMs wordt bereikt door lentivirale transductie. Directe uitdrukking aan het CM-subtype van belang, heeft de lentivirus een promotor element (de MLC2v -enhancer) die specifiek transcriptie in ventriculaire-achtige iPSC-CMs10 drijftbevat. Wanneer de iPSC-CMs waarmee een mengsel van cellen atriale-achtige, knooppunten-achtige en ventriculaire-achtige zijn getransduceerde met deze lentivirus, uit VSFP-CR zich alleen in de ventriculaire-achtige cellen. Aangezien de actiepotentiaal optische beeldvorming, hangt af van deze TL sensor, vertegenwoordigen de opgenomen actie potentials uitsluitend het CM-subtype van belang (Figuur 3).
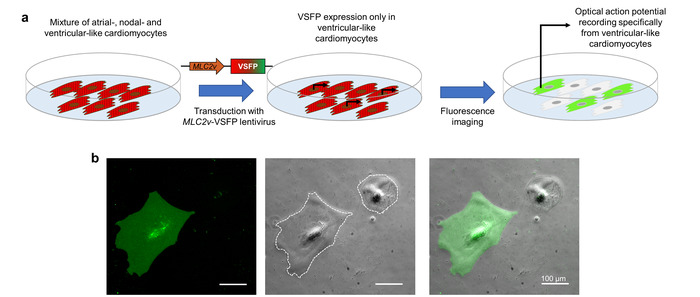
Figuur 3: promotor-gedreven VSFP uitdrukking voor de potentiële imaging subtype-specifieke membraan. (een) dit schema toont hoe cardiomyocyte subtype-specifieke optische actiepotentiaal opnamen worden bereikt. (b) iPSC-CMs besmet met een VSFP onder de controle van de ventriculaire-specifieke MLC2v-enhancer worden weergegeven. De expressie van de voltage-sensor wordt waargenomen alleen in ventriculaire-achtige CMs in het GFP-kanaal (linkerdeel). De fase contrast (middelste deelvenster) en het overlaybeeld (rechtervenster) zijn ook aanwezig. De witte stippellijnen mark celbegrenzing. Klik hier voor een grotere versie van dit cijfer.
Protocol
Representative Results
Discussion
De hier beschreven methode kunt een optische recording van APs van een specifiek subtype (d.w.z., ventriculaire-achtige cellen) van CMs gegenereerd op basis van menselijke iPSCs. Menselijke iPSC-CMs een opkomende instrument om een grote verscheidenheid aan biologische en medische problemen, en de differentiatie naar verschillende subtypen van CM is een belangrijke bron van experimentele variabiliteit. Met behulp van specifieke promotor elementen, wordt de expressie van een GEVI specifiek bereikt in CMs die het s…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
Dit werk werd gesteund door subsidies uit de Duitse Research Foundation (Si 1747/1-1), het anders Kröner-Fresenius-Stiftung en de Deutsche Stiftung für Herzforschung.
Materials
| ß-Mercaptoethanol | Invitrogen | 21985023 | |
| DMEM-F12 Medium | Invitrogen | 21331046 | |
| FBS(Fetal Bovine Serum) | Invitrogen | 16141079 | |
| MEM Non-Essential Amino Acids | Invitrogen | 11140050 | |
| GlutaMax-I Supplement | Invitrogen | 35050061 | alternative L-Glutamine |
| Penicillin-Streptomycin | Invitrogen | 15140122 | |
| Fibronectin bovine plasma | Sigma-Aldrich | F1141 | |
| Collagenase type II | Worthington Biochem | LS004174 | |
| Hexadimethrine Bromide (Polybrene) | Sigma-Aldrich | H9268 | enhancing lentiviral infection |
| 3.5 cm glass-bottom microdishes | MatTek corporation, Ashland, MA, USA | P35G-1.5-14-C | |
| Microscope stand | Leica Microsystems, Wetzlar, Germany | DMI6000B | |
| Microscope objective | Leica Microsystems, Wetzlar, Germany | HCX PL APO 63x/1.4-0.6 Oil | |
| sCMOS camera | Andor Technology, Belfast, UK | Zyla V | |
| Microscope filter cube: excitation filter | Chroma Technology Corp, Bellows Falls, VT, USA | ET480/40X | bandpass 480/40 |
| Microscope filter cube: dichroic mirror | Chroma Technology Corp, Bellows Falls, VT, USA | T505lpxr | longpass 505 nm |
| Image splitter | Cairn Research, Faversham, UK | OptoSplit II | |
| Image splitter filter cube: dichroic mirror | AHF Analysentechnik GmbH, Tübigen, Germany | 568LPXR | longpass 568 nm |
| Image splitter filter cube: emission filter 1 (GFP emission) | AHF Analysentechnik GmbH, Tübigen, Germany | 520/28 BrightLine HC | bandpass 520/28 nm |
| Image splitter filter cube: emission filter 2 (RFP emission) | AHF Analysentechnik GmbH, Tübigen, Germany | 630/75 ET Bandpass | bandpass 630/75 nm |
| Pacing inset | Warner Instruments, Hamden, CT, USA | RC-37FS | |
Riferimenti
- Sinnecker, D., Laugwitz, K. L., Moretti, A. Induced pluripotent stem cell-derived cardiomyocytes for drug development and toxicity testing. Pharmacology & Therapeutics. 143 (2), 246-252 (2014).
- Goedel, A., My, I., Sinnecker, D., Moretti, A. Perspectives and Challenges of Pluripotent Stem Cells in Cardiac Arrhythmia Research. Current Cardiology Reports. 19 (3), 23 (2017).
- Rocchetti, M., et al. Elucidating arrhythmogenic mechanisms of long-QT syndrome CALM1-F142L mutation in patient-specific induced pluripotent stem cell-derived cardiomyocytes. Cardiovascular Research. 113 (5), 531-541 (2017).
- Sinnecker, D., et al. Modeling long-QT syndromes with iPS cells. Journal of Cardiovascular Translational Research. 6 (1), 31-36 (2013).
- Talkhabi, M., Aghdami, N., Baharvand, H. Human cardiomyocyte generation from pluripotent stem cells: A state-of-art. Life Sciences. , 98-113 (2016).
- Ben-Ari, M., et al. Developmental changes in electrophysiological characteristics of human-induced pluripotent stem cell-derived cardiomyocytes. Heart Rhythm. 13 (12), 2379-2387 (2016).
- Den Hartogh, S. C., Passier, R. Concise Review: Fluorescent Reporters in Human Pluripotent Stem Cells: Contributions to Cardiac Differentiation and Their Applications in Cardiac Disease and Toxicity. Stem Cells. 34 (1), 13-26 (2016).
- Schweizer, P. A., et al. Subtype-specific differentiation of cardiac pacemaker cell clusters from human induced pluripotent stem cells. Stem Cell Research & Therapy. 8 (1), 229 (2017).
- Moretti, A., et al. Patient-specific induced pluripotent stem-cell models for long-QT syndrome. The New England Journal of Medicine. 363 (15), 1397-1409 (2010).
- Chen, Z., et al. Subtype-specific promoter-driven action potential imaging for precise disease modelling and drug testing in hiPSC-derived cardiomyocytes. European Heart Journal. 38 (4), 292-301 (2017).
- Lam, A. J., et al. Improving FRET dynamic range with bright green and red fluorescent proteins. Nature Methods. 9 (10), 1005-1012 (2012).
- Chen, G., et al. Chemically defined conditions for human iPSC derivation and culture. Nature Methods. 8 (5), 424-429 (2011).
- Burridge, P. W., et al. Chemically defined generation of human cardiomyocytes. Nature Methods. 11 (8), 855-860 (2014).
- Bhattacharya, S., et al. High efficiency differentiation of human pluripotent stem cells to cardiomyocytes and characterization by flow cytometry. Journal of Visualized Experiments. (91), e52010 (2014).
- Wang, X., McManus, M. Lentivirus production. Journal of Visualized Experiments. (32), e1499 (2009).
- Schneider, C. A., Rasband, W. S., Eliceiri, K. W. NIH Image to ImageJ: 25 years of image analysis. Nature Methods. 9 (7), 671-675 (2012).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Jung, C. B., et al. Dantrolene rescues arrhythmogenic RYR2 defect in a patient-specific stem cell model of catecholaminergic polymorphic ventricular tachycardia. EMBO Molecular Medicine. 4 (3), 180-191 (2012).
- Lemoine, M. D., et al. Human iPSC-derived cardiomyocytes cultured in 3D engineered heart tissue show physiological upstroke velocity and sodium current density. Scientific Reports. 7, 5464 (2017).
- Dorn, T., et al. Direct nkx2-5 transcriptional repression of isl1 controls cardiomyocyte subtype identity. Stem Cells. 33 (4), 1113-1129 (2015).
- Kaestner, L., et al. Genetically Encoded Voltage Indicators in Circulation Research. International Journal of Molecular Sciences. 16 (9), 21626-21642 (2015).

