Plasmid di DNA ad alto throughput e trasfezione utilizzando la tecnologia di nanoedispensing acustico
Summary
Questo protocollo descrive la trasflessazione di plasmide ad alto rendimento delle cellule dei mammiferi in una piastra di 384 pozzetto che utilizza la tecnologia di espulsione acustica delle goccioline. L’erogazione e il multiplexing del DNA, che richiedono molto tempo e richiedono errori, ma anche il reagente di trasfezione, sono basati su software ed eseguiti da un dispositivo nanodispenser. Le cellule vengono poi semiate in questi pozzi precompilati.
Abstract
La trasfezione cellulare, indispensabile per molti studi biologici, richiede il controllo di molti parametri per un risultato accurato e di successo. Il più delle volte eseguita a bassa velocità effettiva, è inoltre dispendiosa in termini di tempo e soggetto a errori, ancora di più quando si multiplano diversi plasmidi. Abbiamo sviluppato un metodo semplice, veloce e preciso per eseguire la trasfezione cellulare in un layout a piastre a 384 pozze utilizzando la tecnologia di espulsione acustica delle goccioline (ADE). Il dispositivo nanodispenser utilizzato in questo studio si basa su questa tecnologia e consente la consegna precisa di nanovolume ad alta velocità da una piastra di pozzo di origine a una di destinazione. Può erogare e multispensare il DNA e il reagente di trasfezione secondo un foglio di calcolo pre-progettato. Qui presentiamo un protocollo ottimale per eseguire la trasfezione ad alta velocità basata su ADE che consente di raggiungere un’efficienza fino al 90% e una cotransfezione quasi al 100% negli esperimenti di cotransfezione. Estendiamo il lavoro iniziale proponendo una macro basata su fogli di calcolo user-friendly, in grado di gestire fino a quattro plasmidi/pozzi da una libreria contenente fino a 1.536 diversi plasmidi e un’applicazione di guida al pipettaggio basata su tablet. La macro progetta i modelli necessari delle lastre di origine e genera i file pronti all’uso per il nanodispenser e l’applicazione basata su tablet. Il protocollo di trasfezione a quattro fasi coinvolge i) un dispense diluente con un gestore di liquidi classico, ii) distribuzione del plasmide e multiplexing, iii) un reagente di trasfezione erosi dal nanodispense, e iv) placcatura cellulare sui pozzi precompilati. Il controllo basato su software descritto di ADE plasmide multiplexing e trasfezione consente anche ai non specialisti del settore di eseguire una trasfezione cellulare affidabile in modo rapido e sicuro. Questo metodo consente di ottenere rapidamente l’identificazione delle impostazioni ottimali per un determinato tipo di cellula e può essere trasposto in approcci manuali e su scala più elevata. Il protocollo facilita le applicazioni, come la proteina UMANA ORFeome (insieme di frame di lettura aperti [ORF] in un genoma) espressione o la convalida della funzione genica basata su CRISPR-Cas9, in strategie di screening non di pool.
Introduction
Il metodo qui presentato descrive in dettaglio come eseguire il plasmide del DNA e la trasfezione nelle cellule dei mammiferi ad alta produttività utilizzando un nanodispenser liquido a base acustica in una piastra di 384 pozze, anche per i non specialisti del settore. Questo metodopubblicato di recente 1 permette di eseguire fino a 384 condizioni indipendenti di multiplexing e trasfezione del DNA plasmide in un esperimento, in meno di 1 h. Gli esperimenti di cotrafezione o singolo hanno avuto successo, raggiungendo un quasi 100% cotrafezione all’interno della popolazione di cellule trasfette. Questo protocollo semplifica la trasfezione perché la maggior parte dei passaggi noiosi, dispendiosi in termini di tempo e soggetti a errori sono ora guidati dal software (vedere Figura 1 per una panoramica generale). Ulteriori sforzi sono stati fatti per sviluppare strumenti dedicati per migliorare la facilità d’uso evitando gli errori umani durante il processo complessivo e per promuovere la trasfezione di successo anche per i non specialisti nel campo. Il protocollo descritto include un foglio di calcolo macro “user-friendly” che abbiamo sviluppato al fine di gestire 384 condizioni di trasfezione indipendenti con possibilità di multiplexing fino a quattro plasmidi in ogni pozzo. La macro genera automaticamente modelli delle lastre di origine per caricare il volume di plasmid di DNA previsto dall’avvio di soluzioni di stock e i file necessari per guidare il software nanodispenser sul progetto sperimentale che è stato inserito. Poiché l’erogazione manuale del DNA in una piastra sorgente 384-well è noiosa e soggetta a errori, abbiamo anche sviluppato un’applicazione dedicata basata su tablet per guidare l’utente durante l’erogazione della soluzione di DNA secondo il modello.
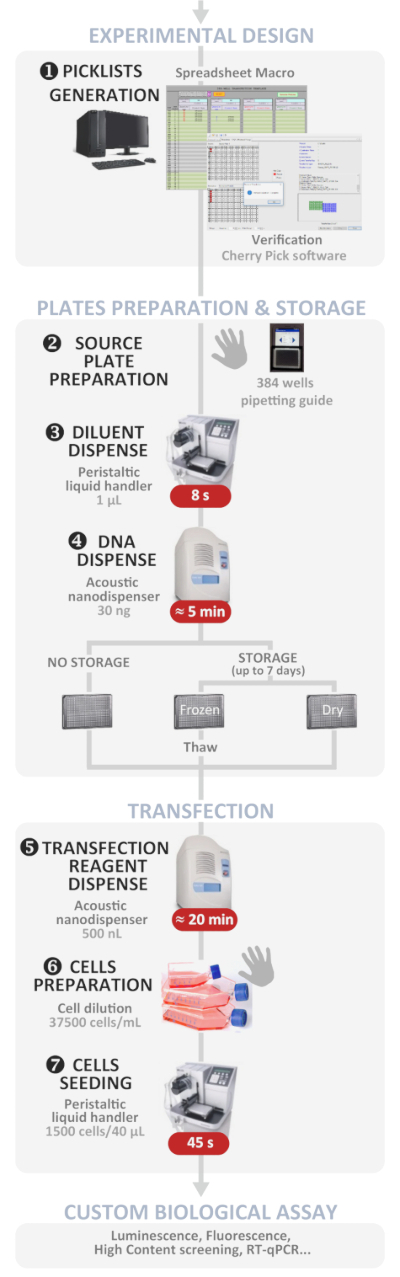
Figura 1: flusso di lavoro sperimentale. Rappresentazione schematica del protocollo di trasfezione inversa automatizzato ottimale ad alta velocità effettiva (dalla progettazione sperimentale al test biologico personalizzato). I passaggi manuali sono indicati dal simbolo della mano e il tempo approssimativo per ogni passo è scritto in una casella rossa. Fare clic qui per visualizzare una versione più grande di questa figura.
Molti esperimenti basati sulle cellule iniziano con la trasfezione del DNA plasmida, e anche se molti reagenti dedicati sono stati e sono ancora in fase di sviluppo per migliorare l’efficienza della trasfezione e/o facilitare la procedura, molto resta da fare2,3 , 4. La trasfezione cellulare plasmida di DNA prevede diversi passaggi per raggiungere un’elevata efficienza, come un assorbimento complesso iniziale, fuga endosomica e trasporto citoplasmatico al nucleo5,6. Oltre alla precipitazione di calcio o tecniche fisiche come elettroporazione o microiniezione utilizzando dispositivi dedicati7, i moderni metodi chimici si sono concentrati sul miglioramento della somministrazione di cellule del DNA, abbassando la citossicità cellulare8, 9. L’uso di lipidi o polimeri cationici che formano complessi simili a liposomi e, più recentemente, sistemi chimici polimerici non liposomici ha reso la trasfezione più facile e più efficiente10. Nonostante questi sviluppi, la trasfezione cellulare richiede ancora competenze specifiche per essere eseguita con precisione poiché la maggior parte di questi protocolli di trasfezione fisica o chimica richiedono agli scienziati di preparare manualmente ogni condizione di reazione alla trasfezione del DNA, compromissione della velocità effettiva. Per aggirare questo problema, sono stati sviluppati protocolli di trasfezione inversa utilizzando reagenti di trasfezione chimica11,12,13, consentendo all’utente di testare o combinare diversi plasmidi in modo più veloce. In questi protocolli, si formano complessi di acido nucleico con reagenti di trasfezione prima di seminare le cellule sui complessi. Tuttavia, questi protocolli inversi sono ancora limitati dalla gestione manuale delle soluzioni del DNA e dalla combinazione di ciascuna delle condizioni indipendenti. Anche se è possibile eseguirli in un formato di piastra 96-well, la preparazione del DNA e dispensa sarà noioso, e probabilmente ci saranno errori. Quando sono necessarie e multiplexed con l’altro diverse quantità di diversi plasmidi di DNA, la trasfezione cellulare diventa ancora più difficile da raggiungere e gli errori umani diventano abbastanza inevitabili. Scalare fino al formato a 384 pozze in un approccio di trasfezione inverso, nonostante poche condizioni di trasfezione del DNA multiplexed, diventa una sfida impossibile a causa dei seguenti motivi. i) I volumi di DNA, reagente di trasfezione o miscela di reazione da gestire sono inferiori a 1 -L per ogni pozzo. ii) Il multiplexing di plasmidi per 384 condizioni indipendenti diventa estremamente complicato. La consegna in ciascuno dei 384 pozzi è anche iii) molto dispendioso in termini di tempo e iv) soggetto a errori. Infatti, erogare la soluzione giusta nei pozzi attesi è difficile da gestire perché i bassi volumi già erogati non consentono il monitoraggio visivo tra i pozzi vuoti e quelli già riempiti. v) Infine, c’è un alto rischio di essiccazione della miscela per evaporazione prima che le cellule vengano aggiunte a causa del tempo necessario per eseguire le fasi di erogazione necessarie. In sintesi, il fattore limitante per impostare analisi di trasfezione del DNA ad alto consumo sembra essere la miniaturizzazione dell’analisi, che implica multiplexing e gestione a basso volume che non possono più essere gestiti manualmente, ma sono anche difficilmente raggiungibili in un affidabile dai classici gestori di liquidi peristatici.
Come prova di difficoltà per automatizzare tali saggi e ottenere un alto rendimento, solo pochi tentativi di automatizzare la trasfezione sono stati pubblicati finora: un formato di piastra di 96 pozzetti che utilizza un dispositivo di movimentazione dei liquidi commerciali e precipitazioni di fosfato di calcio14 e, più recentemente, un reagente lipoplex e un chip microfluidico che consentono 280 trasfettazioni indipendenti15 ma richiedono competenze specializzate in questo campo. Un altro metodo, l’acoustoforesi, che consente la levitazione liquida e porta alla manipolazione e miscelazione dei fluidi, è stato utilizzato per eseguire la trasfezione del DNA nei formati da 24 a 96 pozzi16. Anche se fattibile, questo approccio soffre di una produttività estremamente bassa in quanto la miscela di cellule con miscela di trasfezione del DNA richiede un’incubazione di 60 s per ogni singolo punto prima della semina. Ciò implica una durata di almeno 96 min per una piastra completa di 96 pozze. Inoltre, questo protocollo è ben lungi dall’essere suscettibile al pubblico generale dei biologi in quanto questo lavoro è stato fatto con un dispositivo progettato e fabbricato in-house che attualmente non è disponibile sul mercato. Al contrario, negli ultimi anni, è emersa una tecnologia di erogazione basata sull’acustica basata su software di facile utilizzo con dispositivi di dispenser nanovolume. Utilizzando energia acustica focalizzata, questi dispositivi consentono l’espulsione strettamente controllata di piccoli volumi di liquidi da 2,5 nL a 500 nL da una piastra di origine a una destinazione17. Questa tecnologia, chiamata espulsione acustica delle goccioline (ADE), presenta numerosi vantaggi: è completamente automatizzata, senza contatto, senza punta, precisa e altamente riproducibile, e ha un alto throughput18. In primo luogo dedicato alla fornitura di soluzioni di zolfo dimetilico (DMSO), le impostazioni sono state migliorate per erogare tamponi acquosi19. I nanodispenser acustici, quindi, sembrano adatti per i protocolli di trasfezione inversa delle cellule e potrebbero aggirare la maggior parte delle limitazioni manuali di cui sopra. Poiché in precedenza non sono stati descritti tentativi di trasfezione plasmida utilizzando questa tecnologia, abbiamo recentemente valutato l’idoneità di un sistema di erogazione basato su acustica per eseguire la trasfezione inversa delle celle.
Approfittando della velocità effettiva dei nanodispenser e della facilità d’uso, abbiamo ottimizzato un protocollo di trasfezione inversa per le cellule HeLa verificando diversi parametri che possono influenzare la trafezione del DNA su una piastra singola di 384 pozzetto, vale a dire la quantità totale di DNA e concentrazione iniziale del DNA sorgente, volume diluente, reagente di trasfezione e numero di cellule di diffusione. Il protocollo sviluppato aggira i limiti manuali sopra descritti della trasfezione cellulare e presenta diversi vantaggi rispetto ad altri tentativi di trasfezione automatizzati. In primo luogo, è miniaturizzato, consentendo così un reagente di trasfezione conveniente salvando i preparati del plasmide del DNA e il reagente di trasfezione. In secondo luogo, è molto più ad alto rendimento e riproducibile rispetto al protocollo manuale (anche per i principianti), in quanto la trasfezione di un’intera piastra di 384 pozzetto può essere ottenuta in meno di 1 h. Infine, è basato sul software, consentendo il controllo della quantità di DNA erogato e il multiplexing di diversi plasmidi. Infatti, grazie al software nanodispenser (Tabella dei materiali), l’utente può elaborare un piano di studio per controllare i volumi da erogare da una piastra di origine definita a una di destinazione.
Il protocollo qui presentato è destinato principalmente a coloro che hanno accesso a un nanodispenser e vorrebbero impostare esperimenti di trasfezione ad alta produttività, ma anche per coloro che vogliono ottimizzare rapidamente i loro parametri di trasfezione per un determinato tipo di cellula l’applicazione di questo protocollo per eseguire il cross-test di diversi parametri a velocità effettiva elevata. In effetti, abbiamo dimostrato che i parametri ottimizzati identificati con questo protocollo su nanoscala possono essere trasposti in esperimenti di trasfezione su larga scala e manuali. Infine, poiché il reagente di trasfezione utilizzato nel presente protocollo consente la trasfezione del DNA o del siRNA secondo il produttore, il protocollo è anche di interesse per coloro che mirano a eseguire approcci di array per la sovraespressione genica o il knockdown. Le piastre di destinazione precompilate con DNA possono essere conservate fino a 7 giorni prima dell’uso in un saggio di trasfezione senza perdita di efficacia, che è un altro vantaggio del seguente protocollo per questo tipo di applicazione.
Protocol
Representative Results
Discussion
L’istituzione e l’ottimizzazione di un accurato metodo di trasflessazione ad alto throughput per una determinata linea cellulare richiedono agli scienziati di seguire alcuni parametri chiave descritti in questa sezione. Incoraggiamo vivamente a partire dai valori raccomandati in tutto il protocollo poiché queste impostazioni ottimizzate per le cellule HeLa si sono dimostrate efficienti anche per le cellule HEK. Tuttavia, poiché i parametri migliori possono dipendere dalle linee cellulari e dai reagenti di trasfezione, …
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
Gli autori hanno rivelato una ricevuta del seguente sostegno finanziario per la ricerca, la paternità e/o la pubblicazione di questo articolo: Inserm, Lille University, Lille Pasteur Institute, Conseil Régional du Nord, e PRIM-HCV1 e 2 (P Interdisciplinaire sur le Médicament), Agence Nationale de la Recherche (ANR-10-EQPX-04-01), la Feder (12001407 (D-AL) Equipex Imaginex BioMed) e la Comunità Europea (ERC-STG INTRACELL nTB 260901). Gli autori desiderano ringraziare il Dr. S. Moureu, il Dr. B. Villemagne, il Dr. R. Ferru-Clément e il Dr. H. Groult per la loro revisione critica e le correzioni del manoscritto.
Materials
| 384LDV Microplate | Labcyte | LP-0200 | |
| 384-well Microplate μClear Black | Greiner | 781906 | |
| Ampicilin | Sigma | A9393-5G | Selection antibiotic for bacteria transformed with ampicilin expressing vector |
| Android Tablet | Samsung | Galaxy Note 8 | used to guide the user while the source plate manual dispense |
| Aniospray Surf 29 | Anios | 2421073 | disinfectant to clean the MicroFlo head |
| Columbus software | Perkin Elmer | image analysis software | |
| Dulbecco's Modified Eagle Medium (DMEM), high glucose, GlutaMAX Supplement, pyruvate | Thermo Fisher Scientific | 10566032 | cell culture medium |
| Echo Cherry Pick 1.5.3 software | Labcyte | Software enabling ADE-based dispenses by the Echo550 device from a *.csv file; nanodispenser software | |
| Echo550 | Labcyte | ADE-based dispenser | |
| Fetal Bovine Serum | Thermo Fisher Scientific | 16000044 | to add in cell culture medium |
| Formalin solution, neutral buffered, 10% | Sigma-Aldrich | HT501128-4L | to fix cell |
| HeLa cells | ATCC | HeLa (ATCC® CCL-2™) | |
| Hoechst 33342, Trihydrochloride, Trihydrate | Thermo Fisher Scientific | H3570 | 10 mg/mL Solution in Water |
| INCell Analyzer 6000 | GE Healthcare | 29043323 | automated laser-based confocal imaging platform |
| LB medium | Thermoischer Scientific LB Broth Base (Lennox L Broth Base)®, powder |
12780052 | culture medium for bacteria growth |
| Lysis Buffer (A2) | Macherey-Nagel | 740912.1 | Buffer from the NucleoSpin Plasmid kit used to prepare plasmid from bacterial culture |
| MicroFlo 10µL cassette | Biotek Instruments Inc | 7170013 | to use with the Microflo Dispenser |
| MicroFlo 1μL cassette | Biotek Instruments Inc | 7170012 | to use with the Microflo Dispenser |
| MicroFlo Dispenser | Biotek Instruments Inc | 7171000 | peristaltic pump-based liquid handler device |
| Microvolume spectrophotometer | Denovix | DS-11 Spectrophotometer | Measure the DNA concentration of samples |
| mVenus plasmid | mVenus cDNA was cloned by enzymatic restriction digestion and ligation in Age1/BsrG1 sites of the tdTomato-N1 plasmid | Vector type: Mammalian Expression, Fusion Protein: mVenus | |
| Neutralization Buffer (A3) | Macherey-Nagel | 740913.1 | Buffer from the NucleoSpin Plasmid kit used to prepare plasmid from bacterial culture |
| NucleoSpin Plasmid kit | Macherey-Nagel | 740588.50 | used to prepare plasmid from bacterial culture |
| Optimal-Modified Eagle Medium (Opti-MEM) Medium | Thermo Fisher Scientific | 31985070 | |
| optional Wash bufferWash Buffer (A4) | Macherey-Nagel | 740914.1 | Buffer from the NucleoSpin Plasmid kit used to prepare plasmid from bacterial culture |
| orbital shaker | incubated large capacity shaker | 444-7084 | Used to grow bacteria under gentle agitation and 37°C |
| Penicillin-Streptomycin | Thermo Fisher Scientific | 15140122 | 10,000 U/mL |
| Phosphate-Buffered Saline | Thermo Fisher Scientific | 10010001 | |
| Plasmid mini-columns | Macherey-Nagel | 740499.250 | Silica membrane mini-column to prepare plasmid from bacterial culture |
| Resuspension Buffer (A1) | Macherey-Nagel | 740911.1 | Buffer from the NucleoSpin Plasmid kit used to prepare plasmid from bacterial culture |
| RNAse A | Macherey-Nagel | 740505 | Enzyme from the NucleoSpin Plasmid kit used to prepare plasmid from bacterial culture |
| tdTomato-N1 plasmid | Addgene | Plasmid #54642 | Vector type: Mammalian Expression, Fusion Protein: tdTomato |
| TransIT-X2 Dynamic Delivery System | Mirus Bio | MIR 6000 | |
| Wash Buffer (AW) | Macherey-Nagel | 740916.1 | Buffer from the NucleoSpin Plasmid kit used to prepare plasmid from bacterial culture |
| 3D printer | Creality | CR10S | used to print the plate adapter |
| Blender Software | https://www.blender.org/ Free software under GNU General Public License (GPL). |
version 2.79b | used to design the plate adapter |
Riferimenti
- Colin, B., Deprez, B., Couturier, C. High-Throughput DNA Plasmid Transfection Using Acoustic Droplet Ejection Technology. SLAS Discovery: Advancing Life Sciences R & D. , 2472555218803064 (2018).
- Mirus Bio. . Optimising Transfection Performance. , (2019).
- Thermo Fisher Scientific. . Factors Influencing Transfection Efficiency | Thermo Fisher Scientific – FR. , (2019).
- Boussif, O., et al. A versatile vector for gene and oligonucleotide transfer into cells in culture and in vivo: polyethylenimine. Proceedings of the National Academy of Sciences of the United States of America. 92 (16), 7297-7301 (1995).
- Figueroa, E., et al. A mechanistic investigation exploring the differential transfection efficiencies between the easy-to-transfect SK-BR3 and difficult-to-transfect CT26 cell lines. Journal of Nanobiotechnology. 15 (1), 36 (2017).
- Kirchenbuechler, I., Kirchenbuechler, D., Elbaum, M. Correlation between cationic lipid-based transfection and cell division. Experimental Cell Research. 345 (1), 1-5 (2016).
- Zhang, Z., Qiu, S., Zhang, X., Chen, W. Optimized DNA electroporation for primary human T cell engineering. BMC Biotechnology. 18 (1), 4 (2018).
- Cao, D., et al. Transfection activity and the mechanism of pDNA-complexes based on the hybrid of low-generation PAMAM and branched PEI-1.8k. Molecular bioSystems. 9 (12), 3175-3186 (2013).
- Bos, A. B., et al. Development of a semi-automated high throughput transient transfection system. Journal of Biotechnology. 180, 10-16 (2014).
- Colosimo, A., et al. Transfer and expression of foreign genes in mammalian cells. BioTechniques. 29 (2), 314-318 (2000).
- Villa-Diaz, L. G., Garcia-Perez, J. L., Krebsbach, P. H. Enhanced transfection efficiency of human embryonic stem cells by the incorporation of DNA liposomes in extracellular matrix. Stem Cells and Development. 19 (12), 1949-1957 (2010).
- Sabatini, D. M. . Reverse transfection method. , WO2001020015A1 (2001).
- Raymond, C., et al. A simplified polyethylenimine-mediated transfection process for large-scale and high-throughput applications. Methods (San Diego, CA). 55 (1), 44-51 (2011).
- Junquera, E., Aicart, E. Recent progress in gene therapy to deliver nucleic acids with multivalent cationic vectors. Advances in Colloid and Interface Science. 233, 161-175 (2016).
- Woodruff, K., Maerkl, S. J. A High-Throughput Microfluidic Platform for Mammalian Cell Transfection and Culturing. Scientific Reports. 6, 23937 (2016).
- Vasileiou, T., Foresti, D., Bayram, A., Poulikakos, D., Ferrari, A. Toward Contactless Biology: Acoustophoretic DNA Transfection. Scientific Reports. 6, 20023 (2016).
- Hadimioglu, B., Stearns, R., Ellson, R. Moving Liquids with Sound: The Physics of Acoustic Droplet Ejection for Robust Laboratory Automation in Life Sciences. Journal of Laboratory Automation. 21 (1), 4-18 (2016).
- Grant, R. J., et al. Achieving accurate compound concentration in cell-based screening: validation of acoustic droplet ejection technology. Journal of Biomolecular Screening. 14 (5), 452-459 (2009).
- Sackmann, E. K., et al. Technologies That Enable Accurate and Precise Nano- to Milliliter-Scale Liquid Dispensing of Aqueous Reagents Using Acoustic Droplet Ejection. Journal of Laboratory Automation. 21 (1), 166-177 (2016).
- Day, R. N., Davidson, M. W. The fluorescent protein palette: tools for cellular imaging. Chemical Society Reviews. 38 (10), 2887-2921 (2009).
- Zielinski, D., Gordon, A., Zaks, B. L., Erlich, Y. iPipet: sample handling using a tablet. Nature Methods. 11 (8), 784-785 (2014).
- Brunner, S., et al. Cell cycle dependence of gene transfer by lipoplex, polyplex and recombinant adenovirus. Gene Therapy. 7 (5), 401-407 (2000).
- Nii, T., et al. Single-Cell-State Culture of Human Pluripotent Stem Cells Increases Transfection Efficiency. BioResearch Open Access. 5 (1), 127-136 (2016).
- Noonan, D. J., Henry, K., Twaroski, M. L. A High-Throughput Mammalian Cell-Based Transient Transfection Assay. Signal Transduction Protocols. 284, 051-066 (2004).
- . . Transfection | TransIT Transfection Reagents | Mirus Bio. , (2015).
- American Type Culture Collection. . General protocol for transfection of stem cells, primary cells, and continuous cell lines with ATCC TransfeX Transfection Reagent. , (2017).
- American Type Culture Collection. . Transfection Reagents for Nucleic Acid Transfer into ATCC Cells. , (2017).
- de Los Milagros Bassani Molinas, M., Beer, C., Hesse, F., Wirth, M., Wagner, R. Optimizing the transient transfection process of HEK-293 suspension cells for protein production by nucleotide ratio monitoring. Cytotechnology. 66 (3), 493-514 (2014).
- Promega. . FuGENE® 6 Transfection Reagent. , (2019).
- Olden, B. R., Cheng, Y., Yu, J. L., Pun, S. H. Cationic polymers for non-viral gene delivery to human T cells. Journal of Controlled Release: Official Journal of the Controlled Release Society. 282, 140-147 (2018).
- Park, E., Cho, H. B., Takimoto, K. Effective gene delivery into adipose-derived stem cells: transfection of cells in suspension with the use of a nuclear localization signal peptide-conjugated polyethylenimine. Cytotherapy. 17 (5), 536-542 (2015).
- Wood, R. W., Loomis, A. L. The physical and biological effects of high-frequency sound-waves of great intensity. The London, Edinburgh, and Dublin Philosophical Magazine and Journal of Science. 4 (22), 417-436 (1927).
- Mamat, U., et al. Eliminating Endotoxin at the Source – A Novel Competent Cell Line with Modified Lipopolysaccharide for Low-Endotoxin Plasmid Production. , (2014).
- Ivanova, N. V., Kuzmina, M. L. Protocols for dry DNA storage and shipment at room temperature. Molecular Ecology Resources. 13 (5), 890-898 (2013).
- Lesnick, J., Lejeune-Dodge, A., Ruppert, N., Jarman, C. . High-Precision Cell Dispensing with the Labcyte Echo® Liquid Handler. , (2017).
- Yang, X., et al. A public genome-scale lentiviral expression library of human ORFs. Nature Methods. 8 (8), 659-661 (2011).
- Peng, J., Zhou, Y., Zhu, S., Wei, W. High-throughput screens in mammalian cells using the CRISPR-Cas9 system. The FEBS journal. 282 (11), 2089-2096 (2015).

