Kvantifisering av tre DNA lesjoner ved Mass massespektrometri og vurdering av deres nivåer i vev av mus utsatt for ambient Fine partikler
Summary
Vi beskriver her metoder for sensitiv og nøyaktig kvantifisering av lesjoner 8-Oxo-7, 8-dihydro-2′-deoxyguanosine (8-oxodGuo), 1,n6-etheno-2′-Deoksyadenosinregionen (1,n6-dAdo) og 1,N2– etheno-2′-deoxyguanosine (1,N2-dGuo) i DNA. Metodene ble brukt på vurderingen av virkningene av svevestøv partikler (PM2,5) i vev (lunge, lever og nyre) av eksponerte A/J mus.
Abstract
DNA-addukter og oksidert DNA-baser er eksempler på DNA-lesjoner som er nyttige biomarkører for toksisitet vurdering av stoffer som er Elektrofil, generere reaktive elektrofiler ved biotransformasjon, eller indusere oksidativt stress. Blant oksidert nucleobases, den mest studerte en er 8-Oxo-7, 8-dihydroguanine (8-oxoGua) eller 8-Oxo-7, 8-dihydro-2′-deoxyguanosine (8-oxodGuo), en biomarkør av oxidatively indusert base skade i DNA. Aldehyder og epoxyaldehydes som følge av lipid peroxidation prosessen er Elektrofil molekyler i stand til å danne mutagent exocyclic DNA addukter, slik som etheno addukter 1,n2-etheno-2′-Deoxyguanosine (1,N2– εdGuo) og 1,n6-etheno-2′-Deoksyadenosinregionen (1,n6-εdAdo), som har blitt foreslått som potensielle biomarkører i patofysiologi av betennelse. Selektive og følsomme metoder for deres kvantifisering i DNA er nødvendig for utvikling av forebyggende strategier for å bremse celle mutasjon priser og kronisk sykdom utvikling (f. eks, kreft, nevrodegenerative sykdommer). Blant de sensitive metoder tilgjengelig for deteksjon (høy ytelse flytende kromatografi koplet til elektrokjemiske eller tandem masse massespektrometri detektorer, komet analysen, immunanalyser, 32P-postlabeling), den mest selektive er de basert på høy ytelse flytende kromatografi koplet til tandem Mass massespektrometri (HPLC-ESI-MS/MS). Selektivitet er en viktig fordel når analysere komplekse biologiske prøver og HPLC-ESI-MS/MS utviklet seg som gullstandarden for kvantifisering av modifiserte nucleosides i biologiske matriser, som DNA, urin, plasma og spytt. Bruken av isotopically merket interne standarder legger til fordel for rettelser for molekylet tap under DNA hydrolyse og analytt berikelse skritt, samt for forskjeller i analytt ionisering mellom prøvene. Den likeledes hjelpemidler inne identifikasjonen av det korrekt kromatografiske fjellpigg når mer enn ettall fjellpigg er gave.
Vi presenterer her validert sensitiv, nøyaktig og presis HPLC-ESI-MS/MS metoder som ble med hell søkt om kvantifisering av 8-oxodGuo, 1,N6-DAdo og 1,n2-dGuo i lunge, lever og nyre DNA av A/J mus for vurderingen av virkningene av ambient PM2,5 eksponering.
Introduction
Noen reaktive oksygen arter (ROS) er i stand til å oksidere karbon doble bånd av DNA baser og noen karbonatomer i deoxyribose moiety, genererer oksidert baser og DNA strand pauser1. Som et negativt ladet molekyl rik på nitrogen og oksygen atomer, er DNA også et mål for Elektrofil grupper som covalently reagerer med nukleofil nettsteder (nitrogen og oksygen), noe som gir produkter som kalles DNA addukter2. Så, DNA addukter og oksidert DNA baser er eksempler på DNA lesjoner som er nyttige biomarkører for toksisitet vurdering av stoffer som er Elektrofil, generere reaktive elektrofiler ved biotransformasjon, eller indusere oksidativt stress1, 2i det. Selv om de modifiserte DNA baser kan fjernes fra DNA ved basen eller nukleotid forbrukeravgift reparasjon (BER eller NER), induksjon av en ubalanse mellom generering og fjerning av DNA lesjoner i favør av den tidligere fører til en netto økning på sine nivåer i DNA over tid3 . Resultatene er økningen av DNA mutasjon priser, redusert genuttrykk, og redusert protein aktivitet2,4, 5,6,7, effekter som er nært knyttet til utvikling av sykdommer. DNA mutasjoner kan påvirke ulike cellulære funksjoner, slik som celle signalering, celle syklus, Genova integritet, telomere stabilitet, epigenome, kromatin struktur, RNA skjøting, protein homeostase, metabolisme, apoptose, og celle differensiering8 ,9. Strategier for å forsinke celle mutasjon priser og kronisk sykdom utvikling (f. eks, kreft, nevrodegenerative sykdommer) passere gjennom kunnskap om mutasjon kilder, blant dem, DNA lesjoner og deres årsaker.
ROS generert endogenously i overkant, på grunn av forurensende eksponering, vedvarende betennelse, sykdom patofysiologi (f. eks, diabetes), etc., er viktige årsaker til biomolekyler Kader, inkludert DNA og lipid skade1. Som et eksempel, den svært reaktive hydroksyl radikale (OH) dannet fra H2O2 reduksjon av overgangen metall ioner (Fe2 +, Cu+) oksiderer DNA baser, DNA sukker moiety og flerumettede fettsyrer ved diffusjon-kontrollerte priser10. Blant 80 allerede karakterisert oksidert nucleobases3, den mest studerte en er 8-Oxo-7, 8-dihydroguanine (8-oxoGua) eller 8-Oxo-7, 8-dihydro-2′-deoxyguanosine (8-OxodGuo, figur 1), en lesjon som er i stand til å indusere gt transversions i pattedyrceller10,11. Det er dannet av mono elektronisk oksidasjon av Guanin, eller ved hydroksyl radikale eller singlet oksygen angrep av Guanin i DNA1. Flerumettede fettsyrer er andre viktige mål for svært reaktive oksidanter, for eksempel •Oh, som starter prosessen med lipid peroxidation1,12. Det gir opphav til fatty acid hydroperoxides som kan brytes ned til Elektrofil aldehyder og epoxyaldehydes, som malondialdehyde, 4-AHA-2-nonenal, 2, 4-decadienal, 4, 5-epoxy-(2E)-decenal, hexenal, acrolein, crotonaldehyde, som er stand til å danne mutagent exocyclic DNA addukter, slik som malondialdehyde-, propano-, eller etheno addukter1,12,13. Den etheno addukter 1,n2-etheno-2′-Deoxyguanosine (1,n2-ΕdGuo, figur 1) og 1,n6-etheno-2′-deoksyadenosinregionen (1,n6-εdAdo, figur 1 ) har blitt foreslått som potensielle biomarkører i patofysiologi av betennelse14,15.
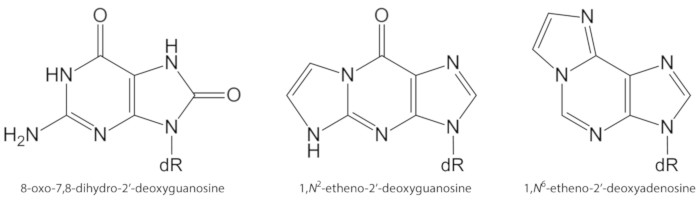
Figur 1. Kjemiske strukturer av DNA lesjoner kvantifisert i denne studien. dR = 2 ́-deoxyribose. Dette tallet er modifisert fra Oliveira et al.34. Vennligst klikk her for å se en større versjon av dette tallet.
Studier utført tidlig på 1980-tallet tillot sensitiv påvisning av 8-oxodGuo av høy ytelse flytende kromatografi koplet til elektrokjemiske deteksjon (HPLC-ECD). Kvantifisering av 8-oxodGuo av HPLC-ECD i flere biologiske systemer utsatt for oksiderende forhold førte til anerkjennelse av 8-oxodGuo som en biomarkør av oxidatively indusert base skade i DNA1,16. Selv om den er robust og tillater kvantifisering av 8-oxodGuo i det lave fmol området17, er HPLC-ECD-målinger avhengig av nøyaktigheten av analytt oppbevaringstid for analytt identifisering og kromatografi oppløsning for å unngå forstyrrelser i andre utvalgs bestanddeler. Som elektrokjemiske deteksjon krever bruk av salt (f. eks, kalium fosfat, natrium acetate) i den mobile fasen, vedlikehold av tilstrekkelig analytiske forhold behov rutine kolonne og utstyr rengjøring tid.
Alternativt, bruk av bakteriell DNA reparasjon enzym formamidopyrimidine DNA glycosylase (FPG) og, etterpå, menneskelige 8-oxoguanine glycosylase 1 (hOGG1), for påvisning og fjerning av 8-oxoGua fra DNA, dukket opp som en måte for induksjon av DNA alkali labilt Nettsteder. Den alkali labilt nettsteder er konvertert til DNA strand pauser og la svært høysensitiv indirekte kvantifisering av 8-oxoGua av alkalisk enkelt celle gel elektroforese (“komet analysen”). Den høye følsomheten og gjennomføringen av analysene uten behov for mobilnettet DNA utvinning er de viktigste fordelene med denne typen analysen. Det gir lavest steady-state nivåer av 8-oxoGua i DNA, typisk 7-10 ganger lavere enn nivåene innhentet av bioanalytical metoder basert på HPLC. Men det er en indirekte måling av 8-oxoGua og noen ulemper er mangelen på spesifisitet eller ukjent effektiviteten av reparasjon enzymer som brukes1,16,18.
Immunanalyser er andre sett av metoder som brukes for påvisning av 8-oxoGua1 og exocyclic DNA addukter, for eksempel 1,N6-dAdo og 1,n2-dGuo12. Til tross for følsomheten, en brist av bruk av antistoffer for påvisning av DNA lesjoner er mangelen på spesifisitet på grunn av kryss-reaktivitet til andre komponenter av biologiske prøver, inkludert normal DNA baser1,12. Exocyclic DNA addukter, inkludert 1,n6-DAdo og 1,n2-dGuo, kan også oppdages og kvantifisert av svært følsomme 32P-postlabeling analyser12. Den høye følsomheten til 32P-postlabeling tillater bruk av svært små mengder DNA (f. eks 10 μg) for påvisning av ca 1 epoxyaddukt per 1010 normal baser19. Men bruken av radio-kjemikalier, mangel på kjemisk spesifisitet og lav nøyaktighet er noen ulemper19,20.
En felles begrensning av metodene sitert ovenfor er den lave selektivitet eller spesifisitet for påvisning av de ønskede molekyler. I dette scenariet, HPLC koblet til electrospray ionisering tandem masse massespektrometri (HPLC-ESI-MS/MS og HPLC-MS3) utviklet seg som gullstandarden for kvantifisering av modifisert nucleosides i biologiske matriser, som DNA, urin, plasma og spytt 1 den andre , 19 andre priser , 20. fordeler med HPLC-ESI-MS/MS metoder er følsomheten (vanligvis i lav fmol rekkevidde) og den høye spesifisitet levert av i) den kromatografiske separasjon, II) den karakteristiske og kjente mønster av molekyl fragmentering inne i massen spektrometer kollisjons kammer, og III) nøyaktig måling av den valgte massen til lade ratio (m/z) i flere reaksjons overvåkingsmodus1,19. Bruken av isotopically merket interne standarder legger til fordel for rettelser for molekylet tap under DNA hydrolyse og analytt berikelse skritt, samt for forskjeller i analytt ionisering mellom prøvene. Den likeledes hjelpemidler inne identifikasjonen av det korrekt kromatografiske fjellpigg når mer enn ettall fjellpigg er gave1,12,19,20.
Adskillige metoder basert på HPLC-ESI-MULTIPLE SCLEROSIS/MULTIPLE SCLEROSIS ha blitt anvendt for kvantifisering av 8-oxodGuo, 1,N6-dAdo og 1,N2-dGuo inne DNA utdraget fra annerledes Biological prøvene12,15,20 ,21,22,23,24,25,26,27,28,29 . Fine partikler (PM2,5) bærer organiske og uorganiske kjemikalier som Polysykliske aromatiske hydrokarboner (PAH), Nitro-PAH, aldehyder, ketoner, kar bok syls syrer, quinolines, metaller og vannløselige ioner, som kan indusere betennelser og oksidativt stress, forhold som favoriserer forekomsten av biomolekyler Kader og sykdom30,31,32,33. Vi presenterer her validert HPLC-ESI-MS/MS metoder som ble med hell søkt om kvantifisering av 8-oxodGuo, 1,N6-DAdo og 1,N2-dGuo i lunge, lever og nyre DNA av A/J mus for vurderingen av effekter av ambient PM2,5 eksponering34.
Protocol
Representative Results
Discussion
Et stort problem funnet i 8-oxodGuo analyser av HPLC metoder er mulig induksjon av dannelsen under workup prosedyrene for DNA-ekstraksjon, DNA hydrolyse, og konsentrasjonen av DNA hydrolysater22,38. For å minimere problemet med 8-oxodGuo artifactual formasjon, anbefales det tilsetning av deferoxamine til alle DNA-ekstraksjon, lagring og hydrolyse løsninger, bruk av natrium iodide chaotropic metode og unngåelse av fenol i DNA-ekstraksjon, som samt bruk av DNA-b…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
FAPESP (Fundação de Amparo à Pesquisa do Estado de São Paulo, Pros. 2012/22190-3 og 2012/08616-8), CNPq (Pros. 454214/2014-6 og 429184/2016-6), KAPPER, PRPUSP (Pró-Reitoria de Pesquisa da Universidade de São Paulo), INCT INAIRA (MCT/CNPq/FNDCT/KAPPER/ FAPEMIG/FAPERJ/FAPESP; Pros. 573813/2008-6), INCT Redoxoma (FAPESP/CNPq/KAPPER; Pros. 573530/2008-4), NAP-Redoxoma (PRPUSP; Pros. 2011.1.9352.1.8) og CEPID Redoxoma (FAPESP; 2013/07937-8). T. F. Oliveira og A. F. Oliveira mottatt stipend fra FAPESP (Pros. 2012/21636-8, 2011/09891-0, 2012/08617-4) og KAPPER (Coordenação de Aperfeiçoamento de Pessoal de Nível Superior). M. H. G. Medeiros, P. di Mascio, P. H. N. Saldiva, og A. P. M. Loureiro mottatt stipend fra CNPq.
Noen figurer og tabeller til stede i dette arbeidet ble opprinnelig publisert i Oliveira A.A.F. et al. gentoksisk og epigenotoxic effekter hos mus eksponert for konsentrerte partikler med svevestøv (PM2,5) fra São Paulo City i Brasil. Partikkel og fiber toksikologiske. 15, 40 (2018).
Materials
| [15N5]-2’-deoxyadenosine | Cambridge Isotope Laboratories | NLM-3895-25 | |
| [15N5]-2’-deoxyguanosine | Cambridge Isotope Laboratories | NLM-3899-CA-10 | |
| acetonitrile | Carlo Erba Reagents | 412413000 | |
| alkaline phosphatase from bovine intestinal mucosa | Sigma | P5521 | |
| ammonium acetate | Merck | 101116 | |
| calf thymus DNA | Sigma | D1501 | |
| cell lysis solution | QIAGEN | 158908 | |
| chloroform | Carlo Erba Reagents | 412653 | |
| deferoxamine | Sigma | D9533 | |
| deoxyribonuclease I (DNase I) | Bio Basic Inc | DD0649 | |
| ethanol | Carlo Erba Reagents | 414542 | |
| formic acid | Sigma-Aldrich | F0507 | |
| HPLC-ESI-MS/MS system | HPLC: Agilent 1200 series ESI-MS/MS: Applied Biosystems/MDS Sciex Instruments | HPLC: binary pump (G1312B), isocratic pump (G1310A), column oven with a column switching valve (G1316B), diode array detector (G1315C), auto sampler (G1367C). ESI-MS/MS: Linear Quadrupole Ion Trap mass spectrometer, Model 4000 QTRAP. | |
| HPLC/DAD system | Shimadzu | Two pumps (LC-20AT), photo diode array detector (DAD-20AV), auto-injector (Proeminence SIL-20AC), column oven (CTO-10AS/VP) | |
| HPLC column (50 x 2.0 mm i.d., 2.5 µm, C18) | Phenomenex | 00B-4446-B0 | |
| HPLC column (150 x 2.0 mm i.d., 3.0 µm, C18) | Phenomenex | 00F-4251-B0 | |
| HPLC column (250 x 4.6 mm i.d., 5.0 µm, C18) | Phenomenex | 00G-4252-E0 | |
| HPLC C18 security guard cartridge (4.0 x 3.0 mm i.d.) | Phenomenex | AJO-4287 | |
| isoamyl alcohol | Sigma-Aldrich | M32658 | |
| isopropyl alcohol (isopropanol) | Carlo Erba Reagents | A412790010 | |
| ketamine | Ceva | Commercial name: Dopalen | |
| magnesium chloride | Carlo Erba Reagents | 349377 | |
| magnesium chloride | Sigma | M2393 | |
| methanol | Carlo Erba Reagents | L022909K7 | |
| phosphodiesterase I from Crotalus atrox | Sigma | P4506 | |
| protein precipitation solution | QIAGEN | 158912 | |
| proteinase K | Sigma-Aldrich | P2308 | |
| ribonuclease A | Sigma | R5000 | |
| sodium chloride | Sigma-Aldrich | S9625 | |
| SPE-C18 (Strata-X) | Phenomenex | 8B-S100-TAK | |
| tris(hydroxymethyl)-aminomethane | Carlo Erba Reagents | 489983 | |
| xylazine | Syntec do Brasil | Commercial name: Xilazin |
Riferimenti
- Cadet, J., Davies, K. J. A., Medeiros, M. H. G., Di Mascio, P., Wagner, J. R. Formation and repair of oxidatively generated damage in cellular DNA. Free Radical Biology and Medicine. 107, 13-34 (2017).
- Barnes, J. L., Zubair, M., John, K., Poirier, M. C., Martin, F. L. Carcinogens and DNA damage. Biochemical Society Transactions. 46, 1213-1224 (2018).
- Cadet, J., Davies, K. J. A. Oxidative DNA damage & repair: An introduction. Free Radical Biology and Medicine. 107, 2-12 (2017).
- Cao, H., Jiang, Y., Wang, Y. Stereospecific synthesis and characterization of oligodeoxyribonucleotides containing an N2-(1-carboxyethyl)-2′-deoxyguanosine. Journal of the American Chemical Society. 129, 12123-12130 (2007).
- Breyer, V., et al. Analysis and biological relevance of advanced glycation end-products of DNA in eukaryotic cells. The FEBS Journal. 275, 914-925 (2008).
- Tamae, D., Lim, P., Wuenschell, G. E., Termini, J. Mutagenesis and repair induced by the DNA advanced glycation end product N2-1-(carboxyethyl)-2′-deoxyguanosine in human cells. Biochimica. 50, 2321-2329 (2011).
- Hecht, S. S. Lung carcinogenesis by tobacco smoke. International Journal of Cancer. 131, 2724-2732 (2012).
- Garraway, L. A., Lander, E. S. Lessons from the cancer genome. Cell. 153, 17-37 (2013).
- Ong, T. P., Loureiro, A. P. M. Nutritional interventions in age-related genetic and epigenetic instability and cancer. Anti-ageing nutrients: Evidence-based prevention of age-associated diseases. , (2015).
- Evans, M. D., Dizdaroglu, M., Cooke, M. S. Oxidative DNA damage and disease: induction, repair and significance. Mutation Research. 567, 1-61 (2004).
- Moriya, M. Single-stranded shuttle phagemid for mutagenesis studies in mammalian cells: 8-oxoguanine in DNA induces targeted GC → TA transversions in simian kidney cells. Proceedings of the National Academy of Sciences of the United States of America. 90, 1122-1126 (1993).
- Medeiros, M. H. G. Exocyclic DNA adducts as biomarkers of lipid oxidation and predictors of disease. Challenges in developing sensitive and specific methods for clinical studies. Chemical Research in Toxicology. 22, 419-425 (2009).
- Guéraud, F. 4-Hydroxynonenal metabolites and adducts in pre-carcinogenic conditions and cancer. Free Radical Biology and Medicine. 111, 196-208 (2017).
- Nair, U., Bartsch, H., Nair, J. Lipid peroxidation-induced DNA damage in cancer-prone inflammatory diseases: A review of published adduct types and levels in humans. Free Radical Biology and Medicine. 43, 1109-1120 (2007).
- Pang, B., et al. Lipid peroxidation dominates the chemistry of DNA adduct formation in a mouse model of inflammation. Carcinogenesis. 28, 1807-1813 (2007).
- Møller, P., et al. Harmonising measurements of 8-oxo-7,8-dihydro-2′-deoxyguanosine in cellular DNA and urine. Free Radical Research. 46, 541-553 (2012).
- Hofer, T., Moller, L. Optimization of the workup procedure for the analysis of 8-oxo-7,8-dihydro-2′-deoxyguanosine with electrochemicaldetection. Chemical Research in Toxicology. 15, 426-432 (2002).
- Collins, A., El Yamani, N., Dusinska, M. Sensitive detection of DNA oxidation damage induced by nanomaterials. Free Radical Biology and Medicine. , 69-76 (2017).
- Zubel, T., Buerkle, A., Mangerich, A. Mass spectrometric analysis of sulfur mustard-induced biomolecular adducts: Are DNA adducts suitable biomarkers of exposure?. Toxicology Letters. 293, 21-30 (2018).
- Tretyakova, N., Goggin, M., Sangaraju, D., Janis, G. Quantitation of DNA adducts by stable isotope dilution mass spectrometry. Chemical Research in Toxicology. 25, 2007-2035 (2012).
- Churchwell, M. I., Beland, F. A., Doerge, D. R. Quantification of multiple DNA adducts formed through oxidative stress using liquid chromatography and electrospray tandem mass spectrometry. Chemical Research in Toxicology. 15, 1295-1301 (2002).
- Chao, M. R., Yen, C. C., Hu, C. W. Prevention of artifactual oxidation in determination of cellular 8-oxo-7,8-dihydro-2′-deoxyguanosine by isotope-dilution LC-MS/MS with automated solid-phase extraction. Free Radical Biology and Medicine. 44, 464-473 (2008).
- Danielsen, P. H., et al. Oxidative stress, inflammation, and DNA damage in rats after intratracheal instillation or oral exposure to ambient air and wood smoke particulate matter. Toxicological Sciences. 118, 574-585 (2010).
- Danielsen, P. H., et al. Oxidative stress, DNA damage, and inflammation induced by ambient air and wood smoke particulate matter in human A549 and THP-1 cell lines. Chemical Research in Toxicology. 24, 168-184 (2011).
- Garcia, C. C. M., et al. [13C2]-Acetaldehyde promotes unequivocal formation of 1,N2-propano-2′-deoxyguanosine in human cells. Journal of the American Chemical Society. 133, 9140-9143 (2011).
- Angeli, J. P. F., et al. Lipid hydroperoxide-induced and hemoglobin-enhanced oxidative damage to colon cancer cells. Free Radical Biology and Medicine. 51, 503-515 (2011).
- Yu, Y., et al. Comprehensive assessment of oxidatively induced modifications of DNA in a rat model of human Wilson’s disease. Molecular and Cellular Proteomics. 15, 810-817 (2016).
- Torres-Cuevas, I., Aupi, M., Asensi, M. A., Vento, M., Ortega, &. #. 1. 9. 3. ;., Escobar, J. 7,8-Hydroxy-2′-deoxyguanosine/2′-deoxiguanosine ratio determined in hydrolysates of brain DNA by ultrachromatrography coupled to tandem mass spectrometry. Talanta. 170, 97-102 (2017).
- Wu, D., et al. Detection of 8-hydroxydeoxyguanosine (8-OHdG) as a biomarker of oxidative damage in peripheral leukocyte DNA by UHPLC-MS/MS. Journal of Chromatography B. 1064, 1-6 (2017).
- IARC. . Monographs on the Evaluation of Carcinogenic Risks to Humans: Outdoor Air Pollution. 109, (2016).
- De Martinis, B. S., Kado, N. Y., Carvalho, L. R. F., Okamoto, R. A., Gundel, L. A. Genotoxicity of fractionated organic material in airborne particles from São. Mutation Research. 446, 83-94 (1999).
- Karlsson, H. L., Nygren, J., Möller, L. Genotoxicity of airborne particulate matter: The role of cell-particle interaction and of substances with adduct-forming and oxidizing capacity. Mutation Research. 565, 1-10 (2004).
- Bell, M. L., Dominici, F., Ebisu, K., Zeger, S. L., Samet, J. M. Spatial and temporal variation in PM2.5 chemical composition in the United States for health effects studies. Environmental Health Perspectives. 115, 989-995 (2007).
- Oliveira, A. A. F., et al. Genotoxic and epigenotoxic effects in mice exposed to concentrated ambient fine particulate matter (PM2.5) from São Paulo city, Brazil. Particle and Fibre Toxicology. 15, 40 (2018).
- Loureiro, A. P. M., Zhang, W., Kassie, F., Zhang, S., Villalta, P. W., Wang, M., Hecht, S. S. Mass spectrometric analysis of a cyclic 7,8-butanoguanine adduct of N-nitrosopyrrolidine: comparison to other N-nitrosopyrrolidine adducts in rat hepatic DNA. Chemical Research in Toxicology. 22, 1728-1735 (2009).
- Loureiro, A. P. M., Marques, S. A., Garcia, C. C. M., Di Mascio, P., Medeiros, M. H. G. Development of an on-line liquid chromatography-electrospray tandem mass spectrometry assay to quantitatively determine 1,N2-etheno-2′-deoxyguanosine in DNA. Chemical Research in Toxicology. 15, 1302-1308 (2002).
- Mangal, D., et al. Analysis of 7,8-dihydro-8-oxo-2′-deoxyguanosine in cellular DNA during oxidative stress. Chemical Research in Toxicology. 22, 788-797 (2009).
- ESCODD (European Standards Committee on Oxidative DNA Damage). Comparative analysis of baseline 8-oxo-7,8-dihydroguanine in mammalian cell DNA, by different methods in different laboratories: an approach to consensus. Carcinogenesis. 23, 2129-2133 (2002).
- Helbock, H. J., et al. DNA oxidation matters: The HPLC-electrochemical detection assay of 8-oxo-deoxyguanosine and 8-oxo-guanine. Proceedings of the National Academy of Sciences of the United States of America. 95, 288-293 (1998).
- Risom, L., et al. Oxidative DNA damage and defence gene expression in the mouse lung after short-term exposure to diesel exhaust particles by inhalation. Carcinogenesis. 24, 1847-1852 (2003).
- Risom, L., et al. Repeated inhalations of diesel exhaust particles and oxidatively damaged DNA in young oxoguanine DNA glycosylase (OGG1) deficient mice. Free Radical Research. 41, 172-181 (2007).
- Tsurudome, Y., et al. Changes in levels of 8-hydroxyguanine in DNA, its repair and OGG1 mRNA in rat lungs after intratracheal administration of diesel exhaust particles. Carcinogenesis. 20, 1573-1576 (1999).
- Marie-Desvergne, C., Maître, A., Bouchard, M., Ravanat, J. L., Viau, C. Evaluation of DNA adducts, DNA and RNA oxidative lesions, and 3-hydroxybenzo(a)pyrene as biomarkers of DNA damage in lung following intravenous injection of the parent compound in rats. Chemical Research in Toxicology. 23, 1207-1214 (2010).
- Iwai, K., et al. Early oxidative DNA damages and late development of lung cancer in diesel exhaust-exposed rats. Environmental Research. 84, 255-264 (2000).
- Ichinose, T., et al. Lung carcinogenesis and formation of 8-hydroxy-deoxyguanosine in mice by diesel exhaust particles. Carcinogenesis. 18, 185-192 (1997).
- Schmerold, I., Niedermu, H. Levels of 8-hydroxy-2′-deoxyguanosine in cellular DNA from 12 tissues of young and old Sprague Dawley rats. Experimental Gerontology. 36, 1375-1386 (2001).
- Garcia, C. C. M., Freitas, F. P., Di Mascio, P., Medeiros, M. H. G. Ultrasensitive simultaneous quantification of 1,N2-etheno-2′-deoxyguanosine and 1,N2-propano-2′-deoxyguanosine in DNA by an online liquid chromatography-electrospray tandem mass spectrometry assay. Chemical Research in Toxicology. 23, 1245-1255 (2010).
- Godshalk, R., et al. Comparison of multiple DNA adduct types in tumor adjacent human lung tissue: effect of cigarette smoking. Carcinogenesis. 23, 2081-2086 (2002).
- Dechakhamphu, S., et al. Lipid peroxidation and etheno DNA adducts in white blood cells of liver fluke-infected patients: protection by plasma alpha-tocopherol and praziquantel. Cancer Epidemiology Biomarkers and Prevention. 19, 310-318 (2010).
- Arab, K., et al. Typical signature of DNA damage in white blood cells: a pilot study on etheno adducts in Danish mother-newborn child pairs. Carcinogenesis. 30, 282-285 (2009).
- Nair, J., et al. High dietary omega-6 polyunsaturated fatty acids drastically increase the formation of etheno-DNA base adducts in white blood cells of female subjects. Cancer Epidemiology Biomarkers and Prevention. 6, 597-601 (1997).

