Pneumococcus infeksjon av primær Human endothelial celler i konstant Flow
Summary
Denne studien beskriver mikroskopisk overvåking av pneumococcus overholdelse av von Willebrand faktor strenger produsert på overflaten av differensiert menneskelige primære endothelial celler under skjær stress i definerte strømningsforhold. Denne protokollen kan utvides til detaljert visualisering av spesifikke celle strukturer og kvantifisering av bakterier ved å bruke differensial immunostaining prosedyrer.
Abstract
Interaksjon av Streptococcus pneumoniae med overflaten av endothelial celler er mediert i blodstrøm via mechanosensitive proteiner som von Willebrand Factor (VWF). Dette glykoprotein endrer sin molekylære konformasjon som svar på skjær stress, og dermed utsette bindende områder for et bredt spekter av Host-ligand interaksjoner. Generelt, dyrking av primær endothelial celler under en definert skjær flyt er kjent for å fremme den spesifikke cellulære differensiering og dannelsen av en stabil og tett knyttet endothelial lag som likner fysiologi av indre foring av et blodkar . Dermed, funksjonell analyse av interaksjoner mellom bakterielle patogener og verten blodkar involverer mechanosensitive proteiner krever etablering av pumpesystemer som kan simulere fysiologiske strømnings krefter kjent for å påvirke overflaten av vaskulære celler.
Den mikrovæskebasert enheten som brukes i denne studien, muliggjør en kontinuerlig og pulseless resirkulering av væsker med en definert strømningshastighet. Det datastyrte Lufttrykks pumpesystemet anvender en definert skjærbelastning på endothelial celle overflater ved å generere en sammenhengende, enveis og kontrollert medium flyt. Morfologiske endringer av celler og bakteriell vedlegget kan mikroskopisk overvåkes og kvantifisert i flyten ved hjelp av spesielle kanal lysbilder som er utformet for mikroskopisk visualisering. I motsetning til statisk cellekultur infeksjon, som generelt krever en prøve fiksering før immun merking og mikroskopiske analyser, gjør de mikrovæskebasert lysbildene det mulig å både fluorescens deteksjon av proteiner, bakterier og cellulære komponenter etter prøve fiksering; seriell immunofluorescence farging; og direkte fluorescens deteksjon i sanntid. I kombinasjon med fluorescerende bakterier og spesifikke fluorescens antistoffer, gir denne infeksjonen prosedyren en effektiv flere komponent visualisering system for et stort spekter av vitenskapelige anvendelser knyttet til vaskulær prosesser.
Introduction
Den patogenesen av pneumococcus infeksjoner er preget av en mangesidig interaksjon med et mangfold av ekstracellulære matrise forbindelser og komponenter av den menneskelige hemostase, som plasminogen og VWF1,2, 3,4,5,6,7,8. Den replikasjonen glykoprotein VWF fungerer som nøkkel regulator av en balansert hemostase av formidling thrombocyte rekruttering og fibrin innlemmelse på stedet av vaskulær trombe formasjon9. Viktigheten av funksjonell, aktiv VWF for blødning kontroll og sår helbredelse er demonstrert av von Willebrand ‘ s sykdom, en felles arvelig blødning lidelse10.
Globular VWF sirkulerer i det menneskelige blod systemet ved en konsentrasjon på opptil 14,0 μg/ml11,10. Som svar på vaskulær skade, den lokale utgivelsen av VWF av endothelial Weibel Palade organer (WBP) er markert økt11,12. Tidligere studier viser at pneumococcus tilslutning til menneskelige endothelial celler og dens produksjon av pore-forming gift pneumolysin betydelig stimulerer luminal VWF sekresjon13. De hydrodynamisk kreftene i blodstrømmen induserer en strukturell åpning av mechanoresponsive VWF-domener. Ved strømningshastigheter på 10 Dyn/cm2 VWF multimerizes til lange protein strenger på opptil flere hundre mikrometer i lengde som forblir festet til subendothelium10,12.
For å forstå funksjonen av multimerized VWF strenger generert under skjær stress i samspillet av pneumococcus med endothelial overflaten, en mikrovæskebasert-basert cellekultur infeksjon tilnærming ble etablert. En mikrovæskebasert enhet med et programvarestyrt lufttrykk pumpesystem ble brukt. Dette aktiverte en kontinuerlig, veis resirkulering av cellekultur medium med en definert strømningshastighet. Dermed brukte systemet en definert skjær stress på overflaten av endothelial celler, som forble festet inne spesialiserte kanal lysbilder. Denne tilnærmingen aktivert simulering av skjærkraft i blodet av det menneskelige vaskulære system, der VWF strenger er generert på differensiert endothelial celler under definerte konstant strømningsforhold. For dette formålet ble de endothelial cellene dyrket i bestemte kanal lysbilder (se tabell over materialer), som ble tilpasset mikroskopiske analyser under flyten. Den mikrovæskebasert pumpen systemet gitt den svært definerte og kontrollerte skjær stress situasjonen kreves for dannelsen av utvidet VWF strenger på confluent endothelial celle laget. Etter stimulering av VWF-sekresjon av confluently vokst menneskelig navle vene endothelial celler (HUVEC) av histamin kosttilskudd, ble strengen formasjonen indusert ved å bruke en skjær stress (ԏ) på 10 Dyn/cm2. Skjær stresset er definert som kraften opptrer på celle laget. Det beregnes omtrent i henhold til Cornish et. et al.14 med ligning 1:
Hvor ԏ = skjær stress i Dyn/cm2, η = viskositet i (Dyn ∙ s)/cm2, h = halvparten av kanal høyden, w = halvparten av kanalbredden, og Φ = Strømmens hastighet i ml/min.
Resultatet av ligningen 1 avhenger av de forskjellige høydene og breddene til de forskjellige lysbildene som brukes (se tabell over materialer). I denne studien en luer kanal lysbilde av 0,4 μm resulterer i et kammer lysbilde faktor på 131,6 ble brukt (se formel 2).
Viskositet av mediet ved 37 ° c er 0,0072 Dyn ∙ s/cm ² og et skjær stress på 10 Dyn/cm ² ble brukt. Dette resulterte i en strømningshastighet på 10,5 mL/min (se formel 3).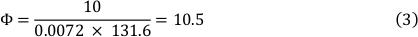
Her er tilpasning og fremme av en mikrovæskebasert celle dyrking prosedyre ved hjelp av en enveis laminær Flow system for etterforskning og visualisering av bakteriell infeksjon mekanismer i verten blodkar er beskrevet i detalj. Generering av VWF strenger på endothelial lag kan også stimuleres ved hjelp av andre pumpesystemer som er i stand til å bruke en kontinuerlig og jevn skjær stress15.
Etter dyrking av primær endothelial celler til samløpet i flyt og stimulering av VWF streng formasjon, pneumokokker uttrykke røde fluorescens protein (RFP)16 ble lagt til endothelial celle laget under konstant mikroskopisk kontroll. Vedlegget av bakterier til VWF strenger på overflaten av endothelial celler ble mikroskopisk visualisere og overvåket i opptil tre timer i sanntid ved hjelp av VWF-spesifikke fluorescerende-merket antistoffer. Med denne tilnærmingen, rollen som VWF som en vedheft kofaktor fremme bakteriell vedlegg til vaskulær endotelet ble bestemt8.
I tillegg til mikroskopisk visualisering av protein sekresjon og conformational endringer, denne metoden kan brukes til å overvåke enkelt trinn av bakteriell infeksjon prosesser i sanntid, og å kvantifisere mengden av vedlagte bakterier på ulike tidspunkt poeng av Infeksjon. Den spesifikke programvaren-kontrollerte pumpesystemet gir også muligheten til å kultur de endothelial cellene i definerte konstante strømningsforhold i opptil flere dager og muliggjør en definert pulserende medium Flow inkubasjons. Videre kan denne metoden brukes ved hjelp av forskjellige celletyper. Tilpassing av farge protokollen gjør det også mulig å oppdage og visualisere bakterier som internalisert inn i eukaryote celler.
Dette manuskriptet beskriver denne avanserte eksperimentelle protokollen som kan brukes som en definert, pålitelig og reproduserbar tilnærming for en effektiv og allsidig karakterisering av patofysiologiske prosesser.
Protocol
Representative Results
Discussion
Simulering av bakteriell interaksjon med mechanosensitive vert proteiner som VWF krever en perfusable cellekultur system som gjør det mulig generering av en definert, enveis, og kontinuerlig strøm av væsker, og dermed generere pålitelig skjær stress . Flere mikrovæskebasert pumpesystemer er allerede beskrevet. En omfattende gjennomgang fra Bergmann et al. oppsummerer de viktigste aspektene ved ulike to-og tre-dimensjonal cellekultur modeller17.
Den mikrovæskebase…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
Prosjektet ble finansiert av DFG (BE 4570/4-1) til S.B.
Materials
| 1 mL Luer-syringe | Fisher Scientific | 10303002 | with 1 mL volume for gelatin injection using the luer-connection of the slides |
| 2 mL Luer-syringe | Sarstedt | 9077136 | For pieptting/injecting fluids into the luer connections of the channel chamber slides |
| Accutase | eBioscience now thermo fisher | 00-4555-56 | protease mix used for gentle detachment of endothelial cells |
| AlexaFluor350-conjugated Phalloidin | Abcam | ab176751 | no concentration available from the manufacturer, stock solution is sufficient for 300 tets, company recommends to use 100 µl of a 1:1000 dilution, blue fluorescence (DAPI-filter settings) |
| AlexaFluor488-conjugated goat-derived anti-mouse antibody | Thermo Fisher Sientific | A11001 | stock concentration: 2 mg/mL for immunostaining of human VWF in microfluidic slide after PFA fixation, green fluorescence |
| AlexaFluor568-conjugated goat-derived anti-rabbit-antibody | Thermo Fisher Scientific | A-11011 | stock concentration: 2 mg/mL for immunostaining of pneumococci in microfluidic slide after pFA fixation, red fluorescence |
| Bacto Todd-Hewitt-Broth | Becton Dickinson GmbH | BD 249210 | complex bacterial culture medium |
| Bovine Serum Albumin (BSA) | Sigma Aldrich | A2153-25G | solubilized, for preparation of blocking buffer |
| Cell culture flasks with filter | TPP | 90026 | subcultivation of HUVEC in non-coated cell culture flasks of 25 cm2 surface |
| Centrifuge Allegra X-12R | Beckman Coulter Life Sciences | 392304 | spinning down of bacteria (volumes of > 2mL) |
| Centrifuge Allegra X-30 | Beckman Coulter Life Sciences | B06314 | spinning down of eukaryotic cells |
| Centrifuge Z 216 MK | Hermle | 305.00 V05 – Z 216 M | spinning down of bacteria (volumes of less than 2 mL) |
| Chloramphenicol | Carl Roth GmbH + Co. KG, Karlsruhe | 3886.2 | used in a concentration of 0.2 /mL for cultivation of pneumococci transformed with genetic construct carrying red fluorescent protein and chloramphenicol resistance cassette |
| Clamp for perfusion tubing | ibidi | 10821 | for holding the liquid in the tube bevor connecting the slide to the pump system |
| CO2-Incubator | Fisher Scientific | MIDI 40 | incubator size is perfectly adapted to teh size of the fluidic unit with connected channel slide and was used for flow cultivation at 37°C and 5% CO2 |
| CO2-Incubator | Sanyo | MCO-18 AIC | for incubation of bacteria and cells in a defined atmosphere at 5% CO2 and 37°C |
| Colombia blood agar plates | Becton Dickinson GmbH | PA-254005.06 | agar-based complex culture medium for S. pneumoniae supplemented with 7% sheep blood |
| Computer | Dell | Latitude 3440 | Comuter with pressure pump software |
| Confocal Laser Scanning Microscope (CLSM) | Leica | DMi8 | An inverse microscope with a stage covered by a heatable chamber and with a fluorescence unit equipped with fluorescence filter, Xenon-light source (SP8, DMi8) and DFC 365 FX Kamera (1392 x 1040, 1.4 Megapixel) |
| Di Potassium hydrogen phosphate (KH2PO4) | Carl Roth GmbH + Co. KG, Karlsruhe | 3904.1 | used for PBS buffer |
| Drying material | Merck | 101969 | orange silica beads for drying used in a glass bottle with a tubing adaptor |
| ECGM supplement Mix | Promocell | C-39215 | supplement mix for ECGM -medium, required for precultivation of endothelial cells: 0.02 mL/mL Fetal calf serum, 0.004 mL/ mL endothelial cell growth supplement, 0.1 ng / mL epidermal growth factor, 1 ng / mL basic fibroblast growth factor, 90 µg / mL heparin, 1 µg / mL Hydrocortisone |
| ECGMS | Promocell | C-22010 | ECGM supplemented with 5 % [w/w] FCS and 1 mM MgSO4 to increase cell adhesion |
| Endothelial Cell growth medium (ECGM, ready to use) | Promocell | C-22010 | culture medium of HUVECs, already supplemented with all components of the supplement mix |
| Fetal Calf Serum (FCS) | biochrome now Merck | S 0415 | supplement for cell culture, used for infection analyses |
| FITC-conjugated goat anti-human VWF antibody | Abcam | ab8822 | stock concentration: 10 mg/mL, for immunodetection of globular and multimerized VWF in flow |
| Fluidic Unit | ibidi | 10903 | fluidic unit for flow cultivation |
| Gelatin (porcine) | Sigma Aldrich | G-1890-100g | for precoating of microslide channel surface |
| histamine dihydrochloride | Sigma Aldrich | H-7250-10MG | for induction of VWF secretion from endothelial Weibel Palade Bodies |
| Human Umbilical Vein Endothelial Cell (HUVEC) | Promocell | C-12203 Lot-Nr. 396Z042 | primary endothelial cells from pooled donor, stored crypcoserved in liquid nitrogen |
| Human VWF-specific antibody derived from mouse (monoclonal) | Santa Cruz | sc73268 | stock concentration: 200 µg/mL for immunostaining of VWF in microfluidic slide after PFA fixation |
| Injection Port | ibidi | 10820 | for injection of histamin or bacteria into the reservoir tubing during the flow circulation |
| Light microscope | Zeiss | Axiovert 35M | inverse light microscope for control of eukaryotic cell detachement and cell counting using a 40 x water objective allowing 400 x magnification |
| Luer-slides I0.4 (ibiTreat472microslides) | ibidi | 80176 | physically modified slides for fludic cultivation (μ–Slide I0.4Luer with a channel hight of 0.4 mm, a channel volume of 100 μl, a growth area of 2.5 cm and a coating area of 25.4 cm2) suitable for all kinds of flow assay, the physical treatment generates a hydrophilic and adhesive surface. |
| Magnesium sulfate (MgSO4, unhydrated) | Sigma Aldrich | M7506-500G | For preparation of ECGMS medium |
| Microfluidic Pump | ibidi | 10905 | air pressure pump |
| Neubauer cell counting chamber | Karl Hecht GmbH&Co KG | 40442002 | microscopic counting chamber for HUVECs |
| Paraformaldehyde 16% (PFA) | Electron Microscopy Sciences | 15710-S | for cross linking of samples |
| Perfusion Set | ibidi | 10964 | Perfusion Set Yellow/Green has a tubing diameter of 1.6 mm, a tube length of 50 cm, a total working volume of 13.6 mL, a dead tube volume of 2.8 mL and a reservoir size of 10 mL. combined with the µ-slide L0.4Luer, at 37°C and a viscosity of 0.0072 dyn x s/cm2 a flow rate range of 3.8mL/min up to 33.9 mL/min and shear stress between 3.5 dyn/cm2 and 31.2 dyn/cm2 can be reached. with 50 cm lenght for microfluidic |
| Phosphate-buffered saline (PBS) | the solution was prepared using the following chemicals: 0.2 g/L KCl, 1.44 g/L Na2HPO4, 0.24 g/L KH2PO4 , pH 7.4 | ||
| Plastic cuvettes | Sarstedt | 67,741 | (2 x optic) for OD measurement at 600 nm |
| Pneumococcus-specific antiserum | Pineda | raised in rabbit using heat-inactivated Streptococcus pneumoniae NCTC10319 and D39, IgG-purified using proteinA-sepharose column. | |
| Polystyrene or Styrofoam plate | this is a precaution step to avoid cold stress on the cells seeded in the channel slides. Any type of styrofoam such as packaging box-material can be used. The plate might by 0.5 cm thick and should have a size of 20 cm2. | ||
| Potassium chloride (KCl) | Carl Roth GmbH + Co. KG, Karlsruhe | 6781.1 | used for PBS buffer |
| Pump Control Software (PumpControl v1.5.4) | ibidi | v1.5.4 | Computer software for controlling the pressure pump, setting the flow conditions and start/end the flow |
| reaction tubes 1.5/ 2.0mL | Sarstedt | 72.706/ 72.695.500 | required for antibody dilutions |
| reaction tubes with 50 mL volume | Sarstedt | 6,25,48,004 | |
| RFP-expressing pneumococci | National Collection of Type Cultures, Public Health England | 10,319 | Streptococcus pneumoniae serotype 47 expressing RFP fused to ahistone-like protein integrated into the genome |
| serological pipets 5, 10 mL | Sarstedt | 86.1253.025/ 86.1254.025 | for pipeting larger volumes |
| Sodium Carbonate (Na2CO3, water free) | Sigma Aldrich | 451614-25G | for preparation of 100 mM Sodium Carbonate buffer |
| Sodium dihydrogen phosphate (NaH2PO4) | Carl Roth GmbH + Co. KG, Karlsruhe | P030.2 | used for PBS buffer |
| Spectral Photometer Libra S22 | Biochrom | 80-2115-20 | measurement of optical density (OD) of bacterial suspension at 600 nm |
| Sucrose | Sigma Aldrich | S0389-500G | for preparation of blocking buffer |
| Triton X-100 | Sigma Aldrich | T9284-500ML | Used in 0.1% end concentration diluted in dH20 for eukaryotic cell permeabilization after PFA fixation |
| Yeast extract | oxoid | LP0021 | bacteria are cultivated in THB supplement with 1% [w/w] yeast extract = complete bacterial cultivation medium THY |
Riferimenti
- Weiser, J. N., Ferreira, D. M., Paton, J. C. Streptococcus pneumoniae: transmission, colonization and invasion. Nature Reviews Microbiology. 16 (6), 355-367 (2018).
- Bergmann, S., Hammerschmidt, S. Versatility of pneumococcal surface proteins. Microbiology. 152, 295-303 (2006).
- Bergmann, S., et al. Integrin-linked kinase is required for vitronectin-mediated internalization of Streptococcus pneumoniae by host cells. Journal of Cell Science. 122, 256-267 (2009).
- Bergmann, S., Schoenen, H., Hammerschmidt, S. The interaction between bacterial enolase and plasminogen promotes adherence of Streptococcus pneumoniae to epithelial and endothelial cells. International Journal of Medical Microbiology. 303, 452-462 (2013).
- Bergmann, S., Rohde, M., Chhatwal, G. S., Hammerschmidt, S. Alpha-enolase of Streptococcus pneumoniae is a plasmin(ogen)-binding protein displayed on the bacterial cell surface. Molecular Microbiology. 40, 1273-1287 (2001).
- Bergmann, S., et al. Identification of a novel plasmin(ogen)-binding motif in surface displayed alpha-enolase of Streptococcus pneumoniae. Molecular Microbiology. 49, 411-423 (2003).
- Bergmann, S., Rohde, M., Preissner, K. T., Hammerschmidt, S. The nine residue plasminogen-binding motif of the pneumococcal enolase is the major cofactor of plasmin-mediated degradation of extracellular matrix, dissolution of fibrin and transmigration. Thrombosis and Haemostasis. 94, 304-311 (2005).
- Jagau, H., et al. Von willebrand factor mediates pneumococcal aggregation and adhesion in flow. Frontiers in Microbiology. 10, 511 (2019).
- Tischer, A., et al. Enhanced local disorder in a clinically elusive von willebrand factor provokes high-affinity platelet clumping. Journal of Molecular Biology. 429, 2161-2177 (2017).
- Ruggeri, Z. M. Structure of von willebrand factor and its function in platelet adhesion and thrombus formation. Best Practice Research Clinical Haematology. 14, 257-279 (2001).
- Spiel, A. O., Gilbert, J. C., Jilma, B. Von willebrand factor in cardiovascular disease: Focus on acute coronary syndromes. Circulation. 117, 1449-1459 (2008).
- Springer, T. A. Von Willebrand factor, Jedi knight of the bloodstream. Blood. 124, 1412-1425 (2014).
- Luttge, M., et al. Streptococcus pneumoniae induces exocytosis of weibel-palade bodies in pulmonary endothelial cells. Cellular Microbiology. 14, 210-225 (2012).
- Cornish, R. J. Flow in a Pipe of Rectangular Cross-Section. Proceedings of the Royal Society A. 786, 691-700 (1928).
- Michels, A., Swystun, L. L., Mewburn, J., Albánez, S., Lillicrap, D. Investigating von Willebrand Factor Pathophysiology Using a Flow Chamber Model of von Willebrand Factor-platelet String Formation. Journal of Visualized Experiments. 14 (126), (2017).
- Kjos, M., et al. fluorescent Streptococcus pneumoniae for live-cell imaging of host-pathogen interactions. Journal of Bacteriology. 197, 807-818 (2015).
- Bergmann, S., Steinert, M. From single cells to engineered and explanted tissues: New perspectives in bacterial infection biology. International Reviews of Cell and Molecular Biology. 319, 1-44 (2015).
- Harrison, D. J., et al. Micromachining a miniaturized capillary electrophoresis-based chemical analysis system on a chip. Science. 261 (5123), 895-897 (1993).
- Magnusson, M. K., Mosher, D. F. Fibronectin: Structure, assembly, and cardiovascular implications. Arteriosclerosis, Thrombosis, and Vascular Biology. 18, 1363-1370 (1998).
- Zerlauth, G., Wolf, G. Plasma fibronectin as a marker for cancer and other diseases. The American Journal of Medicine. 77 (4), 685-689 (1984).
- Li, X. J., Valadez, A. V., Zuo, P., Nie, Z. 2012. Microfluidic 3D cell culture: potential application for tissue-based bioassays. Bioanalysis. 4, 1509-1525 (2019).
- Fiddes, L. K., et al. A circular cross-section PDMS microfluidics system for replication of cardiovascular flow conditions. Biomaterials. 31, 3459-3464 (2010).
- Schimek, K., et al. Integrating biological vasculature into a multi-organ-chip microsystem. Lab on a Chip. 13, 3588-3598 (2013).
- Pappelbaum, K. I., et al. Ultralarge von willebrand factor fibers mediate luminal Staphylococcus aureus adhesion to an intact endothelial cell layer under shear stress. Circulation. 128, 50-59 (2013).
- Schneider, S. W., et al. Shear-induced unfolding triggers adhesion of von willebrand factor fibers. Proceedings of the National Academy of Sciences of the United States of America. 104, 7899-7903 (2007).
- Reneman, R. S., Hoek, A. P. G. Wall shear stress as measured in vivo: consequences for the design of the arterial system. Medical & Biological Engineering & Computing. 46 (5), 499-507 (2008).
- Valentijn, K. M., Sadler, J. E., Valentijn, J. A., Voorberg, J., Eikenboom, J. Functional architecture of Weibel- Palade bodies. Blood. 117, 5033-5043 (2011).
- Freshney, R. I. . Culture of animal cells: A manual of basic Technique, 5th edition. , (2005).
- Shaw, J. A., Shaw, A. J. . Epithelial cell culture- a practical approach. , 218 (1996).
- Elm, C., et al. Ectodomains 3 and 4 of human polymeric Immunoglobulin receptor (hpIgR) mediate invasion of Streptococcus pneumoniae into the epithelium. Journal of Biological Chemistry. 279 (8), 6296-6304 (2004).
- Nerlich, A., et al. Invasion of endothelial cells by tissue-invasive M3 type group A streptococci requires Src kinase and activation of Rac1 by a phosphatidylinositol 3-kinase-independent mechanism. Journal of Biological Chemistry. 284 (30), 20319-20328 (2009).
- Ho, C. T., et al. Liver-cell patterning lab chip: mimicking the morphology of liver lobule tissue. Lab on a Chip. 13, 3578-3587 (2013).
- Huh, D., et al. Reconstituting organ-level lung functions on a chip. Science. 328, 1662-1668 (2010).
- Harink, B., Le Gac, S., Truckenmuller, R., van Blitterswijk, C., Habibovic, P. Regeneration-on-a-chip? The perspectives on use of microfluidics in regenerative medicine. Lab on a Chip. 13, 3512-3528 (2013).

