Bestemme den funksjonelle statusen til kortikospinalkanalen innen en uke etter slag
Summary
Denne protokollen er for evaluering av kortikospinaltractfunksjon innen 1 uke etter slag. Den kan brukes til å velge og stratifisere pasienter i studier av intervensjoner designet for å forbedre øvre lem motorutvinning og resultater og i klinisk praksis for å forutsi øvre lem funksjonelle utfall 3 måneder etter hjerneslag.
Abstract
Høy interindividuell variasjon i utvinning av øvre lem (UL) funksjon etter hjerneslag betyr at det er vanskelig å forutsi en persons potensial for utvinning basert på kliniske vurderinger alene. Den funksjonelle integriteten til kortikospinalkanalen er en viktig prognostisk biomarkør for gjenoppretting av UL-funksjon, spesielt for de med alvorlig innledende UL-svekkelse. Denne artikkelen presenterer en protokoll for evaluering av kortikospinaltractfunksjon innen 1 uke etter slag. Denne protokollen kan brukes til å velge og stratifisere pasienter i studier av intervensjoner designet for å forbedre UL motorutvinning og resultater etter hjerneslag. Protokollen er også en del av PREP2-algoritmen, som forutsier UL-funksjon for individuelle pasienter 3 måneder etter hjerneslag. Algoritmen kombinerer sekvensielt en UL styrkevurdering, alder, transkraniell magnetisk stimulering og hjerneslagalvorlighetsgrad, innen få dager etter slaget. Fordelene ved å bruke PREP2 i klinisk praksis er beskrevet andre steder. Denne artikkelen fokuserer på bruk av en UL styrkevurdering og transkraniell magnetisk stimulering for å evaluere kortikospinaltractfunksjon.
Introduction
Øvre lem funksjon er vanligvis svekket etter hjerneslag, og utvinning av UL funksjon er viktig for å gjenvinne uavhengighet i daglige leveaktiviteter1. Stroke rehabilitering studier er ofte rettet mot å forbedre UL utvinning og resultater etter hjerneslag. Flertallet av hjerneslag rehabilitering forskning utføres med pasienter på kronisk stadium (> 6 måneder etter hjerneslag), men de fleste rehabilitering oppstår tidlig etter hjerneslag2,3. Mer forskning må utføres med pasienter kort tid etter et slag for å bygge et bevisgrunnlag for rehabiliteringspraksis.
En av de største utfordringene ved å gjennomføre forskning kort tid etter slaget er å oppdage effekten av intervensjonen mot bakgrunnen av utvinning som oppstår i løpet av de første ukene og månedene etter slaget. Høy intersubject variabilitet i klinisk presentasjon og utvinning skaper støy som kan skjule de gunstige effektene av intervensjoner. Intervensjons- og kontrollgrupper er vanligvis balansert på kliniske tiltak for innledende nevrologisk svekkelse. Imidlertid er disse tiltakene ofte dårlige prediktorer for pasientens potensial for påfølgende utvinning, spesielt de med alvorlig innledende svekkelse4,5. Dette betyr at grupper kan matches for kliniske mål ved baseline og ikke samsvares for restitusjonspotensialet, noe som gjør det vanskeligere å fastslå intervensjonens effekter. Biomarkører kan løse denne utfordringen ved å identifisere en enkelt pasients potensial for motorgjenoppretting, slik at grupper kan samsvares nøyaktig og stratifiseres6,7,8. Biomarkører kan også brukes til å velge pasienter som mest sannsynlig reagerer på intervensjonens kjente eller hypotetiske virkningsmekanismer6.
Den funksjonelle integriteten til kortikospinalkanalen (CST) er en viktig biomarkør som forutsier utvinning av UL-funksjon etter slag5,8,9,10,11,12. CST formidler synkende motoreffekt fra den primære motorcortex til ryggmargen og er avgjørende for koordinering og fin motorkontroll. Pasienter med funksjonell CST etter hjerneslag er mer sannsynlig å gjenvinne styrke, koordinering og fingerferdighet enn pasienter uten. En klinisk vurdering kan være tilstrekkelig til å bekrefte at CST er funksjonell hos mildt svekkede pasienter13,14,15. Pasienter med mer alvorlig innledende svekkelse kan imidlertid eller ikke har en funksjonell CST, og en nevrofysiologisk vurdering ved hjelp av transkraniell magnetisk stimulering (TMS) er nødvendig9,10,11,16,17.
TMS er en ikke-invasiv og smertefri teknikk som kan brukes til å teste CST-funksjon18. TMS-spolen gir en magnetisk stimulans over den primære motorcortex som genererer en synkende volley i CST, som fremkaller et motor-fremkalt potensial (MEP) i musklene i det kontralateralelem19. Tilstedeværelsen av en MEP i den pariske armen eller hånden (MEP+) indikerer en funksjonell CST og er forbundet med større potensial for utvinning av UL-funksjonen. Pasienter som er MEP- er mest sannsynlig å ha verre UL utvinning, uten retur av koordinert og dexterous hånd funksjon4,6,9,12,16.
Testing av alle pasienter med TMS er upraktisk og unødvendig, da de med mild innledende svekkelse mest sannsynlig har en funksjonell CST17. Derfor er det nødvendig med en hierarkisk tilnærming slik at TMS bare brukes til pasienter med mer alvorlig innledende svekkelse. PREP2-algoritmen ble utviklet ved hjelp av en kombinasjon av kliniske tiltak og TMS for å evaluere CST-funksjonen og forutsi sannsynlig UL-utfall ved 3 måneders etterslag (figur 1)17. PREP2 starter på dag 3 etter slag ved å teste styrken av skulder bortføring og finger forlengelse i paretic arm (SAFE score), ved hjelp av Medical Research Council karakterer. Hvis summen av disse karakterene er 5 eller mer av 10, er det “trygt” å anta at pasienten er MEP +. Disse pasientene forventes å ha et godt eller utmerket UL-utfall med 3 måneders etterslag, avhengig av deres alder17. Disse pasientene trenger ikke TMS for å bestemme MEP-status, minimere kostnader og unødvendig testing for pasienten.
Pasienter med en SIKKER score på mindre enn 5 på dag 3 poststroke krever TMS for å bestemme den funksjonelle integriteten til cst. Hvis en MEP kan fremkalles fra den pariske extensor carpi radialis (ECR) eller første dorsal interosseus (FDI) muskler, pasienten er MEP + og forventes å gjenopprette fin motor kontroll av hånden med 3 måneder etterslag. Omtrent halvparten av pasientene med sikker score mindre enn 5 på dag 3 poststroke er MEP +. Viktigere, pasienter kan ha en SAFE score så lavt som null og være MEP +. Dette illustrerer behovet for TMS i denne undergruppen av pasienter, da klinisk vurdering alene ikke kan skille mellom pasienter med og uten funksjonell CST. Pasienter som er MEP- har betydelig CST skade. Disse pasientene forventes å ha et begrenset eller dårlig UL funksjonsresultat avhengig av deres totale hjerneslag alvorlighetsgrad, målt med National Institute of Health Stroke Scale (NIHSS) (Figur 1)17. Disse MEP-pasientene forventes ikke å gjenvinne koordinert og fingerkontroll og kan grupperes sammen for forskningsformål.
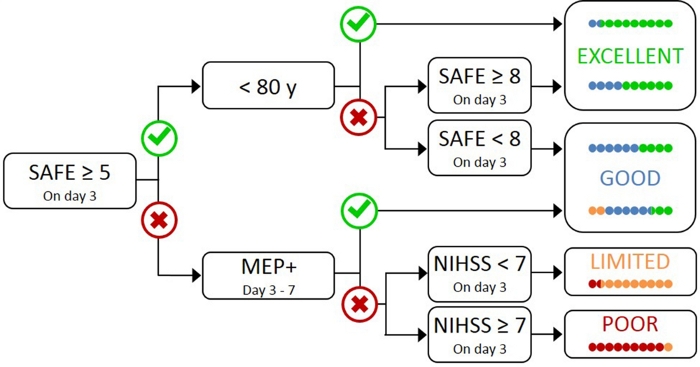
Figur 1: PREP2-algoritmen. SAFE = Skulderbortføring, Finger Extension score, som er summen av Medical Research Council karakterer for hver av disse bevegelsene ut av 5, for en total SAFE score av 10. MEP+ = Motor Evoked Potentials kan fremkalles fra den pariske extensor carpi radialis (ECR) og/eller første dorsal interosseous (FDI) muskler i paretic UL ved hjelp av transkraniell magnetisk stimulering. NIHSS = Nasjonale institutter for helseslagskala. Algoritmen forutsier ett av fire mulige UL funksjonelle resultater ved 3 måneder etter slag. Hver prediksjonskategori er forbundet med et rehabiliteringsfokus som kan brukes til å skreddersy UL terapi2. De fargede prikkene representerer proporsjonalt PREP2 algoritmenøyaktighet. Prikkene er fargekodet basert på resultatkategorien oppnådde faktisk 3 måneder etter slag (Grønn = Utmerket; Blå = Bra; Oransje = Begrenset; Rød = Dårlig). Figur gjengitt fra Stinear et al.17. Vennligst klikk her for å vise en større versjon av dette tallet.
I klinisk praksis forutsier PREP2 en av fire utfallskategorier som kan brukes til å skreddersy rehabilitering for individuelle pasienter og hjelpe pasienter og familier til å forstå hva de kan forvente for ul-gjenopprettingen. Til dags dato er PREP2 det eneste eksternt validerte UL prediksjonsverktøyet som kombinerer klinisk vurdering og biomarkørinformasjon i etbeslutningstre 17. Det er også det eneste UL prediksjonsverktøyet med forskning på effekten av implementering i klinisk praksis20,21. PREP2 spådommer er nøyaktige for ca 75% av pasientene, for optimistisk ei 17% og for pessimistisk for 8% av pasientene ved 3 måneder etter slag17. Nøyaktigheten er høyest for MEP-pasienter (nøyaktig for 90% av MEP-pasienter), og fremhever verdien av å bruke TMS for å identifisere disse pasientene med alvorlig skade på de synkende motorbanene17. PREP2 forblir riktig for rundt 80% av pasientene ved 2 år etter slag22. Dette støtter bruk av PREP2 for å forutsi UL funksjonelle motorutfall på 3 måneder og lengre sikt. Informasjon om levering av PREP2-spådommer og bruk av dem i klinisk praksis er utenfor omfanget av denne metoden papir, men detaljerte ressurser er tilgjengelig online23.
PREP2 gir forskere et verktøy for å velge og stratifisere pasienter for kliniske studier. Dette gjør at pasienter kan grupperes ikke bare i henhold til kliniske egenskaper ved baseline, men også deres nevrobiologiske potensial for UL-gjenoppretting. Til tross for monteringsbevis for bruk av TMS som en prognostisk biomarkør for UL utvinning, mangel på kjennskap til TMS protokoller i sykehusinnstillinger med subakutt hjerneslag pasienter kan være en barriere for bruk i forskning. Derfor har denne protokollen som mål å demonstrere hvordan du bruker SAFE-poengsummen og TMS til å evaluere CST-funksjonen hos pasienter i en sykehusinnstilling tidlig etter hjerneslag.
Protocol
Representative Results
Discussion
CST-funksjonen evaluert med MEP-status er en viktig prognostisk biomarkør for UL-gjenoppretting og utfall etter slag. Totalt 95% av pasientene med en funksjonell CST på 1 uke etterslag oppnå en Action Research Arm Test (ARAT) score på minst 34 av 57 av 3 måneder etter slag17. Omvendt, 100% av pasientene uten en funksjonell CST på 1 uke etterslag oppnå en ARAT score på mindre enn 34 av 3 måneder etter slag17. Evaluering av CST-funksjon innen en uke poststroke kan fo…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
Forfatterne takker professor Winston Byblow og Harry Jordan for deres verdifulle bidrag til dette arbeidet. Dette arbeidet ble finansiert av Health Research Council of New Zealand.
Materials
| alcohol/skin cleansing wipes | Reynard | alcohol prep pads | |
| electromyography electrodes | 3M | red dot electrodes | |
| Magstim TMS coil | Magstim | flat figure-8 coil | |
| razors | any | ||
| skin prep tape | 3M | red dot skin prep tape | |
| TMS stimulator | Magstim | Magstim 200 single pulse stimulator |
Riferimenti
- Veerbeek, J. M., Kwakkel, G., van Wegen, E. E., Ket, J. C., Heymans, M. W. Early prediction of outcome of activities of daily living after stroke: a systematic review. Stroke. 42 (5), 1482-1488 (2011).
- Lohse, K. R., Schaefer, S. Y., Raikes, A. C., Boyd, L. A., Lang, C. E. Asking New Questions with Old Data: The Centralized Open-Access Rehabilitation Database for Stroke. Frontiers in Neurology. 7, 153 (2016).
- Stinear, C., Ackerley, S., Byblow, W. Rehabilitation is initiated early after stroke, but most motor rehabilitation trials are not: a systematic review. Stroke. 44 (7), 2039-2045 (2013).
- Stinear, C. M. Prediction of recovery of motor function after stroke. Lancet Neurology. 9 (12), 1228-1232 (2010).
- Byblow, W. D., Stinear, C. M., Barber, P. A., Petoe, M. A., Ackerley, S. J. Proportional recovery after stroke depends on corticomotor integrity. Annals of Neurology. 78 (6), 848-859 (2015).
- Stinear, C. M. Prediction of motor recovery after stroke: advances in biomarkers. Lancet Neurology. 16 (10), 826-836 (2017).
- Kim, B., Winstein, C. Can Neurological Biomarkers of Brain Impairment Be Used to Predict Poststroke Motor Recovery? A Systematic Review. Neurorehabilitation and Neural Repair. 31 (1), 3-24 (2016).
- Boyd, L. A., et al. Biomarkers of stroke recovery: Consensus-based core recommendations from the Stroke Recovery and Rehabilitation Roundtable. International Journal of Stroke. 12 (5), 480-493 (2017).
- Escudero, J. V., Sancho, J., Bautista, D., Escudero, M., Lopez-Trigo, J. Prognostic value of motor evoked potential obtained by transcranial magnetic brain stimulation in motor function recovery in patients with acute ischemic stroke. Stroke. 29 (9), 1854-1859 (1998).
- Pennisi, G., et al. Absence of response to early transcranial magnetic stimulation in ischemic stroke patients: prognostic value for hand motor recovery. Stroke. 30 (12), 2666-2670 (1999).
- Rapisarda, G., Bastings, E., de Noordhout, A. M., Pennisi, G., Delwaide, P. J. Can motor recovery in stroke patients be predicted by early transcranial magnetic stimulation?. Stroke. 27 (12), 2191-2196 (1996).
- Bembenek, J. P., Kurczych, K., Karli Nski, M., Czlonkowska, A. The prognostic value of motor-evoked potentials in motor recovery and functional outcome after stroke – a systematic review of the literature. Functional Neurology. 27 (2), 79-84 (2012).
- Smania, N., et al. Active finger extension: a simple movement predicting recovery of arm function in patients with acute stroke. Stroke. 38 (3), 1088-1090 (2007).
- Nijland, R. H., van Wegen, E. E., Harmeling-van der Wel, B. C., Kwakkel, G. EPOS Investigators. Presence of finger extension and shoulder abduction within 72 hours after stroke predicts functional recovery: early prediction of functional outcome after stroke: the EPOS cohort study. Stroke. 41 (4), 745-750 (2010).
- Katrak, P., et al. Predicting upper limb recovery after stroke: the place of early shoulder and hand movement. Archives of Physical Medicine and Rehabilitation. 79 (7), 758-761 (1998).
- Stinear, C. M., Barber, P. A., Petoe, M., Anwar, S., Byblow, W. D. The PREP algorithm predicts potential for upper limb recovery after stroke. Brain. 135 (Pt 8), 2527-2535 (2012).
- Stinear, C. M., et al. PREP2: A biomarker-based algorithm for predicting upper limb function after stroke. Annals of Clinical and Translational Neurology. 4 (11), 811-820 (2017).
- Groppa, S., et al. A practical guide to diagnostic transcranial magnetic stimulation: report of an IFCN committee. Clinical Neurophysiology. 123 (5), 858-882 (2012).
- Barker, A. T., Jalinous, R., Freeston, I. L. Non-invasive magnetic stimulation of human motor cortex. Lancet. 1 (8437), 1106-1107 (1985).
- Stinear, C. M., Byblow, W. D., Ackerley, S. J., Barber, P. A., Smith, M. C. Predicting Recovery Potential for Individual Stroke Patients Increases Rehabilitation Efficiency. Stroke. 48 (4), 1011-1019 (2017).
- Connell, L. A., Smith, M. C., Byblow, W. D., Stinear, C. M. Implementing biomarkers to predict motor recovery after stroke. NeuroRehabilitation. 43 (1), 41-50 (2018).
- Smith, M. C., Ackerley, S. J., Barber, P. A., Byblow, W. D., Stinear, C. M. PREP2 Algorithm Predictions Are Correct at 2 Years Poststroke for Most Patients. Neurorehabilitation and Neural Repair. 33 (8), 635-642 (2019).
- Rossi, S., Hallett, M., Rossini, P. M., Pascual-Leone, A. Safety, ethical considerations, and application guidelines for the use of transcranial magnetic stimulation in clinical practice and research. Clinical Neurophysiology. 120 (12), 2008-2039 (2009).
- Talelli, P., Greenwood, R. J., Rothwell, J. C. Arm function after stroke: neurophysiological correlates and recovery mechanisms assessed by transcranial magnetic stimulation. Clinical Neurophysiology. 117 (8), 1641-1659 (2006).

