Определение функционального состояния Кортикоспинального тракта в течение одной недели после инсульта
Summary
Этот протокол предназначен для оценки функции кортикоспинального тракта в течение 1 недели после инсульта. Он может быть использован для отбора и расслоения пациентов в испытаниях мероприятий, направленных на улучшение восстановления верхних конечностей двигателя и результатов и в клинической практике для прогнозирования верхних конечностей функциональных исходов 3 месяцев после инсульта.
Abstract
Высокая межиндивидуальная изменчивость в восстановлении функции верхней конечности (UL) после инсульта означает, что трудно предсказать потенциал человека для восстановления на основе клинических оценок в одиночку. Функциональная целостность кортикоспинального тракта является важным прогностический биомаркер для восстановления функции UL, особенно для тех, кто с тяжелыми первоначальными нарушениями UL. В этой статье представлен протокол для оценки функции кортикоспинального тракта в течение 1 недели после инсульта. Этот протокол может быть использован для отбора и стратификации пациентов в испытаниях мероприятий, направленных на улучшение UL восстановления двигателя и результаты после инсульта. Протокол также является частью алгоритма PREP2, который предсказывает функцию UL для отдельных пациентов 3 месяца после инсульта. Алгоритм последовательно сочетает в себе UL оценки силы, возраст, транскраниальной магнитной стимуляции, и тяжесть инсульта, в течение нескольких дней после инсульта. Преимущества использования PREP2 в клинической практике описаны в других местах. В этой статье основное внимание уделяется использованию оценки силы UL и транскраниальной магнитной стимуляции для оценки функции кортикоспинального тракта.
Introduction
Функция верхних конечностей обычно нарушается после инсульта, и восстановление функции UL имеет важное значение для восстановления независимости в повседневной жизни деятельности1. Инсульт реабилитационные испытания часто направлены на улучшение UL восстановления и результаты после инсульта. Большинство исследований реабилитации инсульта проводится с пациентами на хронической стадии (Зgt;6 месяцев после инсульта), но большинство реабилитации происходит рано после инсульта2,3. Необходимы дополнительные исследования с пациентами вскоре после инсульта, чтобы создать доказательную базу для реабилитационной практики.
Одной из самых больших проблем при проведении исследований вскоре после инсульта является выявление последствий вмешательства на фоне восстановления, происходящего в первые недели и месяцы после инсульта. Высокая межсубъектная изменчивость в клинической презентации и восстановлении создает шум, который может скрыть благотворное воздействие вмешательств. Интервенционные и контрольные группы, как правило, сбалансированы по клиническим показателям первоначальных неврологических нарушений. Тем не менее, эти меры часто плохо предсказателей потенциал пациента для последующего выздоровления, особенно с тяжелыми первоначальными нарушениями4,5. Это означает, что группы могут быть сопоставлены для базовых клинических мер и не совпадают с их потенциалом восстановления, что затрудняет установление последствий вмешательства. Биомаркеры могут решить эту проблему, определив потенциал индивидуального пациента для восстановления двигателя, так что группы могут быть точно подобраны и стратифицированы6,7,8. Биомаркеры также могут быть использованы для выбора пациентов, которые, скорее всего, реагировать на известные или гипотетические механизмы действия6вмешательства.
Функциональная целостность кортикоспинального тракта (CST) является ключевым биомаркером, который предсказывает восстановление функции UL после инсульта5,8,9,10,11,12. CST передает нисходящий двигатель от первичной моторной коры к спинному мозгу и имеет важное значение для координации и мелкого управления мотором. Пациенты с функциональным CST после инсульта, скорее всего, восстановить силы, координацию и ловкость, чем пациенты без. Клиническая оценка может быть достаточно, чтобы подтвердить, что CST является функциональным в слабо поврежденных пациентов13,14,15. Тем не менее, пациенты с более тяжелыми первоначальными нарушениями могут или не могут иметь функциональный КНТ, и нейрофизиологическая оценка с использованием транскраниальной магнитной стимуляции (TMS) необходимо9,10,11,16,17.
TMS является неинвазивной и безболезненной техникой, которая может быть использована для тестирования функции CST18. Катушка TMS обеспечивает магнитный стимул над первичной моторной коры, которая генерирует нисходящий залп в CST, вызывая двигательно-вызванный потенциал (MEP) в мышцах контралатеральной конечности19. Присутствие MEP в подпорной руке или руке (MEP) указывает на функциональный CST и связано с большим потенциалом для восстановления функции UL. Пациенты, которые MEP-, скорее всего, хуже UL восстановления, без возврата скоординированных и ловкий функции рук4,6,9,12,16.
Тестирование всех пациентов с TMS является непрактичным и ненужным, так как те, с легким первоначальным нарушением, скорее всего, имеют функциональный CST17. Поэтому необходим иерархический подход, чтобы TMS использовался только для пациентов с более тяжелыми первоначальными нарушениями. Алгоритм PREP2 был разработан с использованием комбинации клинических мер и TMS для оценки функции CST и прогнозирования вероятного исхода UL на 3 месяца после инсульта(рисунок 1)17. PREP2 начинается в день 3 после инсульта, проверяя силу похищения плеча и расширение пальца в paretic руку (SAFE оценка), используя медицинские исследования Совета классов. Если сумма этих оценок составляет 5 или более из 10, то «безопасно» считать, что пациент является MEP. Эти пациенты, как ожидается, имеют хороший или отличный результат UL на 3 месяца после инсульта, в зависимости от их возраста17. Эти пациенты не нуждаются в TMS для определения статуса MEP, минимизации затрат и ненужных испытаний для пациента.
Пациенты с SAFE оценка менее 5 на 3 день после инсульта требуют TMS, чтобы определить функциональную целостность их CST. Если MEP может быть извлечен из паретического разгибателя карпи радиалис (ECR) или первый спинной межосеус (ПИИ) мышцы, пациент MEP и, как ожидается, восстановить мелкий двигатель управления рукой на 3 месяца после инсульта. Приблизительно половина пациентов с SAFE оценка менее 5 на 3 день после инсульта являются MEP. Важно отметить, что пациенты могут иметь показатель SAFE как минимум до нуля и быть MEP. Это иллюстрирует необходимость TMS в этой подгруппе пациентов, так как клиническая оценка сама по себе не может различать пациентов с функциональным КНТ и без нее. Пациенты, которые MEP-имеют значительные повреждения CST. Эти пациенты, как ожидается, имеют ограниченный или плохой UL функциональный результат в зависимости от их общей тяжести инсульта, измеряется с Национальным институтом здравоохранения инсульта шкалы (NIHSS) (Рисунок 1)17. Эти MEP-пациенты, как ожидается, не восстановить скоординированный и ловкий контроль пальцев и могут быть сгруппированы вместе для исследовательских целей.
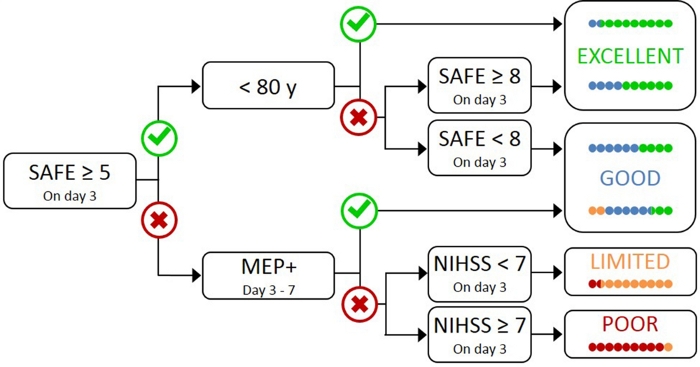
Рисунок 1: Алгоритм PREP2. SAFE – Похищение плеча, оценка расширения пальца, которая является суммой оценки Медицинского исследовательского совета для каждого из этих движений из 5, для общего балла SAFE из 10. MeP – Мотор Вызывает потенциалы могут быть получены из паретического разгибателя карпи радиалис (ECR) и / или первый спинной межзосевых (ПИИ) мышцы партерического UL с помощью транскраниальной магнитной стимуляции. NIHSS – Национальные институты шкалы инсульта здоровья. Алгоритм предсказывает один из четырех возможных функциональных исходов UL на 3 месяца после инсульта. Каждая категория предсказания связана с реабилитационным фокусом, который может быть использован для адаптации UL терапии2. Цветные точки представляют пропорционально точность алгоритма PREP2. Точки цветокодирования на основе результата категории на самом деле достигнута 3 месяца после инсульта (Зеленый и Отлично; Синий й хороший; Оранжевый и ограниченный; Красный й бедный). Рисунок, воспроизведенный из Stinear et al.17. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
В клинической практике, PREP2 предсказывает одну из четырех категорий результатов, которые могут быть использованы для адаптации реабилитации для отдельных пациентов и помочь пациентам и семьям понять, что они могут ожидать для их восстановления UL. На сегодняшний день PREP2 является единственным внешне проверенным инструментом прогнозирования UL, который сочетает в себе клиническую оценку и информацию о биомаркерах в дереве решений17. Это также единственный инструмент прогнозирования UL с исследованием о влиянии реализации в клинической практике20,21. PREP2 прогнозы точны для около 75% пациентов, слишком оптимистично для 17% и слишком пессимистично для 8% пациентов в 3 месяца после инсульта17. Точность является самым высоким для MEP-пациентов (точный для 90% MEP-пациентов), подчеркивая ценность использования TMS для выявления этих пациентов с серьезным повреждением нисходящих путей двигателя17. PREP2 остается правильным для около 80% пациентов в 2 года после инсульта22. Это поддерживает использование PREP2 для прогнозирования функциональных результатов UL двигателя на 3 месяца и более длительный срок. Информация о предоставлении preP2 прогнозы и их использование в клинической практике выходит за рамки этого метода бумаги, но подробные ресурсы доступны онлайн23.
PREP2 предоставляет исследователям инструмент для отбора и стратификации пациентов для клинических испытаний. Это позволяет пациентам быть сгруппированы не только в соответствии с базовыми клиническими характеристиками, но и их нейробиологический потенциал для восстановления UL. Несмотря на растущие доказательства использования TMS в качестве прогностический биомаркер для восстановления UL, отсутствие знакомства с протоколами TMS в больничных условиях с подострым инсультом пациентов может быть препятствием для его использования в исследованиях. Таким образом, этот протокол призван продемонстрировать, как использовать балл SAFE и TMS для оценки функции CST у пациентов в больнице настройки на ранних стадиях после инсульта.
Protocol
Representative Results
Discussion
Функция CST, оцениваемый со статусом MEP, является ключевым прогностический биомаркер для восстановления UL и результата после инсульта. В общей сложности 95% пациентов с функциональным CST на 1 неделю послеинсульта достичь действий исследований Arm Test (ARAT) оценка по крайней мере 34 из 57 на 3 меся…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
Авторы благодарят профессора Уинстона Байблоу и Гарри Джордана за их ценный вклад в эту работу. Эта работа финансировалась Советом по исследованиям в области здравоохранения Новой Зеландии.
Materials
| alcohol/skin cleansing wipes | Reynard | alcohol prep pads | |
| electromyography electrodes | 3M | red dot electrodes | |
| Magstim TMS coil | Magstim | flat figure-8 coil | |
| razors | any | ||
| skin prep tape | 3M | red dot skin prep tape | |
| TMS stimulator | Magstim | Magstim 200 single pulse stimulator |
Riferimenti
- Veerbeek, J. M., Kwakkel, G., van Wegen, E. E., Ket, J. C., Heymans, M. W. Early prediction of outcome of activities of daily living after stroke: a systematic review. Stroke. 42 (5), 1482-1488 (2011).
- Lohse, K. R., Schaefer, S. Y., Raikes, A. C., Boyd, L. A., Lang, C. E. Asking New Questions with Old Data: The Centralized Open-Access Rehabilitation Database for Stroke. Frontiers in Neurology. 7, 153 (2016).
- Stinear, C., Ackerley, S., Byblow, W. Rehabilitation is initiated early after stroke, but most motor rehabilitation trials are not: a systematic review. Stroke. 44 (7), 2039-2045 (2013).
- Stinear, C. M. Prediction of recovery of motor function after stroke. Lancet Neurology. 9 (12), 1228-1232 (2010).
- Byblow, W. D., Stinear, C. M., Barber, P. A., Petoe, M. A., Ackerley, S. J. Proportional recovery after stroke depends on corticomotor integrity. Annals of Neurology. 78 (6), 848-859 (2015).
- Stinear, C. M. Prediction of motor recovery after stroke: advances in biomarkers. Lancet Neurology. 16 (10), 826-836 (2017).
- Kim, B., Winstein, C. Can Neurological Biomarkers of Brain Impairment Be Used to Predict Poststroke Motor Recovery? A Systematic Review. Neurorehabilitation and Neural Repair. 31 (1), 3-24 (2016).
- Boyd, L. A., et al. Biomarkers of stroke recovery: Consensus-based core recommendations from the Stroke Recovery and Rehabilitation Roundtable. International Journal of Stroke. 12 (5), 480-493 (2017).
- Escudero, J. V., Sancho, J., Bautista, D., Escudero, M., Lopez-Trigo, J. Prognostic value of motor evoked potential obtained by transcranial magnetic brain stimulation in motor function recovery in patients with acute ischemic stroke. Stroke. 29 (9), 1854-1859 (1998).
- Pennisi, G., et al. Absence of response to early transcranial magnetic stimulation in ischemic stroke patients: prognostic value for hand motor recovery. Stroke. 30 (12), 2666-2670 (1999).
- Rapisarda, G., Bastings, E., de Noordhout, A. M., Pennisi, G., Delwaide, P. J. Can motor recovery in stroke patients be predicted by early transcranial magnetic stimulation?. Stroke. 27 (12), 2191-2196 (1996).
- Bembenek, J. P., Kurczych, K., Karli Nski, M., Czlonkowska, A. The prognostic value of motor-evoked potentials in motor recovery and functional outcome after stroke – a systematic review of the literature. Functional Neurology. 27 (2), 79-84 (2012).
- Smania, N., et al. Active finger extension: a simple movement predicting recovery of arm function in patients with acute stroke. Stroke. 38 (3), 1088-1090 (2007).
- Nijland, R. H., van Wegen, E. E., Harmeling-van der Wel, B. C., Kwakkel, G. EPOS Investigators. Presence of finger extension and shoulder abduction within 72 hours after stroke predicts functional recovery: early prediction of functional outcome after stroke: the EPOS cohort study. Stroke. 41 (4), 745-750 (2010).
- Katrak, P., et al. Predicting upper limb recovery after stroke: the place of early shoulder and hand movement. Archives of Physical Medicine and Rehabilitation. 79 (7), 758-761 (1998).
- Stinear, C. M., Barber, P. A., Petoe, M., Anwar, S., Byblow, W. D. The PREP algorithm predicts potential for upper limb recovery after stroke. Brain. 135 (Pt 8), 2527-2535 (2012).
- Stinear, C. M., et al. PREP2: A biomarker-based algorithm for predicting upper limb function after stroke. Annals of Clinical and Translational Neurology. 4 (11), 811-820 (2017).
- Groppa, S., et al. A practical guide to diagnostic transcranial magnetic stimulation: report of an IFCN committee. Clinical Neurophysiology. 123 (5), 858-882 (2012).
- Barker, A. T., Jalinous, R., Freeston, I. L. Non-invasive magnetic stimulation of human motor cortex. Lancet. 1 (8437), 1106-1107 (1985).
- Stinear, C. M., Byblow, W. D., Ackerley, S. J., Barber, P. A., Smith, M. C. Predicting Recovery Potential for Individual Stroke Patients Increases Rehabilitation Efficiency. Stroke. 48 (4), 1011-1019 (2017).
- Connell, L. A., Smith, M. C., Byblow, W. D., Stinear, C. M. Implementing biomarkers to predict motor recovery after stroke. NeuroRehabilitation. 43 (1), 41-50 (2018).
- Smith, M. C., Ackerley, S. J., Barber, P. A., Byblow, W. D., Stinear, C. M. PREP2 Algorithm Predictions Are Correct at 2 Years Poststroke for Most Patients. Neurorehabilitation and Neural Repair. 33 (8), 635-642 (2019).
- Rossi, S., Hallett, M., Rossini, P. M., Pascual-Leone, A. Safety, ethical considerations, and application guidelines for the use of transcranial magnetic stimulation in clinical practice and research. Clinical Neurophysiology. 120 (12), 2008-2039 (2009).
- Talelli, P., Greenwood, R. J., Rothwell, J. C. Arm function after stroke: neurophysiological correlates and recovery mechanisms assessed by transcranial magnetic stimulation. Clinical Neurophysiology. 117 (8), 1641-1659 (2006).

