Bestämma korticospinalkanalens funktionella status inom en veckaefter stroke
Summary
Detta protokoll är för utvärdering av kortikospinal tarmkanalen funktion inom 1 vecka efter stroke. Det kan användas för att välja och stratifiera patienter i prövningar av interventioner som syftar till att förbättra övre delen motorisk återhämtning och resultat och i klinisk praxis för att förutsäga övre delen funktionella resultat 3 månader efter stroke.
Abstract
Hög interindividuell variabilitet vid återvinning av övre delen (UL) funktion efter stroke innebär att det är svårt att förutsäga en individs potential för återhämtning baserat på kliniska bedömningar ensam. Den funktionella integriteten hos kortikospinalkanalen är en viktig prognostisk biomarkör för återvinning av UL-funktion, särskilt för dem med svår initial UL-försämring. Denna artikel presenterar ett protokoll för utvärdering av corticospinal tarmkanalen funktion inom 1 vecka efter stroke. Detta protokoll kan användas för att välja och stratifiera patienter i försök till interventioner som syftar till att förbättra UL motor återhämtning och resultat efter stroke. Protokollet utgör också en del av PREP2 algoritm, som förutspår UL-funktion för enskilda patienter 3 månader efter stroke. Algoritmen kombinerar sekventiellt en UL-styrkebedömning, ålder, transkraniell magnetisk stimulering och strokesvårighetsgrad, inom några dagar efter stroke. Fördelarna med att använda PREP2 i klinisk praxis beskrivs någon annanstans. Denna artikel fokuserar på användningen av en UL styrka bedömning och transkraniell magnetisk stimulering för att utvärdera kortikospinal tarmkanalen funktion.
Introduction
Övre delen funktion är ofta nedsatt efter stroke, och återvinning av UL funktion är viktigt för att återfå självständighet i dagliga levande aktiviteter1. Stroke rehabilitering prövningar syftar ofta till att förbättra UL återhämtning och resultat efter stroke. Majoriteten av stroke rehabilitering forskning bedrivs med patienter i kroniskt skede (> 6 månader poststroke), men de flesta rehabilitering sker tidigt efter stroke2,3. Mer forskning måste bedrivas med patienter strax efter en stroke för att bygga en evidensbas för rehabiliteringspraktik.
En av de största utmaningarna när man bedriver forskning strax efter stroke är att upptäcka effekterna av ingripandet mot bakgrund av återhämtning inträffar under de första veckorna och månaderna efter stroke. Hög interämnevariation i klinisk presentation och återhämtning skapar buller som kan dölja de positiva effekterna av interventioner. Interventions- och kontrollgrupper balanseras vanligtvis på kliniska mått på initial neurologisk funktionsnedsättning. Dessa åtgärder är dock ofta dåliga prediktorer för patientens potential för efterföljande återhämtning, särskilt de med svår initial nedskrivning4,5. Detta innebär att grupper kan matchas för kliniska åtgärder vid baslinjen och inte matchas för sin återhämtningspotential, vilket gör det svårare att fastställa interventionens effekter. Biomarkörer kan ta itu med denna utmaning genom att identifiera en enskild patients potential för motoråtervinning, så att grupper kan matchas korrekt och stratifieras6,7,8. Biomarkörer kan också användas för att välja patienter som är mest benägna att svara på ingripandets kända eller hypotetiska verkningsmekanismer6.
Den funktionella integriteten hos kortikospinalkanalen (CST) är en viktig biomarkör som förutspår återhämtning av UL-funktionen efter stroke5,8,9,10,11,12. CST förmedlar fallande motoreffekt från den primära motorcortex till ryggmärgen och är avgörande för samordning och fin motorkontroll. Patienter med en funktionell CST efter stroke är mer benägna att återfå styrka, samordning och fingerfärdighet än patienter utan. En klinisk bedömning kan vara tillräcklig för att bekräfta att CST är funktionell hos lindrigt nedsatta patienter13,14,15. Patienter med allvarligare initial funktionsnedsättning kan dock ha en funktionell CST, och en neurofysiologisk bedömning med transkraniell magnetisk stimulering (TMS) behövs9,10,11,16,17.
TMS är en noninvasive och smärtfri teknik som kan användas för att testa CST-funktion18. TMS-spolen ger en magnetisk stimulans över den primära motorcortex som genererar en fallande volley i CST, framkalla en motor-framkallad potential (MEP) i musklerna i kontralateral lem19. Förekomsten av en parlamentsledamot i pariska armen eller handen (MEP+) indikerar en funktionell CST och är associerad med större potential för återvinning av UL-funktionen. Patienter som är parlamentsledamoten- är mest benägna att ha sämre UL återhämtning, utan återlämnande av samordnade och fingerfärdighet hand funktion4,6,9,12,16.
Testa alla patienter med TMS är opraktiskt och onödigt, eftersom de med mild initial funktionsnedsättning troligen har en funktionell CST17. Därför behövs en hierarkisk metod så att TMS endast används för patienter med allvarligare initial funktionsnedsättning. PREP2-algoritmen utvecklades med hjälp av en kombination av kliniska åtgärder och TMS för att utvärdera CST-funktionen och förutsäga sannolikt UL-utfall vid 3 månader efter stroke(figur 1)17. PREP2 börjar på dag 3 poststroke genom att testa styrkan i skuldra bortförande och finger förlängning i paretic armen (SAFE poäng), med hjälp av Medical Research Council betyg. Om summan av dessa betyg är 5 eller fler av 10, är det “säkert” att anta att patienten är parlamentsledamot +. Dessa patienter förväntas ha en bra eller utmärkt UL resultat med 3 månader efterstroke, beroende på derasålder 17. Dessa patienter behöver inte TMS för att bestämma status som ledamot av Europaparlamentet, vilket minimerar kostnaderna och onödiga tester för patienten.
Patienter med en säker poäng på mindre än 5 på dag 3 poststroke kräver TMS att bestämma den funktionella integriteten hos deras CST. Om en parlamentsledamot kan framkallas från paretic extensor carpi radialis (ECR) eller första dorsala interosseus (FDI) muskler, patienten är mep + och förväntas återhämta fin motorkontroll av handen med 3 månader poststroke. Ungefär hälften av patienterna med en SAFE poäng mindre än 5 på dag 3 poststroke är MEP +. Viktigt, patienter kan ha en SAFE poäng så lågt som noll och vara MEP +. Detta illustrerar behovet av TMS i denna undergrupp av patienter, eftersom enbart klinisk bedömning inte kan skilja mellan patienter med och utan funktionell CST. Patienter som är parlamentsledamoten har betydande CST-skador. Dessa patienter förväntas ha ett begränsat eller dåligt UL-funktionsresultat beroende på deras totala strokesvårighetsgrad, mätt med National Institute of Health Stroke Scale (NIHSS) (figur 1)17. Dessa parlamentsledamoten- patienterna förväntas inte återfå koordinerad och fingerkontroll och kan grupperas tillsammans för forskningsändamål.
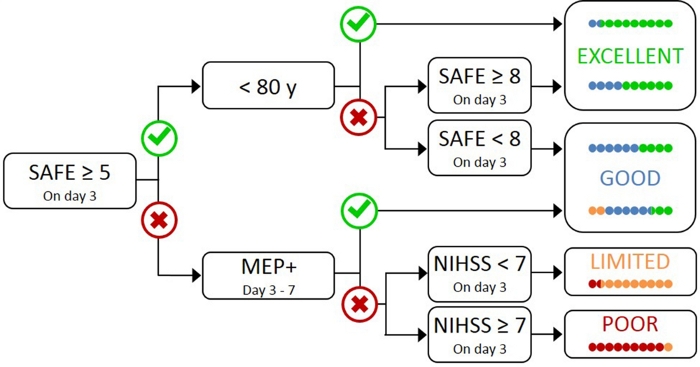
Bild 1: PREP2-algoritmen. SAFE = Shoulder Abduction, Finger Extension poäng, vilket är summan av Medical Research Council betyg för var och en av dessa rörelser av 5, för en total SAFE poäng av 10. MEP+ = Motor Evoked Potentials kan framkallas från paretic extensor carpi radialis (ECR) och/eller första dorsala interosseous (FDI) muskler paretic UL med hjälp av transkraniell magnetisk stimulering. NIHSS = Nationella institutet för hälsostroke skala. Algoritmen förutspår ett av fyra möjliga UL-funktionella resultat vid 3 månaders poststroke. Varje förutsägelse kategori är associerad med en rehabilitering fokus som kan användas för att skräddarsy UL terapi2. De färgade prickarna representerar proportionellt prep2-algoritmnoggrannhet. Prickarna är färgkodade baserat på resultatkategorin som faktiskt uppnåtts 3 månader efter stroke (Grön = Utmärkt; Blå = Bra; Orange = Begränsad; Röd = Dålig). Figur återges från Stinear et al.17. Klicka här för att se en större version av denna siffra.
I klinisk praxis förutspår PREP2 en av fyra utfallskategorier som kan användas för att skräddarsy rehabilitering för enskilda patienter och hjälpa patienter och familjer att förstå vad de kan förvänta sig för deras UL återhämtning. Hittills är PREP2 det enda externt validerade UL-förutsägelseverktyget som kombinerar klinisk bedömning och biomarkörinformation i ett beslutsträd17. Det är också det enda UL förutsägelse verktyg med forskning om effekterna av genomförandet i klinisk praxis20,21. PREP2 förutsägelser är korrekta för cirka 75% av patienterna, för optimistisk för 17% och för pessimistiska för 8% av patienterna vid 3 månader efter stroke17. Noggrannheten är högst för P-patienter (korrekt för 90% av PARlamentsledamoten- patienter), belyser värdet av att använda TMS för att identifiera dessa patienter med allvarliga skador på fallande motorvägar17. PREP2 är fortfarande korrekt för cirka 80% av patienterna vid 2 år efter stroke22. Detta stöder användningen av PREP2 för att förutsäga UL funktionella motoriska resultat på 3 månader och längre sikt. Information om att leverera PREP2 förutsägelser och använda dem i klinisk praxis ligger utanför ramen för denna metod papper, men detaljerade resurser finns tillgängliga online23.
PREP2 ger forskare ett verktyg för att välja och stratifiera patienter för kliniska prövningar. Detta gör det möjligt för patienter att grupperas inte bara enligt kliniska grundläggande egenskaper, men också deras neurobiologiska potential för UL återhämtning. Trots de ökande bevisen för användning av TMS som en prognostisk biomarkör för UL återhämtning, brist på förtrogenhet med TMS protokoll i sjukhusinställningar med subakuta stroke patienter kan vara ett hinder för dess användning i forskning. Därför syftar detta protokoll till att visa hur man använder SAFE-poängen och TMS för att utvärdera CST-funktionen hos patienter i en sjukhusmiljö tidigt efter stroke.
Protocol
Representative Results
Discussion
CST-funktionen utvärderad med MEP-status är en viktig prognostisk biomarkör för UL-återställning och resultat efter stroke. Totalt 95% av patienterna med en funktionell CST vid 1 vecka poststroke uppnå en Action Research Arm Test (ARAT) poäng på minst 34 av 57 med 3 månader efter stroke17. Omvänt uppnår 100% av patienterna utan en funktionell CST vid 1 vecka poststroke en ARAT poäng på mindre än 34 med 3 månader poststroke17. Utvärdering av CST-funktionen i…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
Författarna tackar professor Winston Byblow och Harry Jordan för deras värdefulla bidrag till detta arbete. Detta arbete finansierades av Health Research Council of New Zealand.
Materials
| alcohol/skin cleansing wipes | Reynard | alcohol prep pads | |
| electromyography electrodes | 3M | red dot electrodes | |
| Magstim TMS coil | Magstim | flat figure-8 coil | |
| razors | any | ||
| skin prep tape | 3M | red dot skin prep tape | |
| TMS stimulator | Magstim | Magstim 200 single pulse stimulator |
Riferimenti
- Veerbeek, J. M., Kwakkel, G., van Wegen, E. E., Ket, J. C., Heymans, M. W. Early prediction of outcome of activities of daily living after stroke: a systematic review. Stroke. 42 (5), 1482-1488 (2011).
- Lohse, K. R., Schaefer, S. Y., Raikes, A. C., Boyd, L. A., Lang, C. E. Asking New Questions with Old Data: The Centralized Open-Access Rehabilitation Database for Stroke. Frontiers in Neurology. 7, 153 (2016).
- Stinear, C., Ackerley, S., Byblow, W. Rehabilitation is initiated early after stroke, but most motor rehabilitation trials are not: a systematic review. Stroke. 44 (7), 2039-2045 (2013).
- Stinear, C. M. Prediction of recovery of motor function after stroke. Lancet Neurology. 9 (12), 1228-1232 (2010).
- Byblow, W. D., Stinear, C. M., Barber, P. A., Petoe, M. A., Ackerley, S. J. Proportional recovery after stroke depends on corticomotor integrity. Annals of Neurology. 78 (6), 848-859 (2015).
- Stinear, C. M. Prediction of motor recovery after stroke: advances in biomarkers. Lancet Neurology. 16 (10), 826-836 (2017).
- Kim, B., Winstein, C. Can Neurological Biomarkers of Brain Impairment Be Used to Predict Poststroke Motor Recovery? A Systematic Review. Neurorehabilitation and Neural Repair. 31 (1), 3-24 (2016).
- Boyd, L. A., et al. Biomarkers of stroke recovery: Consensus-based core recommendations from the Stroke Recovery and Rehabilitation Roundtable. International Journal of Stroke. 12 (5), 480-493 (2017).
- Escudero, J. V., Sancho, J., Bautista, D., Escudero, M., Lopez-Trigo, J. Prognostic value of motor evoked potential obtained by transcranial magnetic brain stimulation in motor function recovery in patients with acute ischemic stroke. Stroke. 29 (9), 1854-1859 (1998).
- Pennisi, G., et al. Absence of response to early transcranial magnetic stimulation in ischemic stroke patients: prognostic value for hand motor recovery. Stroke. 30 (12), 2666-2670 (1999).
- Rapisarda, G., Bastings, E., de Noordhout, A. M., Pennisi, G., Delwaide, P. J. Can motor recovery in stroke patients be predicted by early transcranial magnetic stimulation?. Stroke. 27 (12), 2191-2196 (1996).
- Bembenek, J. P., Kurczych, K., Karli Nski, M., Czlonkowska, A. The prognostic value of motor-evoked potentials in motor recovery and functional outcome after stroke – a systematic review of the literature. Functional Neurology. 27 (2), 79-84 (2012).
- Smania, N., et al. Active finger extension: a simple movement predicting recovery of arm function in patients with acute stroke. Stroke. 38 (3), 1088-1090 (2007).
- Nijland, R. H., van Wegen, E. E., Harmeling-van der Wel, B. C., Kwakkel, G. EPOS Investigators. Presence of finger extension and shoulder abduction within 72 hours after stroke predicts functional recovery: early prediction of functional outcome after stroke: the EPOS cohort study. Stroke. 41 (4), 745-750 (2010).
- Katrak, P., et al. Predicting upper limb recovery after stroke: the place of early shoulder and hand movement. Archives of Physical Medicine and Rehabilitation. 79 (7), 758-761 (1998).
- Stinear, C. M., Barber, P. A., Petoe, M., Anwar, S., Byblow, W. D. The PREP algorithm predicts potential for upper limb recovery after stroke. Brain. 135 (Pt 8), 2527-2535 (2012).
- Stinear, C. M., et al. PREP2: A biomarker-based algorithm for predicting upper limb function after stroke. Annals of Clinical and Translational Neurology. 4 (11), 811-820 (2017).
- Groppa, S., et al. A practical guide to diagnostic transcranial magnetic stimulation: report of an IFCN committee. Clinical Neurophysiology. 123 (5), 858-882 (2012).
- Barker, A. T., Jalinous, R., Freeston, I. L. Non-invasive magnetic stimulation of human motor cortex. Lancet. 1 (8437), 1106-1107 (1985).
- Stinear, C. M., Byblow, W. D., Ackerley, S. J., Barber, P. A., Smith, M. C. Predicting Recovery Potential for Individual Stroke Patients Increases Rehabilitation Efficiency. Stroke. 48 (4), 1011-1019 (2017).
- Connell, L. A., Smith, M. C., Byblow, W. D., Stinear, C. M. Implementing biomarkers to predict motor recovery after stroke. NeuroRehabilitation. 43 (1), 41-50 (2018).
- Smith, M. C., Ackerley, S. J., Barber, P. A., Byblow, W. D., Stinear, C. M. PREP2 Algorithm Predictions Are Correct at 2 Years Poststroke for Most Patients. Neurorehabilitation and Neural Repair. 33 (8), 635-642 (2019).
- Rossi, S., Hallett, M., Rossini, P. M., Pascual-Leone, A. Safety, ethical considerations, and application guidelines for the use of transcranial magnetic stimulation in clinical practice and research. Clinical Neurophysiology. 120 (12), 2008-2039 (2009).
- Talelli, P., Greenwood, R. J., Rothwell, J. C. Arm function after stroke: neurophysiological correlates and recovery mechanisms assessed by transcranial magnetic stimulation. Clinical Neurophysiology. 117 (8), 1641-1659 (2006).

