新しい天然物を発見するためのツールとしての質量分析誘導ゲノムマイニング
Summary
質量分析誘導ゲノムマイニングプロトコルが確立され、ここに記載されています。ゲノム配列情報とLC-MS/MS解析に基づき、複雑な微生物や植物抽出物からの分子の同定を容易にすることを目的としています。
Abstract
天然物で覆われた化学空間は、巨大で広く認識されていない。したがって、自然界におけるそれらの機能の幅広い評価を行う簡便な方法論や、潜在的な人的利益(例えば、創薬用途)が望まれている。このプロトコルは、ゲノムマイニング(GM)と分子ネットワーキング(MN)の組み合わせ、全ゲノムシーケンシングにおける遺伝子クラスターコードアノテーションと、粗代謝抽出物の化学構造シグネチャを一致させる2つの現代的なアプローチを記述する。これは、新しい自然エンティティの発見に向けた最初のステップです。これらの概念を一緒に適用すると、ここでは MS ガイド付きゲノムマイニングと定義されます。この方法では、主成分は以前に(MNを使用して)指定されており、構造的に関連する新しい候補は、ゲノム配列アノテーション(GMを使用)に関連付けられています。GMとMNを組み合わせることは、既に知られている化合物から類似体を同定するために、新しい分子の骨格を標的にしたり、代謝プロファイルを収穫するための有益な戦略です。
Introduction
二次代謝の調査は、多くの場合、特定の生物学的活性のための粗抽出物をスクリーニングし、その後、活性画分に属する成分の精製、同定、および特性化から構成される。このプロセスは、いくつかの化学実体の分離を促進し、効率的であることが証明されています。しかし、今日では、これは主に再発見率が高いため、実現不可能であると見なされています。医薬品産業は特殊代謝物の役割や機能を知らずに革命を起こしたので、その同定は、自然を正確に表さない実験室条件下で行った。今日では、自然なシグナル伝達の影響、分泌、および検出不可能な低濃度でのほとんどの標的の存在をよりよく理解しています。さらに、プロセスの規制は、学術界や製薬業界がこの知識を活用するのに役立ちます。また、サイレント生合成遺伝子クラスター(BGC)2に関連する代謝産物の直接分離を含む研究にも利益2をもたらす。
この文脈において、ゲノムシーケンシングの進歩は、微生物代謝産物のスクリーニングへの関心を再び高めている。これは、発見された生合成クラスターのゲノム情報を分析することで、実験室の条件下で観察または生産されていない新しい化合物をコードする遺伝子を明らかにすることができるからです。現在、多くの微生物全ゲノムプロジェクトまたはドラフトが利用可能であり、その数は毎年増加しており、ゲノムマイニング33、44を通じて新しい生理活性分子を発見するための大きな見通しを提供しています。
生合成遺伝子クラスターのアトラスは、共同ゲノム研究所(JGI IMG-ABC)2の統合微生物ゲノムプラットフォームの構成要素として自動的に採掘された遺伝子クラスターの現在最大のコレクションである。2最近では、生合成遺伝子クラスター(MIBiG)標準化イニシアチブの最小情報は、高度にキュレーションされた参照データセット5を提供し、Bgcsの手動リアノテーションを促進しました。今日では、遺伝データの計算マイニングと既知の二次代謝産物との接続を可能にする多くのツールが利用可能です。新しい生理活性天然産物(異種発現、標的遺伝子欠失、体外再構成、ゲノム配列、同位体誘導スクリーニング[ジェノミソトピックアプローチ]、局所および世界の規制当局の操作、抵抗標的ベースの採掘、文化独立採掘、さらに最近ではMSガイド/コードアプローチ,2、6、76,728、99、9 、MS誘導/コードアプローチ)にアクセスするためのさまざまな戦略も開発されています。10、11 、12、13、14、,15)。14
ゲノムマイニングは、単一の、または小さな分子グループにアナンスする努力を必要とします。したがって、分離と構造解明のために新しい化合物が優先されるプロセスのギャップが残っています。原則として、これらのアプローチは実験ごとに1つの生合成経路のみを対象とし、それによって発見速度が遅くなります。この意味で、GMを分子ネットワークアプローチと共に使用することは、天然物研究14,15,にとって重要な進歩を表している。
液体クロマトグラフィー質量分析(LC-MS)の汎用性、精度、高感度により、化合物同定に適した方法です。現在、いくつかのプラットフォームは、対象のないメタボロ,ミクス16、17、18、19、20,17のためのアルゴリズムとソフトウェアスイート19を20投資しています。,18これらのプログラムの中核は、サンプルのバッチ間で同一の特徴の一致を可能にし、パターンを検索する機能検出(ピークピッキング)21とピークアライメントを含む。MSパターンベースのアルゴリズム22,23は特徴的な断片化パターンを比較し、23構造特徴を共有する分子ファミリーを生成するMS2類似点と一致する。これらの特徴は、次に、同時にMS2、24、25によって複雑な生物学的抽出物から既知および未知の分子を迅速に発見2する能力を与え、強調表示25され、クラスタ化することができる。,したがって、タンデムMSは、大量のデータに含まれる複数の化学式の構造情報を同時に得る汎用性の高い方法である。
グローバル天然物社会分子ネットワーキング(GNPS)26アルゴリズムは、正規化されたフラグメントイオン強度を使用して多次元ベクトルを構築し、コサイン関数を用いて類似点を比較する。異なる親イオンの関係は図表表現にプロットされ、各フラグメント化は節点(円)として視覚化され、各節点の関連はエッジ(線)によって定義されます。単一のソースからの分子のグローバルな可視化は、分子ネットワークとして定義されます。一意に断片化する構造的に発散する分子は、独自の特定のクラスターまたは星座を形成し、関連する分子は一緒にクラスターします。化学型のクラスタリングは、類似した構造特徴を生合成起源と仮定的に結び付けることを可能にする。
化学型から遺伝子型へのアプローチと遺伝子型から化学型へのアプローチの両方を組み合わせることは、Bgcsとその小分子製品27との間のバイオインフォマティクスリンクを作成する際に強力である。したがって、MS誘導ゲノムマイニングは、迅速な方法であり、低材料消費戦略であり、多様な代謝および環境条件下で1つ以上の株のWGSによって明らかにされた親イオンおよび生合成経路を橋渡しするのに役立ちます。
このプロトコルのワークフロー ( 図1) は、WGS データを、ANTISMASH28、29,、30などの生合成遺伝子クラスタアノテーション プラットフォームに供給する方法で構成されています。これは、ゲノムによってコードされる化合物の多様性および化合物のクラスを推定するのに役立ちます。目的とする化学主体をコードする生合成遺伝子クラスターを標的とする戦略を採用する必要があり、BGCを含む野生型株および/または異種株からの培養抽出物を分析して、GNPS 26,3131を用いて類似性に26基づいてクラスターイオンを生成することができる。したがって、標的となるBGCに関連し、データベースでは使用できない新しい分子を同定することが可能です(主に未知の類似体、時には低い価数で生成される)。ユーザーがこれらのプラットフォームに貢献し、バイオインフォマティクスとMS/MSデータの可用性が急速に増加しており、複雑な抽出物と分子との効率的な接続を導くために効果的な計算ツールとアルゴリズムの絶え間ない開発とアップグレードに追い込まれていることを考慮することが重要です。
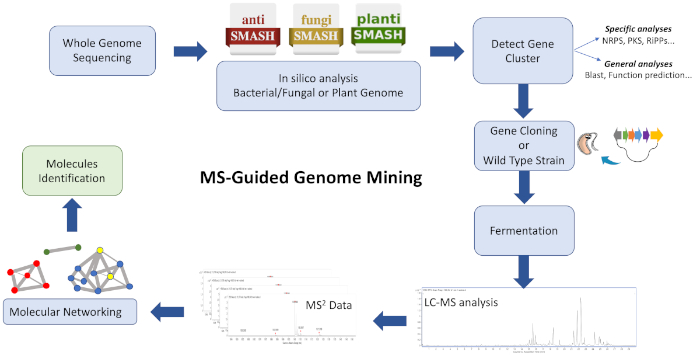
図 1: ワークフロー全体の概要図は、新しい代謝産物を同定するための、記載されたMSガイド型ゲノムマイニング手法に関与するバイオインフォマティクス、クローニング、および分子ネットワーキングのステップを示しています。この図の大きなバージョンを表示するには、ここをクリックしてください。
このプロトコルは、ゲノムマイニングと分子ネットワーキングを自然製品発見パイプラインの出発点として組み合わせるための迅速かつ効率的なワークフローを記述します。多くのアプリケーションは、1つのネットワーク内のMS検出可能な分子の組成と関連を可視化することができますが、構造的に類似したクラスター化された分子を視覚化するために、ここでいくつかが採用されています。この戦略を用いて、ストレプトマイセスsp.CBMAI 2042の代謝抽出物で観察された新規のシクロデプシペプチド産物が正常に同定される。ゲノムマイニングによって導かれ、バリノマイシンをコードする全生合成遺伝子クラスターが認識され、生産者株ストレプトマイセス・コエカラー M1146にクローン化される。最後に、MSパターンベースの分子ネットワーキングに続いて、MSによって検出された分子は、その生物発生を担うBGC32と相関している。
Protocol
Representative Results
Discussion
このプロトコルの最も強い利点は、新しい分子、特に構造類似体2の構造を解明するために、代謝プロファイルを迅速に切り下げ、ゲノム情報をMSデータとブリッジする能力である。ゲノム情報に基づいて、ポリケチド(PK)、非リボソームペプチド(NRP)、グリコシル化天然物(GNP)、および不可解なBgCsなどの異なる天然物の化学タイプを調査することができます。したがって、BGC?…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
この研究のための財政支援はサンパウロ研究財団によって提供された – FAPESP (2019/10564-5, 2014/12727-5 と 2014/50249-8 から L.G.O; 2013/12598-8 および 2015/01013-4 から R.S.、2019/08853-9 から C.F.F.A.B.S.P、C.F.F.A.、L.G.O.は、国家科学技術開発評議会(205729/2018-5、162191/20191/2015-4、313492/2017-4)からフェローシップを受けました。L.G.O.はまた、科学の女性のためのプログラム(2008年、ブラジル版)によって提供される助成金のサポートに感謝しています。すべての著者は、ブラジルの卒業後のプログラムを支援するためのCAPES(高等教育人材の改善のための調整)を認めています。
Materials
| Acetonitrile | Tedia | AA1120-048 | HPLC grade |
| Agar | Oxoid | LP0011 | NA |
| Apramycin | Sigma Aldrich | A2024 | NA |
| Carbenicillin | Sigma Aldrich | C9231 | NA |
| Centrifuge | Eppendorf | NA | 5804 |
| Chloramphenicol | Sigma Aldrich | C3175 | NA |
| Column C18 | Agilent Technologies | NA | ZORBAX RRHD Extend-C18, 80Å, 2.1 x 50 mm, 1.8 µm, 1200 bar pressure limit P/N 757700-902 |
| Kanamycin | Sigma Aldrich | K1377 | NA |
| Manitol P.A.- A.C.S. | Synth | NA | NA |
| Microcentrifuge | Eppendorf | NA | 5418 |
| Nalidixic acid | Sigma Aldrich | N4382 | NA |
| Phusion Flash High-Fidelity PCR Master Mix | ThermoFisher Scientific | F548S | NA |
| Q-TOF mass spectrometer | Agilent technologies | NA | 6550 iFunnel Q-TOF LC/MS |
| Sacarose P.A.- A.C.S. | Synth | NA | NA |
| Shaker/Incubator | Marconi | MA420 | NA |
| Sodium Chloride | Synth | NA | P. A. – ACS |
| Soy extract | NA | NA | NA |
| Sucrose | Synth | NA | P. A. – ACS |
| Thermal Cycles | Eppendorf | NA | Mastercycler Nexus Gradient |
| Thiostrepton | Sigma Aldrich | T8902 | NA |
| Tryptone | Oxoid | LP0042 | NA |
| Tryptone Soy Broth | Oxoid | CM0129 | NA |
| UPLC | Agilent Technologies | NA | 1290 Infinity LC System |
| Yeast extract | Oxoid | LP0021 | NA |
Riferimenti
- Davies, J. Specialized microbial metabolites: functions and origins. The Journal of Antibiotics. 66 (7), 361-364 (2013).
- Ziemert, N., Alanjary, M., Weber, T. The evolution of genome mining in microbes – a review. Natural Product Reports. 33 (8), 988-1005 (2016).
- Zerikly, M., Challis, G. L. Strategies for the Discovery of New Natural Products by Genome Mining. ChemBioChem. 10 (4), 625-633 (2009).
- Gomez-Escribano, J. P., Bibb, M. J. Heterologous expression of natural product biosynthetic gene clusters in Streptomyces coelicolor: from genome mining to manipulation of biosynthetic pathways. Journal of Industrial Microbiology & Biotechnology. 41 (2), 425-431 (2014).
- Medema, M. H., et al. Minimum Information about a Biosynthetic Gene cluster. Nature Chemical Biology. 11 (9), 625-631 (2015).
- Lautru, S., Deeth, R. J., Bailey, L. M., Challis, G. L. Discovery of a new peptide natural product by Streptomyces coelicolor genome mining. Nature Chemical Biology. 1 (5), 265-269 (2005).
- Chiang, Y. -. M., et al. Molecular Genetic Mining of the Aspergillus Secondary Metabolome: Discovery of the Emericellamide Biosynthetic Pathway. Chemistry & Biology. 15 (6), 527-532 (2008).
- Huang, T., et al. Identification and Characterization of the Pyridomycin Biosynthetic Gene Cluster of Streptomyces pyridomyceticus NRRL B-2517. Journal of Biological Chemistry. 286 (23), 20648-20657 (2011).
- Udwary, D. W., et al. Genome sequencing reveals complex secondary metabolome in the marine actinomycete Salinispora tropica. Proceedings of the National Academy of Sciences. 104 (25), 10376-10381 (2007).
- Gross, H., et al. The Genomisotopic Approach: A Systematic Method to Isolate Products of Orphan Biosynthetic Gene Clusters. Chemistry & Biology. 14 (1), 53-63 (2007).
- Spohn, M., Wohlleben, W., Stegmann, E. Elucidation of the zinc-dependent regulation in Amycolatopsis japonicum enabled the identification of the ethylenediamine-disuccinate ([S,S ]-EDDS) genes. Environmental Microbiology. 18 (4), 1249-1263 (2016).
- Thaker, M. N., Waglechner, N., Wright, G. D. Antibiotic resistance-mediated isolation of scaffold-specific natural product producers. Nature Protocols. 9 (6), 1469-1479 (2014).
- Katz, M., Hover, B. M., Brady, S. F. Culture-independent discovery of natural products from soil metagenomes. Journal of Industrial Microbiology & Biotechnology. 43, 129-141 (2016).
- Quinn, R. A., et al. Molecular Networking as a Drug Discovery, Drug Metabolism, and Precision Medicine Strategy. Trends in Pharmacological Sciences. 38 (2), 143-154 (2017).
- Yang, J. Y., et al. Molecular Networking as a Dereplication Strategy. Journal of Natural Products. 76 (9), 1686-1699 (2013).
- Lommen, A. MetAlign: Interface-Driven, Versatile Metabolomics Tool for Hyphenated Full-Scan Mass Spectrometry Data Preprocessing. Analytical Chemistry. 81 (8), 3079-3086 (2009).
- Katajamaa, M., Miettinen, J., Oresic, M. MZmine: toolbox for processing and visualization of mass spectrometry based molecular profile data. Bioinformatics. 22 (5), 634-636 (2006).
- Pluskal, T., Castillo, S., Villar-Briones, A., Orešič, M. MZmine 2: Modular framework for processing, visualizing, and analyzing mass spectrometry-based molecular profile data. BMC Bioinformatics. 11 (1), 395 (2010).
- Tautenhahn, R., Patti, G. J., Rinehart, D., Siuzdak, G. XCMS Online: A Web-Based Platform to Process Untargeted Metabolomic Data. Analytical Chemistry. 84 (11), 5035-5039 (2012).
- Kuhl, C., Tautenhahn, R., Böttcher, C., Larson, T. R., Neumann, S. CAMERA: An Integrated Strategy for Compound Spectra Extraction and Annotation of Liquid Chromatography/Mass Spectrometry Data Sets. Analytical Chemistry. 84 (1), 283-289 (2012).
- Katajamaa, M., Orešič, M. Data processing for mass spectrometry-based metabolomics. Journal of Chromatography A. 1158, 318-328 (2007).
- Liu, W. -. T., et al. Interpretation of Tandem Mass Spectra Obtained from Cyclic Nonribosomal Peptides. Analytical Chemistry. 81 (11), 4200-4209 (2009).
- Ng, J., et al. Dereplication and de novo sequencing of nonribosomal peptides. Nature Methods. 6 (8), 596-599 (2009).
- Liaw, C., et al. Vitroprocines, new antibiotics against Acinetobacter baumannii, discovered from marine Vibrio sp. QWI-06 using mass-spectrometry-based metabolomics approach. Scientific Reports. 5 (1), 1-11 (2015).
- Kang, K. B., et al. Targeted Isolation of Neuroprotective Dicoumaroyl Neolignans and Lignans from Sageretia theezans Using in Silico Molecular Network Annotation Propagation-Based Dereplication. Journal of Natural Products. 81 (8), 1819-1828 (2018).
- Wang, M., et al. Sharing and community curation of mass spectrometry data with Global Natural Products Social Molecular Networking. Nature Biotechnology. 34 (8), 828-837 (2016).
- Doroghazi, J. R., et al. A roadmap for natural product discovery based on large-scale genomics and metabolomics. Nature Chemical Biology. 10 (11), 963-968 (2014).
- Medema, M. H., et al. antiSMASH: rapid identification, annotation and analysis of secondary metabolite biosynthesis gene clusters in bacterial and fungal genome sequences. Nucleic Acids Research. 39, 339-346 (2011).
- Weber, T., et al. antiSMASH 3.0-a comprehensive resource for the genome mining of biosynthetic gene clusters. Nucleic Acids Research. 43, 237-243 (2015).
- Blin, K., et al. antiSMASH 5.0: updates to the secondary metabolite genome mining pipeline. Nucleic Acids Research. 47, 81-87 (2019).
- Watrous, J., et al. Mass spectral molecular networking of living microbial colonies. Proceedings of the National Academy of Sciences. 109 (26), 1743-1752 (2012).
- Paulo, B. S., Sigrist, R., Angolini, C. F. F., De Oliveira, L. G. New Cyclodepsipeptide Derivatives Revealed by Genome Mining and Molecular Networking. ChemistrySelect. 4 (27), 7785-7790 (2019).
- Gonzaga de Oliveira, L., Sigrist, R., Sachetto Paulo, B., Samborskyy, M. Whole-Genome Sequence of the Endophytic Streptomyces sp. Strain CBMAI 2042, Isolated from Citrus sinensis. Microbiology Resource Announcements. 8 (2), 1-2 (2019).
- Aziz, R. K., et al. The RAST Server: Rapid Annotations using Subsystems Technology. BMC Genomics. 9 (1), 75 (2008).
- Nah, H. -. J., Pyeon, H. -. R., Kang, S. -. H., Choi, S. -. S., Kim, E. -. S. Cloning and Heterologous Expression of a Large-sized Natural Product Biosynthetic Gene Cluster in Streptomyces Species. Frontiers in Microbiology. 8, 1-10 (2017).
- Zhang, J. J., Tang, X., Moore, B. S. Genetic platforms for heterologous expression of microbial natural products. Natural Product Reports. 36 (9), 1313-1332 (2019).
- Alduina, R., et al. Artificial chromosome libraries of Streptomyces coelicolor A3(2) and Planobispora rosea. FEMS Microbiology Letters. 218 (1), 181-186 (2003).
- Jones, A. C., et al. Phage P1-Derived Artificial Chromosomes Facilitate Heterologous Expression of the FK506 Gene Cluster. PLoS One. 8 (7), 69319 (2013).
- Gomez-Escribano, J. P., Bibb, M. J. Engineering Streptomyces coelicolor for heterologous expression of secondary metabolite gene clusters. Microbial Biotechnology. 4 (2), 207-215 (2011).
- Cannell, R. J. P. . Natural Products Isolation. , (1998).
- Kersten, R. D., et al. A mass spectrometry-guided genome mining approach for natural product peptidogenomics. Nature Chemical Biology. 7 (11), 794-802 (2011).
- Kersten, R. D., et al. Glycogenomics as a mass spectrometry-guided genome-mining method for microbial glycosylated molecules. Proceedings of the National Academy of Sciences. 110 (47), 4407-4416 (2013).
- Liu, W., et al. MS/MS-based networking and peptidogenomics guided genome mining revealed the stenothricin gene cluster in Streptomyces roseosporus. The Journal of Antibiotics. 67 (1), 99-104 (2014).
- Duncan, K. R., et al. Molecular Networking and Pattern-Based Genome Mining Improves Discovery of Biosynthetic Gene Clusters and their Products from Salinispora Species. Chemistry & Biology. 22 (4), 460-471 (2015).
- Cao, L., et al. MetaMiner: A Scalable Peptidogenomics Approach for Discovery of Ribosomal Peptide Natural Products with Blind Modifications from Microbial Communities. Cell Systems. , (2019).
- Chen, L. -. Y., Cui, H. -. T., Su, C., Bai, F. -. W., Zhao, X. -. Q. Analysis of the complete genome sequence of a marine-derived strain Streptomyces sp. S063 CGMCC 14582 reveals its biosynthetic potential to produce novel anti-complement agents and peptides. PeerJ. 7 (1), 6122 (2019).
- Kim Tiam, S., et al. Insights into the Diversity of Secondary Metabolites of Planktothrix Using a Biphasic Approach Combining Global Genomics and Metabolomics. Toxins. 11 (9), 498 (2019).
- Özakin, S., Ince, E. Genome and metabolome mining of marine obligate Salinispora strains to discover new natural products. Turkish Journal of Biology. 43 (1), 28-36 (2019).
- Trivella, D. B. B., de Felicio, R. The Tripod for Bacterial Natural Product Discovery: Genome Mining, Silent Pathway Induction, and Mass Spectrometry-Based Molecular Networking. mSystems. 3 (2), 00160 (2018).
- Maansson, M., et al. An Integrated Metabolomic and Genomic Mining Workflow To Uncover the Biosynthetic Potential of Bacteria. mSystems. 1 (3), 1-14 (2016).
- Blin, K., Kim, H. U., Medema, M. H., Weber, T. Recent development of antiSMASH and other computational approaches to mine secondary metabolite biosynthetic gene clusters. Briefings in Bioinformatics. 20 (4), 1103-1113 (2019).
- Fisch, K. M. Biosynthesis of natural products by microbial iterative hybrid PKS-NRPS. RSC Advances. 3 (40), 18228-18247 (2013).
- Tatsuno, S., Arakawa, K., Kinashi, H. Analysis of Modular-iterative Mixed Biosynthesis of Lankacidin by Heterologous Expression and Gene Fusion. The Journal of Antibiotics. 60 (11), 700-708 (2007).
- Helfrich, E. J. N., Piel, J. Biosynthesis of polyketides by trans-AT polyketide synthases. Natural Product Reports. 33 (2), 231-316 (2016).

