Traduire la purification de l’affinité ribosome (TRAP) pour étudier le développement de la racine d’Arabidopsis thaliana à une échelle spécifique au type cellulaire
Summary
La traduction de la purification de l’affinité ribosome (TRAP) offre la possibilité de disséquer les programmes de développement avec un traitement minimal des organes et des tissus. Le protocole donne de l’ARN de haute qualité à partir de cellules ciblées avec un sous-unité ribosomal étiquetée protéine fluorescente verte (GFP). Les outils d’analyse en aval, tels que qRT-PCR ou ARN-seq, révèlent des profils d’expression spécifiques aux tissus et aux cellules.
Abstract
Dans cet article, nous donnons des instructions pratiques pour obtenir des données de traduction de différents types de cellules racinaires Arabidopsis thaliana par l’intermédiaire de la méthode de purification de l’affinité ribosome de traduction (TRAP) et de la préparation continue optimisée de bibliothèque à faible entrée.
En tant que matériau de départ, nous employons des lignées végétales qui expriment la protéine ribosomalE IFFOmalE RPL18 marquée par GFP d’une manière spécifique au type cellulaire par l’utilisation de promoteurs adéquats. Avant l’immunopurification et l’extraction d’ARN, le tissu est gelé, qui préserve l’intégrité des tissus et permet simultanément l’exécution d’études de série temporelle avec une résolution temporelle élevée. Notamment, les structures de mur cellulaire restent intactes, ce qui est un inconvénient majeur dans les procédures alternatives telles que les approches à base de tri cellulaire activée par fluorescence qui reposent sur le protoplasting tissulaire pour isoler les populations cellulaires distinctes. En outre, aucune fixation tissulaire n’est nécessaire comme dans les techniques basées sur la microdissection de capture laser, ce qui permet d’obtenir de l’ARN de haute qualité.
Cependant, l’échantillonnage des sous-populations de cellules et l’arn polysome-associé qui isolent limitent sévèrement les rendements d’ARN. Il est donc nécessaire d’appliquer des méthodes de préparation de bibliothèque suffisamment sensibles pour l’acquisition réussie de données par RNA-seq.
TRAP offre un outil idéal pour la recherche sur les plantes, car de nombreux processus de développement impliquent des voies de signalisation liées aux parois cellulaires et mécaniques. L’utilisation de promoteurs pour cibler des populations cellulaires spécifiques fait le pont entre le niveau d’organe et le niveau unicellulaire qui, à son tour, souffre de peu de résolution ou de coûts très élevés. Ici, nous appliquons TRAP pour étudier la communication cellule-cellule dans la formation latérale de racine.
Introduction
Poussé par l’application croissante des techniques de séquençage de nouvelle génération, la résolution spatiale en biologie du développement pourrait être augmentée. Les études contemporaines visent à disséquer les tissus vers le bas pour les types de cellules spécialisées, si ce n’est le niveau unicellulaire1,2,3,4. À cette fin, une pléthore de différentes méthodes a été conçue au cours des cinquante dernières années (voir figure 1A)5,6,7,8,9,10,11,12,13,14,15.
De nombreux outils en science végétale ont été des adaptations de techniques qui ont été pionnières dans la recherche animale. Ce n’est pas le cas pour la méthode que nous introduisons en détail ici. En 2005, doté d’un solide fond de traduction de protéines, le Laboratoire Bailey-Serres a entrepris de concevoir des protéines ribosomales pour la purification ultérieure de l’affinité16. Ainsi, ils pourraient éviter le profilage polysome long et laborieux, qui est basé sur l’ultracentrifugation avec un gradient de saccharose et a été employé pour évaluer la traduction des ribosomes depuis les années 196017,18. La méthode a depuis été appelée purification d’affinité ribosome translationnelle (TRAP)16. Après des études réussies de traduction dans les plantes, Heiman et autres ont adapté TRAP pour les animaux19 et d’autres ont étendu son application à la levure20, Drosophila21, Xenopus22 et le poisson zèbre23,24.
Bien que la modification génétique du système modèle soit une condition préalable pour TRAP, qui limite son application aux espèces qui se prêtent à la transformation génétique, on peut simultanément exploiter cette objection pour cibler des sous-ensembles de cellules qui sont d’intérêt particulier et autrement extrêmement difficiles à isoler du tissu intact/organe25 (p. ex., les cellules dendritiques fortement ramifiées dans un cerveau de souris ou hyphes fongiques dans le tissu végétal infecté). Dans les plantes, toutes les cellules sont maintenues en place par des parois cellulaires qui forment la base du squelette hydrostatique26. Pour libérer une cellule végétale de cette matrice, les scientifiques ont soit physiquement coupé la cellule de son tissu environnant par microdissection de capture laser (LCM)27 ou effectué la digestion enzymatique des parois cellulaires28. Parmi ces dernières cellules, ce que l’on appelle les protoplastes, la population d’intérêt est étiquetée fluorescentement et peut être séparée par le tri cellulaire activé par fluorescence (FACS)7. LCM nécessite généralement un échantillon à fixer et intégré dans la cire, ce qui finit par détériorer la qualité de son ARN29. Les méthodes à base de FACS produisent de l’ARN de haute qualité, mais le processus de protoplasting lui-même introduit des différences dans l’expressiongénique 30 et les tissus avec des parois cellulaires secondaires modifiées et épaisses sont notoirement difficiles à traiter. En outre, de nombreux processus de développement dans les plantes sont supposés s’appuyer sur des signaux mécaniquement transmis et donc l’intégrité de la paroi cellulaire est d’une importance primordiale31. Deux méthodes, qui utilisent un raccourci pour contourner l’isolement cellulaire en opérant au niveau des nucléii, sont le tri nucléaire activé par la fluorescence (FANS) et l’isolement des noyaux marqués dans des types cellulaires spécifiques (INTACT). Comme dans TRAP, ils utilisent des promoteurs spécifiques au type de cellule pour marquer les noyaux, qui se sont ensuite enrichis par tri ou tirer vers le bas, respectivement8,15. Un défi majeur pour toutes ces approches est d’obtenir suffisamment de matériel d’ARN à partir de sous-ensembles de cellules dans un tissu. Comme TRAP ne capture qu’une fraction des ARN cellulaires, la collecte d’échantillons est un goulot d’étranglement considérable. Par conséquent, des protocoles de préparation de bibliothèque particulièrement sensibles sont nécessaires pour produire des données de haute qualité à partir de faibles quantités d’entrée.
Depuis sa création, TRAP a été utilisé en combinaison avec des microrésions d’ADN ou, comme les coûts de séquençage ont chuté de manière significative ces dernières années, RNA-seq10,32,33. Une multitude de questions de recherche a déjà été élucidée tel qu’il a été examiné dans Sablok et coll.34. Nous sommes convaincus que d’autres rapports suivront dans les années à venir, car la technique est très polyvalente lorsqu’elle combine différents promoteurs pour cibler des types de cellules spécifiques. Finalement, cela se fera même d’une manière inductible, et peut être combiné avec sonder la réaction de la plante à de nombreux facteurs de stress biotiques et abiotiques. En outre, lorsque des lignées transgéniques stables ne sont pas disponibles, les systèmes d’expression des racines poilues ont également été utilisés avec succès pour effectuer TRAP dans la tomate et medicago35,36.
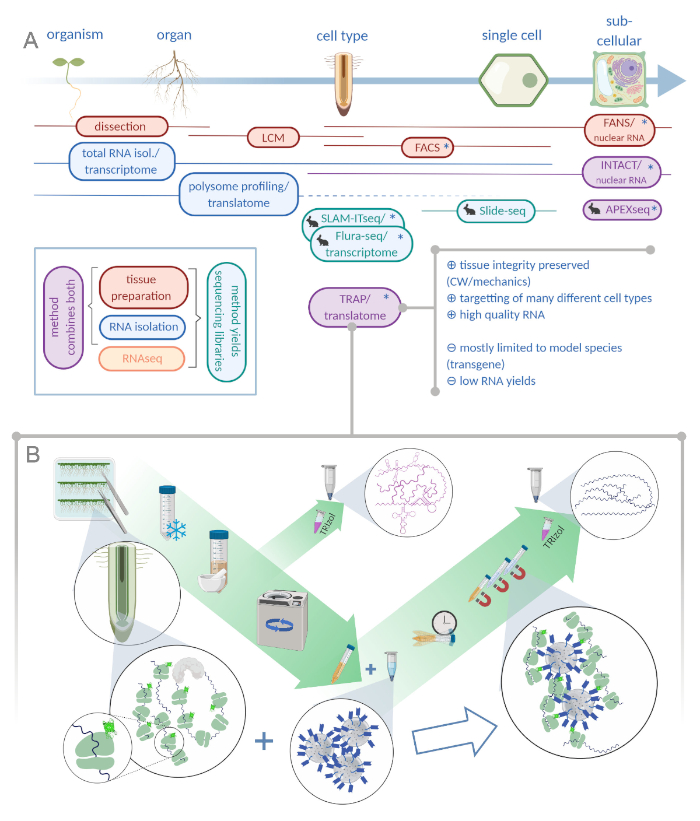
Figure 1 : La traduction de la purification de l’affinité ribosome (TRAP) complète le portefeuille d’analyse « omics ». R. L’augmentation des niveaux de précision analytique, jusqu’à la résolution unicellulaire ou même subcellulaire peut être obtenue par une pléthore de méthodes ou de combinaisons de celui-ci. Le programme donne un aperçu des outils actuellement disponibles dans le domaine des plantes et des animaux. La collecte de tissus à la résolution cellulaire peut être obtenue par des protocoles comme LCM ou FACS, qui sont ensuite couplés à un transcriptome standard ou à une analyse de profilage/traduction polysome. TRAP et INTACT intègrent à la fois la capture des tissus et l’isolement de l’ARN car ils sont basés sur l’épitope-marquage. Cependant, INTACT n’échantillonne que les noyaux cellulaires et constitue, par conséquent, un cas particulier d’analyse de transcriptome. Une petite icône de lapin marque des méthodes nouvellement développées dans le domaine animal : Alors que SLAM-ITseq et Flura-seq s’appuient sur la ciblage métabolique des ARN naissants avec des bases d’uracil modifiées dans les cellules exprimant l’enzyme permissive, Slide-seq utilise une diapositive en verre enduit avec des codes-barres d’ADN qui fournissent des informations de position dans la gamme cellulaire. Une approche d’étiquetage de proximité est suivie dans APEX-seq pour échantillonner les ARN dans des compartiments subcellulaires spécifiques. Notamment, une résolution accrue nécessite souvent la production de matériaux transgéniques (astérisques) et ces méthodes sont donc principalement utilisées pour les espèces modèles. TRAP est particulièrement adapté pour les études scientifiques végétales impliquant la paroi cellulaire (CW) ou la signalisation mécanique ainsi que les espèces cellulaires qui sont difficiles à libérer de leur matrice CW. B. Les étapes détaillées de la procédure TRAP : Les semis exprimant des protéines ribosomal étiquetées GFP dans des types cellulaires distincts (p. ex. endodermis de racine) sont cultivés sur des plats Petri pendant sept jours et des racines récoltées par congélation rapide. Un échantillon total de contrôle de l’ARN est prélevé sur l’extrait brut homogénéisé avant de pelleter les débris par centrifugation. Des perles magnétiques anti-GFP sont ajoutées à l’extrait effacé pour effectuer l’immunoprécipitation. Après l’incubation et trois étapes de lavage, l’ARN polysome-associé (TRAP/ARN polysome) est directement obtenu par extraction de phénol-chloroforme. LCM : microdissection de capture laser, FACS/FANS : tri cellulaire/nucléaire activé par fluorescence, APEX-seq: méthode basée sur l’ascorbate peroxidase, INTACT: isolation des noyaux étiquetés dans des types cellulaires spécifiques, SLAM-ITseq: thiol (SH) alkylation liée à la séquence métabolique de l’ARN dans les tissus, Flura-seq: fluorouracil-étiqueté RNA séquençage (Créé avec Biorender.com) S’il vous plaît cliquez ici pour voir une version plus grande de cette figure.
Le but de cet article est de fournir une description détaillée de la méthode TRAP, de mettre en évidence les étapes critiques et de fournir des conseils pour une méthode de préparation possible de la bibliothèque.
Une expérience TRAP générique consistera essentiellement en les étapes suivantes (voir aussi la figure 1B) : (1) Préparation du matériel végétal, y compris le clonage de la construction de ribosome-marquage, la production et la sélection transgéniques de lignées, la culture et l’encombrement des graines, la stérilisation et le placage, et l’application/traitement du stress (facultatif) et la récolte des tissus; (2) l’immunopurification, y compris l’homogénéisation des tissus et le dégagement de l’extrait brut, le lavage et l’immunopurification des perles, et les étapes de lavage; (3) Évaluation de la qualité de l’ARN; et (4) la préparation de la bibliothèque.
La racine Arabidopsis a été un système modèle pour étudier le développement des plantes depuis son introduction comme une plante modèle37,38. Ici, l’application de TRAP est présentée dans le contexte du développement latéral des racines végétales. Dans les plantes, l’accumulation de l’ensemble du système racinaire repose sur l’exécution de ce programme et est donc très importante pour la survie de l’organisme39. Dans Arabidopsis, les racines latérales proviennent de tissu péricycle qui réside à côté des vaisseaux xylèmes et est donc appelé pericycle pôle xylème (XPP; voir figure 2C)40. Certaines cellules XPP, qui sont situées profondément à l’intérieur de la racine, acquièrent une identité cellulaire fondatrice et, sur un déclencheur hormonal local, commencent à proliférer en gonfleant et en divisant anticlinally41. Cependant, en raison de la présence d’une matrice rigide de mur cellulaire, ce processus exerce le stress mécanique sur les tissus environnants. En particulier, l’endoderme overlying est affecté, car il est dans la voie de l’axe de croissance latérale des racines42,43,44. En effet, le primordium nouvellement formé devra se développer à travers la cellule endodermis overlying (figure 2C2) tandis que les cellules cortex et épiderme sont juste repoussées pour que le primordium émerge enfin45,46. Des travaux récents dans notre laboratoire ont montré que l’endoderme contribue activement à la prolifération du péricycle. Le blocage ciblé de la signalisation hormonale endodermique est suffisant pour inhiber même la toute première division dans les cellules XPP47. Par conséquent, la communication péricycle-endodermis constitue un point de contrôle très précoce pour le développement latéral des racines dans Arabidopsis. On ne sait cependant pas comment cette traque est effectuée. Pour percer ce mystère, nous avons choisi l’approche TRAP-seq pour cibler XPP et les cellules endodermiques. Pour enrichir pour les cellules dans le programme de racine latérale, nous avons imité le déclencheur hormonal en appliquant exogènement un analogue auxin (acide à laphthalèneacécéétique, NAA)48, qui en même temps a permis de résoudre temporellement la phase initiale de la formation latérale de racine.
Protocol
Representative Results
Discussion
Vérification du modèle de localisation RPL18
Crucial pour éviter une mauvaise interprétation des données de toute expérience TRAP est le modèle d’expression approprié du sous-unité ribosomal marqué. Par conséquent, l’incorporation de GFP comme une étiquette d’épitope à RPL18 permet très élégamment la vérification du modèle d’expression désiré et consécutivement, retirer la fraction polysome du même tissu. Des approches plus invasives pour assurer des modèles de promoteu…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
Nous tenons à remercier Jean-Claude Walser du Centre de diversité génétique de Zurich pour les conseils d’experts cruciaux dans la première phase de ce projet. Les travaux du laboratoire Vermeer ont été soutenus par une subvention de la Chaire SNF (PP00P3_157524) et une subvention d’équipement R’EQUIP (316030-164086) de la Fondation nationale suisse des sciences (SNSF) décernée à JEMV.
Materials
| Sterilization | |||
| bleach, 13% | Sigma | 71696 | |
| beaker | VWR | 214-1172/74/75 | |
| desiccator with porcelaine plate (DURAN) | Sigma/Merck | Z317454-1EA/Z317594-1EA | |
| EtOH, p.a. | Honeywell | 02860-1L | |
| HCl, 37% | Roth | 4625.1 | |
| Tween 20 | Sigma | P9416 | |
| Plate growth + harvesting | |||
| MS salts, basal salt mixture, incl. MES buffer | Duchefa | M0254 | |
| agar plant for cell culture | Applichem/Panreac | A2111.1000 | |
| DMSO | Sigma | D4540 | |
| forcepts | Rubis Switzerland | 5-SA model | |
| KOH | Fluka | 60370 | |
| micropore/surgical tape | 3M | 1530-0 | |
| NAA | Duchefa | N0903 | |
| petri dishes 120×120 mm | Greiner bio-one | 688102 | |
| scalpel | VWR/Swann-Morton | 233-5454 | |
| tissues, neutral, two-layered | any supplier of your choice | ||
| Immunoprecipitation | |||
| GFP-beads: gtma-100 GFP-Trap_MA | Chromotek | e.g. gtma-100 | |
| Brij-35 | Sigma | P1254-500G | |
| centrifuge tubes (in accordance with centrifuge) | Beckman Coulter | 357001 | |
| Chloramphenicol | Applichem | C0378-25G | |
| cotton gloves | VWR | 113-7355 | |
| Cycloheximide, HPLC grade | Sigma | 01810-1G | |
| DEPC | VWR | E174 | might have long delivery times |
| DTT | Fluka | 43815 | |
| EGTA | Sigma | 3054.3 | |
| homogenizers DUALL 23 | KONTES GLASS CO (via VWR) | SCERSP885450-0023 (set) | SCERSP885451-0023 pestle only – SCERSP885452-0023 cylinder only; long delivery times |
| Igepal CA-360 | Sigma | I3021-100ml | |
| KCl | Sigma | 60130 | |
| MgCl2 hexahydrat | Roth | 2189.2 | |
| mortar and pestle | VWR | 470148-960 & 470019-978 | |
| PMSF | Roche | 10 837 091 001 | |
| Polyoxyethylene-(10)-tridecylether/PTE | Sigma | P2393-500G | |
| RNase-free water | Roth | T143.3 | |
| RNAZap | Thermo Fisher | AM9780/AM9782 | for cleaning surfaces |
| Tris, >99.3% | Roth | AE15.3 | |
| Triton X-100 | Fluka | T8787-250ml | |
| Tween 20 | Sigma | P9416-100ml | |
| RNA extraction | |||
| 2-Propanol, p.a. | Sigma | 33539-1L-GL-R | |
| Chloroform, HPLC grade | Scharlau | CL02181000 | |
| EtOH, p.a. | Honeywell | 02860-1L | |
| low-retention microcentrifuge tubes, 1.5 ml | Eppendorf/Sigma | Z666548-250EA | LoBind |
| RNase-free DNase set | Qiagen | 79254 | |
| RNeasy MiniElute Cleanup Kit | Qiagen | 74204 | |
| TRIzol reagent | ThermoFisher/Ambion | 15596018 | |
| Library preparation | |||
| 15/50 mL Tube Magnetic Separator | Abraxis | PN 472250 | |
| AMPure beads | Beckman Coulter | A63881 | |
| Index Kit A | Illumina | FC-131-2001 | |
| Index Kit D | Illumina | FC-131-2004 | |
| neodymium magnets | Amazon/other | 6 x 1.5 mm range: N42 (NdFeB) | |
| Nextera XT kit | Illumina | FC-131-1024/1096 | https://emea.support.illumina.com/ |
| PCR strips | ThermoScientific | AB-0266 | |
| SMARTer v4 kit | Takara Bioscience | 634892 | https://www.takarabio.com/ |
| Bioanalyzer | Agilent | 2100 Bioanalyzer Instrument | specialized equipment for RNA/DNA quality control |
| Tapestation | Agilent | 4200 Tapestation Instrument | specialized equipment for RNA/DNA quality control |
| Fragment Analyzer | Agilent | 5400 Fragment Analyzer System | specialized equipment for RNA/DNA quality control (high throughput) |
| LabChip | PerkinElmer | LabChip GX Touch Nucleic Acid Analyzer | specialized equipment for RNA/DNA quality control (high throughput) |
| Qubit 4 Fluorometer | ThermoFisher | Q33239 | specialized equipment for RNA/DNA concentration determination |
| qRT-PCR | |||
| GATA23 | Microsynth | fwd: AGTGAGAATGAA AGAAGAGAAGGG; rev: GTGGCTGCGAAT AATATGAATACC |
|
| GH3.3 | Microsynth | fwd: CAAACCAATCCT CCAAATGAC; rev: ACTTATCCGCAA CCCGACT |
|
| LBD29 | Microsynth | fwd: TCTCCAACAACA GGTTGTGAAT; rev: AAGGAGCCTTAG TAGTGTCTCCA |
|
| UBC21 | Microsynth | fwd: TGCGACTCAGGG AATCTTCT; rev: TCATCCTTTCTT AGGCATAGCG |
|
| SsoAdvanced Universal SYBR Green | Bio-Rad | #172-5270 | |
| iScript Adv cDNA Kit | Bio-Rad | #172-5038 | |
| miscellaneous | |||
| Falcon tubes 15 ml, Cellstar | Greiner bio-one | 188261 | |
| Falcon tubes 50 ml, Cellstar | Greiner bio-one | 210261 | |
| filter tips 1 ml | Axygen | TF-1000-R-S | |
| filter tips 10 µl | Axygen | TF-10-R-S | |
| filter tips 100 µl | Axygen | TF-100-R-S | |
| filter tips 20 µl | Axygen | TF-20-R-S | |
| filter tips 200 µl | Axygen | TF-200-R-S | |
| microcentrifuge tubes 1.5 ml | SARSTEDT | 72.690.001 | |
| Propidium iodide | Sigma | P4170-100MG | |
| sequencing company | Novogene | en.novogene.com |
Riferimenti
- Van Verk, M. C., Hickman, R., Corné, M. J., Pieterse, M., Van Wees, S. C. RNA-Seq: Revelation Of The Messengers. Trends In Plant Science. 18 (4), 175-179 (2013).
- Libault, M., Pingault, L., Zogli, P., Schiefelbein, J. Plant Systems Biology At The Single-Cell Level. Trends In Plant Science. 22 (11), 949-960 (2017).
- Mustroph, A., et al. Profiling Translatomes Of Discrete Cell Populations Resolves Altered Cellular Priorities During Hypoxia In Arabidopsis. Proceedings Of The National Academy Of Sciences Of The United States Of America. 106 (44), 18843-18848 (2009).
- Karve, R., Iyer-Pascuzzi, A. S. Digging Deeper: High-Resolution Genome-Scale Data Yields New Insights Into Root Biology. Current Opinion In Plant Biology. 24, 24-30 (2015).
- Warner, J. R., Knopf, P. M., Rich, A. A Multiple Ribosomal Structure In Protein Synthesis. Proceedings of The National Academy of Sciences of The United States of America. 49 (1), 122-129 (1963).
- Gautam, V., Sarkar, A. K. Laser Assisted Microdissection, An Efficient Technique To Understand Tissue Specific Gene Expression Patterns And Functional Genomics In Plants. Molecular Biotechnology. 57 (4), 299-308 (2015).
- Bargmann, B. O. R., Birnbaum, K. D. Fluorescence Activated Cell Sorting Of Plant Protoplasts. Journal of Visualized Experiments. (36), e1673 (2010).
- Deal, R. B., Henikoff, S. The Intact Method For Cell Type-Specific Gene Expression And Chromatin Profiling In Arabidopsis Thaliana. Nature Protocols. 6 (1), 56-68 (2011).
- Dougherty, J. D. The Expanding Toolkit Of Translating Ribosome Affinity Purification. The Journal of Neuroscience: The Official Journal Of The Society For Neuroscience. 37 (50), 12079-12087 (2017).
- Mustroph, A., Juntawong, P., Bailey-Serres, J. Isolation Of Plant Polysomal mRNA By Differential Centrifugation And Ribosome Immunopurification Methods. Methods in Molecular Biology. 553, 109-126 (2009).
- Matsushima, W., et al. SLAM-ITseq: Sequencing Cell Type-Specific Transcriptomes Without Cell Sorting. Development. 145 (13), (2018).
- Basnet, H., et al. Flura-Seq Identifies Organ-Specific Metabolic Adaptations During Early Metastatic Colonization. Elife. 8, (2019).
- Rodriques, S. G., et al. Slide-Seq: A Scalable Technology For Measuring Genome-Wide Expression At High Spatial Resolution. Science. 363 (6434), 1463-1467 (2019).
- Fazal, F. M., et al. Atlas Of Subcellular RNA Localization Revealed By Apex-Seq. Cell. 178 (2), 473-490 (2019).
- Slane, D., Bayer, M., Kaufmann, K., Mueller-Roeber, B. Cell Type-Specific Gene Expression Profiling Using Fluorescence-Activated Nuclear Sorting. Plant Gene Regulatory Networks: Methods And Protocols. , 27-35 (2017).
- Zanetti, M. E., Chang, I. F., Gong, F., Galbraith, D. W., Bailey-Serres, J. Immunopurification Of Polyribosomal Complexes Of Arabidopsis For Global Analysis Of Gene Expression. Plant Physiology. 138 (2), 624-635 (2005).
- King, H. A., Gerber, A. P. Translatome Profiling: Methods For Genome-Scale Analysis Of mRNA Translation. Briefings In Functional Genomics. 15 (1), 22-31 (2016).
- Mašek, T., Valášek, L., Pospíšek, M., Nielsen, H. Polysome Analysis And RNA Purification From Sucrose Gradients. RNA: Methods And Protocols. , 293-309 (2011).
- Heiman, M., et al. A Translational Profiling Approach For The Molecular Characterization Of Cns Cell Types. Cell. 135 (4), 738-748 (2008).
- Halbeisen, R. E., Scherrer, T., Gerber, A. P. Affinity Purification Of Ribosomes To Access The Translatome. Methods. 48 (3), 306-310 (2009).
- Thomas, A., et al. A Versatile Method For Cell-Specific Profiling Of Translated mRNAs In Drosophila. Plos One. 7 (7), e40276 (2012).
- Watson, F. L., et al. Cell Type-Specific Translational Profiling In The Xenopus Laevis Retina. Developmental Dynamics. 241 (12), 1960-1972 (2012).
- Lam, P. Y., Harvie, E. A., Huttenlocher, A. Heat Shock Modulates Neutrophil Motility In Zebrafish. Plos One. 8 (12), e84436 (2013).
- Fang, Y., et al. Translational Profiling Of Cardiomyocytes Identifies An Early Jak1/Stat3 Injury Response Required For Zebrafish Heart Regeneration. Proceedings Of The National Academy Of Sciences Of The United States Of America. 110 (33), 13416-13421 (2013).
- Mustroph, A., Zanetti, M. E., Girke, T., Bailey-Serres, J. Isolation And Analysis Of mRNAs From Specific Cell Types Of Plants By Ribosome Immunopurification. Methods In Molecular Biology. 959, 277-302 (2013).
- Monshausen, G. B., Gilroy, S. Feeling Green: Mechanosensing In Plants. Trends In Cell Biology. 19 (5), 228-235 (2009).
- Day, R. C., Grossniklaus, U., Macknight, R. C. Be More Specific! Laser-Assisted Microdissection Of Plant Cells. Trends In Plant Science. 10 (8), 397-406 (2005).
- Sheen, J. Signal Transduction In Maize And Arabidopsis Mesophyll Protoplasts. Plant Physiology. 127 (4), 1466-1475 (2001).
- Datta, S., et al. Laser Capture Microdissection: Big Data From Small Samples. Histology And Histopathology. 30 (11), 1255-1269 (2015).
- Birnbaum, K., et al. A Gene Expression Map Of The Arabidopsis Root. Science. 302 (5652), 1956 (2003).
- Hamant, O., Haswell, E. S. Life Behind The Wall: Sensing Mechanical Cues In Plants. BMC Biology. 15 (1), 1354 (2017).
- Vragović, K., et al. Translatome Analyses Capture Of Opposing Tissue-Specific Brassinosteroid Signals Orchestrating Root Meristem Differentiation. Proceedings of The National Academy of Sciences of the United States of America. 112 (3), 923-928 (2015).
- Wang, Y., Jiao, Y. Translating Ribosome Affinity Purification (Trap) For Cell-Specific Translation Profiling In Developing Flowers. Methods In Molecular Biology. 1110, 323-328 (2014).
- Sablok, G., Powell, J. J., Kazan, K. Emerging Roles And Landscape Of Translating mRNAs In Plants. Frontiers in Plant Science. 8, 1443 (2017).
- Ron, M., et al. Hairy Root Transformation Using Agrobacterium Rhizogenes As A Tool For Exploring Cell Type-Specific Gene Expression And Function Using Tomato As A Model. Plant Physiology. 166 (2), 455-469 (2014).
- Reynoso, M. A., et al. Evolutionary Flexibility In Flooding Response Circuitry In Angiosperms. Science. 365 (6459), 1291-1295 (2019).
- Dolan, L., et al. Cellular Organisation Of The Arabidopsis Thaliana Root. Development. 119 (1), 71 (1993).
- Ristova, D., Barbez, E. . Root Development. , (2018).
- Shekhar, V., Stӧckle, D., Thellmann, M., Vermeer, J. E. M. The Role Of Plant Root Systems In Evolutionary Adaptation. Current Topics in Developmental Biology. 131, 55-80 (2019).
- Malamy, J. E., Benfey, P. N. Down And Out In Arabidopsis: The Formation Of Lateral Roots. Trends in Plant Science. 2 (10), 390-396 (1997).
- de Smet, I., et al. Bimodular Auxin Response Controls Organogenesis In Arabidopsis. Proceedings of the National Academy of Sciences of The United States of America. 107 (6), 2705-2710 (2010).
- Péret, B., et al. Arabidopsis Lateral Root Development: An Emerging Story. Trends In Plant Science. 14 (7), 399-408 (2009).
- Vilches-Barro, A., Maizel, A. Talking Through Walls: Mechanisms Of Lateral Root Emergence In Arabidopsis Thaliana. Current Opinion in Plant Biology. 23, 31-38 (2015).
- Porco, S., et al. Lateral Root Emergence In Arabidopsis Is Dependent On Transcription Factor Lbd29 Regulation Of Auxin Influx Carrier Lax3. Development. 143 (18), 3340-3349 (2016).
- Stoeckle, D., Thellmann, M., Vermeer, J. E. Breakout-Lateral Root Emergence In Arabidopsis Thaliana. Current Opinion in Plant Biology. 41, 67-72 (2018).
- Banda, J., et al. Lateral Root Formation In Arabidopsis: A Well-Ordered Lrexit. Trends in Plant Science. 24 (9), 826-839 (2019).
- Vermeer, J. E. M., et al. A Spatial Accommodation By Neighboring Cells Is Required For Organ Initiation In Arabidopsis. Science. 343 (6167), 178-183 (2014).
- Vanneste, S., et al. Cell Cycle Progression In The Pericycle Is Not Sufficient For Solitary Root/Iaa14-Mediated Lateral Root Initiation In Arabidopsis Thaliana. The Plant Cell. 17 (11), 3035-3050 (2005).
- Marques-Bueno, M. M., et al. A Versatile Multisite Gateway-Compatible Promoter And Transgenic Line Collection For Cell Type-Specific Functional Genomics In Arabidopsis. The Plant Journal : For Cell and Molecular Biology. 85 (2), 320-333 (2016).
- Shimada, T. L., Shimada, T., Hara-Nishimura, I. A Rapid And Non-Destructive Screenable Marker, Fast, For Identifying Transformed Seeds Of Arabidopsis Thaliana. The Plant Journal : For Cell and Molecular Biology. 61 (3), 519-528 (2010).
- Clough, S. J., Bent, A. F. Floral Dip: A Simplified Method For Agrobacterium Mediated Transformation Of Arabidopsis Thaliana. The Plant Journal. 16 (6), 735-743 (1998).
- Lindsey, B. E., Rivero, L., Calhoun, C. S., Grotewold, E., Brkljacic, J. Standardized Method For High-Throughput Sterilization Of Arabidopsis Seeds. Journal Of Visualized Experiments. (128), e56587 (2017).
- Andersen, T. G., et al. Diffusible Repression Of Cytokinin Signalling Produces Endodermal Symmetry And Passage Cells. Nature. 555, 529-533 (2018).
- Schroeder, A., et al. The Rin: An Rna Integrity Number For Assigning Integrity Values To Rna Measurements. BMC Molecular Biology. 7, 3 (2006).
- Vragović, K., Bartom, E., Savaldi-Goldstein, S. Quantitation Of Cell Type-Specific Responses To Brassinosteroid By Deep Sequencing Of Polysome-Associated Polyadenylated RNA. Methods in Molecular Biology. 1564, 81-102 (2017).
- Bertin, B., Renaud, Y., Aradhya, R., Jagla, K., Junion, G. Trap-Rc, Translating Ribosome Affinity Purification From Rare Cell Populations Of Drosophila Embryos. Journal Of Visualized Experiments. (103), e52985 (2015).
- Livak, K. J., Schmittgen, T. D. Analysis Of Relative Gene Expression Data Using Real-Time Quantitative PCR And The 2(-Delta Delta C(T)) Method. Methods. 25 (4), 402-408 (2001).
- Jiao, Y., Meyerowitz, E. M. Cell-Type Specific Analysis Of Translating Rnas In Developing Flowers Reveals New Levels Of Control. Molecular Systems Biology. 6, 419 (2010).
- Tian, C., et al. A Gene Expression Map Of Shoot Domains Reveals Regulatory Mechanisms. Nature Communications. 10 (1), 141 (2019).
- Townsley, B. T., Covington, M. F., Ichihashi, Y., Zumstein, K., Sinha, N. R. Brad-Seq: Breath Adapter Directional Sequencing: A Streamlined, Ultra-Simple And Fast Library Preparation Protocol For Strand Specific mRNA Library Construction. Frontiers in Plant Science. 6, 366 (2015).
- Song, Y., et al. A Comparative Analysis Of Library Prep Approaches For Sequencing Low Input Translatome Samples. BMC Genomics. 19 (1), 696 (2018).
- Basu, D., Haswell, E. S. Plant Mechanosensitive Ion Channels: An Ocean Of Possibilities. Current Opinion in Plant Biology. 40, 43-48 (2017).
- Brady, S. M., et al. A High-Resolution Root Spatiotemporal Map Reveals Dominant Expression Patterns. Science. 318 (5851), 801 (2007).

