Imágenes de células vivas del ciclo de vida del depredador bacteriavo Bdellovibrio mediante microscopía de fluorescencia Time-Lapse
Summary
Aquí se presenta un protocolo que describe el monitoreo del ciclo de vida completo de la bacteria depredadora Bdellovibrio bacteriovorus usando microscopía de fluorescencia de lapso de tiempo en combinación con una almohadilla de agarosa y platos de imágenes celulares.
Abstract
La bacteria Bdellovibrio es una pequeña bacteria depredadora gramnegativa que mata otras bacterias gramnegativas, incluidos los patógenos dañinos. Por lo tanto, se considera un antibiótico vivo. Para aplicar B. bacteriovorus como un antibiótico vivo, primero es necesario entender las principales etapas de su complejo ciclo de vida, particularmente su proliferación dentro de sus presas. Hasta ahora, ha sido un reto monitorear las sucesivas etapas del ciclo de vida depredador en tiempo real. Aquí se presenta un protocolo integral para la imagen en tiempo real del ciclo de vida completo de B. bacteriovorus,especialmente durante su crecimiento dentro del huésped. Para este propósito, se utiliza un sistema que consiste en una almohadilla de agarosa en combinación con platos de imágenes celulares, en el que las células depredadoras pueden moverse libremente debajo de la almohadilla de agarosa, mientras que las células de presa inmovilizadas son capaces de formar bdelloplasts. La aplicación de una cepa que produce una subunidad de ADN polimerasa III con etiquetas fluorescentes permite además controlar la replicación cromosómica durante la fase de reproducción del ciclo de vida de B. bacteriovorus.
Introduction
Bdellovibrio bacteriovorus es una bacteria pequeña (0,3-0,5 m por 0,5-1,4 m) gramnegativa que se aprovecha de otras bacterias gramnegativas, incluidos patógenos nocivos como Klebsiella pneumoniae, Pseudomonas aeruginosa y Shigella flexneri1,,2,,3. Dado que B. bacteriovorus mata patógenos, se considera un antibiótico vivo potencial que se puede aplicar para combatir las infecciones bacterianas, particularmente las causadas por cepas multirresistentes.
B. bacteriovorus presenta un ciclo de vida peculiar que consiste en dos fases: una fase de ataque no replicativo de vida libre y una fase reproductiva intracelular(Figura 1). En la fase de vida libre, esta bacteria altamente móvil, que se mueve a velocidades de hasta 160 m/s, busca a su presa. Después de adherirse a la membrana externa de la presa, entra en el periplasma4,5. Durante la fase reproductiva interperiplasmática, B. bacteriovorus utiliza una plétora de enzimas hidrolíticas para degradar las macromoléculas del huésped y reutilizarlas para su propio crecimiento. Poco después de invadir el periplasma, la célula huésped muere y se hincha en una estructura esférica llamada bdelloplast, dentro de la cual la célula depredadora se alarga y replica sus cromosomas. El proceso de replicación comienza en el origen de replicación (oriC)6 y continúa hasta que varias copias del cromosoma se han sintetizado completamente7. Curiosamente, la replicación de cada cromosoma no es seguida por la división celular. En su lugar, el depredador se alarga para formar una célula larga, multinucleoide y filamentosa. Tras el agotamiento de nutrientes, el filamento se somete a septación síncrona y las células progenie se liberan del bdelloplast8.
Antes de B. bacteriovorus puede ser utilizado como un antibiótico vivo contra las infecciones bacterianas, es crucial entender las principales etapas de su ciclo de vida, particularmente las relacionadas con su proliferación dentro de la presa. La imagen de células vivas de B. bacteriovorus ha sido un desafío, debido a las diversas formas morfológicas del depredador y su presa durante el complejo ciclo de vida. Hasta ahora, las interacciones entre B. bacteriovorus y su célula huésped han sido estudiadas principalmente por microscopía electrónica y análisis de disparo a presión2,9,10, ambos de los cuales tienen limitaciones, especialmente cuando se utilizan para monitorear etapas sucesivas del ciclo de vida depredador. Estos métodos proporcionan imágenes de alta resolución de células B. bacteriovorus y permiten la observación de un pequeño depredador durante la fase de ataque o crecimiento. Sin embargo, no permiten el seguimiento de células B. bacteriovorus solas a lo largo de ambas fases del ciclo de vida.
Aquí se presenta un protocolo completo para el uso de microscopía de fluorescencia de lapso de tiempo (TLFM) para monitorear el ciclo de vida completo de B. bacteriovorus. Un sistema que consiste en una almohadilla de agarosa se utiliza en combinación con una placa de imagen celular, en la que las células depredadoras pueden moverse libremente debajo de la almohadilla de agarosa, mientras que las células de presa inmovilizadas son capaces de formar bdelloplasts (Figura 2). Esta configuración se prepara sobre la base de cepas específicas de E. coli y B. bacteriovorus,pero el protocolo puede ser fácilmente alterado para adaptarse a las cepas individuales de un usuario (por ejemplo, llevando diferentes marcadores de selección, proteínas fusionadas con diferentes fluoróforos, etc.).
En este caso, para visualizar B. bacteriovorus durante la fase de ataque, se construyó una cepa específica (HD100 DnaN-mNeonGreen/PilZ-mCherry) que expresa una versión etiquetada fluorescentemente de la proteína citoplasma, PilZ (disponible en nuestro laboratorio bajo petición)7. Esta cepa produce además DnaN (la abrazadera deslizante, una subunidad de holoenzima DNA polimerasa III, fusionada con una proteína fluorescente. Esto permite que la replicación continua del ADN sea monitoreada dentro de las células depredadoras a medida que crecen dentro de los bdelloplasts.
Aunque el protocolo y el software descritos utilizados para la adquisición de imágenes se refieren a un microscopio invertido proporcionado por un fabricante específico (ver Tabla de materiales),esta técnica puede ajustarse para cualquier microscopio invertido equipado con una cámara ambiental u otro soporte de calefacción externo y capaz de obtener imágenes de lapso de tiempo. Para el análisis de datos, los usuarios pueden elegir cualquier software disponible compatible con los formatos de salida individuales.
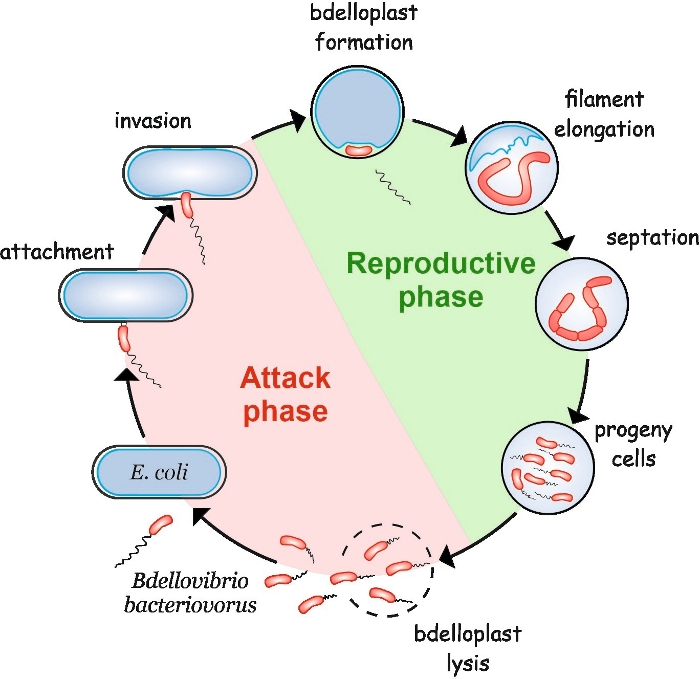
Figura 1: B. ciclo de vida de bacteriovorus en E. coli como célula huésped. Durante la fase de ataque, una célula de B. bacteriovorus de natación libre busca y se une a una célula de E. coli huésped. Después de la invasión, la célula depredadora se localiza en el periplasma de la presa, cambiando la forma de la célula huésped y formando un bdelloplast. La fase reproductiva comienza con la formación de bdelloplast. La célula depredadora digiere la célula de presa y reutiliza compuestos simples para construir sus propias estructuras. B. bacteriovorus crece como un filamento único largo dentro del periplasma del huésped. Cuando se agotan los recursos de la célula de presa, el filamento B. bacteriovorus se septúa sincrónicamente y forma células progenie. Después de que las células progenie desarrollan su flagelo, lisan el bdelloplast. Haga clic aquí para ver una versión más grande de esta figura.
Protocol
Representative Results
Discussion
Debido al mayor interés en el uso de B. bacteriovorus como un antibiótico vivo, se necesitan nuevas herramientas para observar el ciclo de vida depredador, particularmente las interacciones depredador-patógeno, se necesitan. El protocolo presentado se utiliza para realizar un seguimiento de todo el ciclo de vida de B. bacteriovorus, especialmente durante su crecimiento dentro del huésped, en tiempo real. Además, la aplicación de una cepa que produce una abrazadera beta etiquetada fluorescentemente…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
Este estudio fue apoyado por la subvención Opus 2018/29/B/NZ6/00539 al Centro Nacional de Ciencias a J.Z.C.
Materials
| Centrifuge | MPW MED. INSTRUMENTS | MPW-260R | Rotor ref. 12183 |
| CertifiedMolecular Biology Agarose | BIO-RAD | 161-3100 | low fluorescence agarose for agarose pad |
| Fiji | ImageJ | https://imagej.net/Fiji | Open source image processing package |
| Glass Bottom Dish 35 mm | ibidi | 81218-200 | uncoated glass |
| Microscope | GE | DeltaVision Elite | Microtiter Stage, ultimate focus laser module, DV Elite CoolSnap HQ2 Camera, SSI assembly FP DV, kit obj. Oly 100x oil 1.4 NA, prism Nomarski 100x LWD DIC, ENV ctrl IX71 uTiter opaQ 240 V |
| Minisart Filter 0.45 µm | Sartorius | 16555———-K | Cellulose Acetate, Sterile, Luer Lock Outlet |
| Start SoftWoRx | GE | Manufacturer-supplied imaging software |
Riferimenti
- Shatzkes, K., et al. Predatory Bacteria Attenuate Klebsiella pneumoniae Burden in Rat Lungs. mBio. 7 (6), (2016).
- Iebba, V., et al. Bdellovibrio bacteriovorus directly attacks Pseudomonas aeruginosa and Staphylococcus aureus Cystic fibrosis isolates. Frontiers in Microbiology. 5, (2014).
- Willis, A. R., et al. Injections of Predatory Bacteria Work Alongside Host Immune Cells to Treat Shigella Infection in Zebrafish Larvae. Current biology: CB. 26 (24), 3343-3351 (2016).
- Lambert, C., et al. Characterizing the flagellar filament and the role of motility in bacterial prey-penetration by Bdellovibrio bacteriovorus. Molecular Microbiology. 60 (2), 274-286 (2006).
- Lambert, C., et al. A Predatory Patchwork: Membrane and Surface Structures of Bdellovibrio bacteriovorus. Advances in Microbial Physiology. 54, 313-361 (2008).
- Makowski, &. #. 3. 2. 1. ;., et al. Initiation of Chromosomal Replication in Predatory Bacterium Bdellovibrio bacteriovorus. Frontiers in Microbiology. 7, 1898 (2016).
- Makowski, &. #. 3. 2. 1. ;., et al. Dynamics of Chromosome Replication and Its Relationship to Predatory Attack Lifestyles in Bdellovibrio bacteriovorus. Applied and Environmental Microbiology. 85 (14), (2019).
- Fenton, A. K., Kanna, M., Woods, R. D., Aizawa, S. I., Sockett, R. E. Shadowing the actions of a predator: backlit fluorescent microscopy reveals synchronous nonbinary septation of predatory Bdellovibrio inside prey and exit through discrete bdelloplast pores. Journal of Bacteriology. 192 (24), 6329-6335 (2010).
- Kuru, E., et al. Fluorescent D-amino-acids reveal bi-cellular cell wall modifications important for Bdellovibrio bacteriovorus predation. Nature Microbiology. 2 (12), 1648-1657 (2017).
- Dashiff, A., Junka, R. A., Libera, M., Kadouri, D. E. Predation of human pathogens by the predatory bacteria Micavibrio aeruginosavorus and Bdellovibrio bacteriovorus. Journal of Applied Microbiology. 110 (2), 431-444 (2011).

