中性子スピンエコー分光法 による タンパク質ダイナミクスの研究
Summary
本プロトコルは、ヒトの健康に重要な役割を果たす2つのモデルタンパク質の構造および動態を調査するための方法を記載する。この技術は、ベンチトップの生物物理学的特性評価と中性子スピンエコー分光法を組み合わせて、タンパク質のドメイン間運動に関連する時間と長さのスケールでのダイナミクスにアクセスします。
Abstract
ほとんどの人体タンパク質の活性および機能は、タンパク質結晶構造内のサブドメイン全体の構成変化に関連している。結晶構造は、タンパク質の構造またはダイナミクスを記述する計算の基礎を構築しますが、ほとんどの場合、強い幾何学的制限があります。しかしながら、結晶構造からこれらの制限は溶液中には存在しない。溶液中のタンパク質の構造は、ピコ上のループまたはサブドメインのナノ秒時間スケール(すなわち、内部タンパク質ダイナミクス時間レジーム)への再配列のために結晶と異なり得る。本研究は、中性子散乱を用いて数十ナノ秒の時間スケールのスローモーションにどのようにアクセスできるかを記述している。特に、明確に定義された二次構造を欠く本質的に無秩序なタンパク質と古典的な抗体タンパク質である2つの主要なヒトタンパク質の動的特性評価は、中性子スピンエコー分光法(NSE)と幅広い実験室特性評価方法を組み合わせることによって対処されます。タンパク質ドメインダイナミクスに関するさらなる洞察は、実験中性子データを記述し、拡散性タンパク質運動と内部タンパク質運動の組み合わせの間のクロスオーバーを決定するための数学的モデリングを使用して達成された。NSEから得られた中間散乱機能への内部動的寄与の抽出は、様々な動きの時間スケールを含む、単一のタンパク質の機械的特性および混雑したタンパク質溶液中のほぼ自然な環境におけるタンパク質の柔らかさへのさらなるビジョンを可能にする。
Introduction
中性子によるソフトマターのダイナミクスの探査
タンパク質とペプチドの動的特性を調べることは生物物理学的研究の主要な部分であり、今日では幅広いエネルギーランドスケープにアクセスするために多くのよく開発された方法が存在します1。実験的に明らかにされたタンパク質のダイナミクスを生物学的機能に関連付けることは、複雑な数学的モデルとコンピュータ支援ダイナミクスシミュレーションを必要とする、はるかに困難な作業です。タンパク質運動の解析のための中性子分光法の重要性は、いくつかのよく受け入れられ、広く認められている研究1,2,3,4,5で強調されている。内部タンパク質ダイナミクスの多様なエネルギーランドスケープを探索する前に、ソフトマターの動的プロセスと中性子がそれらにアクセスする方法の簡単な概要が必要です。
同位体配置に対する中性子の感度と、それらがソフトマターと示す相互作用の種類により、中性子散乱は最も汎用性の高い調査技術の1つとなっています6。中性子がアクセスできる相関長スケールと相関時間は、核励起や原子振動から、等方性回転や拡散運動のような集団運動やゆっくりとした緩和プロセスまで、幅広いスペクトルがあります。散乱中性子のエネルギー移動を調べる場合、3つの主要な相互作用を区別することができます:サンプル中の入射中性子と粒子との間にエネルギー交換がない弾性散乱。中性子と粒子の間の大規模で定量化可能なエネルギー交換を伴う非弾性散乱;入射中性子エネルギーと比較して非常に小さなエネルギー移動を示す準弾性散乱の特異なケース1,7。これらの相互作用は、調査された材料に関する正確な情報を提供し、多種多様な中性子散乱技術の理論的基礎を形成する。
弾性散乱では、検出器は中性子の方向を回折パターンとして記録し、試料原子の互いに対する位置を示す。原子位置の相関に関する情報(すなわち、構造情報のみに関連する運動量伝達Qに関する積分強度 S( Q))が取得される。この原理は中性子回折8の基礎をなす。
複雑さは、サンプル材料の励起と内部変動のためにエネルギー移動がゼロでなくなったときに発生します。これは中性子分光法の基礎を形成し、散乱中性子はエネルギー移動Eと運動量伝達Qの両方の関数として調査される。動的および構造的情報が得られる。中性子分光法は、エネルギー移動(すなわち、サンプル散乱による中性子の速度変化、S(Q,ω) = S(Q,E)の動的構造因子とも呼ばれる)について、同じ積分強度S(Q)を測定する9。
材料からの散乱を計算するには、ペア相関関数7,10を使用する方が適切です。回折の場合、静的対相関関数 G(r) は、別の粒子の中心から所定の距離 r にある粒子の中心を見つける確率を与えます。分光法は、静的ペア相関関数を一般化し、散乱方程式にエネルギー/周波数/時間を含めます。対相関関数 G(r) は時間 G(r, t) の関数となり、これは別個の原子対相関関数 GN(R, T) と自己相関関数 GS(R, T) に分解されることがある。これらは、コヒーレント散乱を支配する原子の対相関運動と、非コヒーレント散乱を支配する自己相関の2種類の相関を記述している10。
コヒーレント散乱は「平均」からの散乱であり、散乱波の相対的な位相に依存する。小角散乱レジームでは、異なる散乱中心(異なる原子)からの散乱中性子波が建設的に干渉し(同様の相を有する)、原子の集団運動が強い強度増強で観察される。コヒーレント散乱は、本質的に、試料10中の全ての原子核からの単一の中性子の散乱を記述する。
異なる中心からの散乱中性子波の間に建設的な干渉が起こらなければ、単一の原子が時間的に続き、時刻t=0の原子の位置と時刻tの同じ原子との間に自己相関が観察される。したがって、原子の相対位置に関する情報は失われ、焦点は局所的な揺らぎにのみ集中する。局所的な変動による散乱は、一貫性のない散乱を支配します。非コヒーレント散乱は等方性であり、バックグラウンド信号に寄与し、そして信号対雑音10,11を劣化させる。
上記のすべてを組み合わせて、我々は4つの主要な中性子散乱プロセス10を区別します:(1)弾性コヒーレント(原子位置の相関を測定する)、(2)非弾性コヒーレント(原子の集団運動を測定する)、(3)弾性非コヒーレント(背景に寄与し、デバイ・ウォラー係数(DWF)によって散乱強度を減少させ、弾性非コヒーレント構造因子(EISF)を測定し、閉じ込められた幾何学における拡散運動の幾何学を記述し、 (4)非弾性非コヒーレント(単一原子ダイナミクスと自己相関を測定する)。
中性子が生物学でアクセスできるダイナミクスプロセスは、低周波の原子および分子振動の減衰、溶媒分子と生体表面との相互作用、巨大分子の水和層および閉じ込められた幾何学における拡散プロセスから、短距離の並進、回転、転動拡散運動、タンパク質ドメインおよびアロステリック運動1.タンパク質ダイナミクスを測定するための中性子法および機器の多様性は、入射または出射中性子ビームの無色化がどのように達成されるか、および散乱中性子のエネルギー分析がどのように実行されるかに基づいている。3軸から飛行時間、後方散乱、スピンエコー分光計まで、1 x 10-14秒から1 x 10-6秒(フェムト秒からマイクロ秒)12の間の特徴的な時間で動的プロセスを探索することができます。
オークリッジ国立研究所は、2つの有名な中性子源、スパレーション中性子源(SNS13)と高同位体フラックスリアクターHFIR14を備え、生体材料のダイナミクスを調査するための最高の分光計スイートの1つを備えています。最も雄弁な例のいくつかは、溶液16中の緑色蛍光タンパク質の周りの水和水の動的摂動またはいくつかのタンパク質17のサブピコ秒の集団振動を調査するためにSNS15で冷中性子チョッパー分光計(CNCS)を使用することを含む。非弾性中性子散乱調査の繰り返しの問題は、いくつかの生物学的プロセスが観察するには遅すぎるということです。中性子強度の大幅な損失につながる極端なセットアップがなければ、飛行時間分光計は10μeVのエネルギー分解能に制限され、最大時間スケールは〜200ps10,11に対応します。これは、タンパク質の大規模な動きを観察するには不十分です。したがって、後方散乱分光計のようなより高いエネルギー分解能を持つ機器がしばしば必要とされます。飛行時間と後方散乱技術を組み合わせることで、ヒドロキシル化樟脳18を触媒する酵素であるシトクロムP450cam(CYP101)の内部ダイナミクスの変化を調べるのに強力であることが証明されています。
SNS-BASIS19 の後方散乱分光器で測定された微視的拡散度は驚くほど明確に定義されており、中性子散乱によって研究された最初の生きた動物であるプラナリア扁平虫の水の拡散性(水和、細胞質、バルク状の水)と細胞成分の拡散度に分離することができた20.後方散乱は高分解能分光技術ですが、数μeV = 数ナノ秒に制限されていますが、生体材料の遅いダイナミクスは、原子位置やスピン配向の相関の生存時間としても現れます(例えば、緩和プロセス、10〜数百ナノ秒の時間範囲で定期的に発生します)。
中性子スピンエコー分光法(NSE)は、このような高分解能に達する唯一の中性子散乱技術です。他の中性子技術とは異なり、NSEは中性子の量子力学的相(磁気モーメント)を使用するため、ビームの非クロマト化を必要としません。磁気モーメントの操作は、広い中性子ビーム波長分布の使用を可能にするが、この技術は、1 x 10-4のオーダーの非常に小さな中性子速度変化に敏感である。NSEは、多くのタンパク質の溶液中のタンパク質の遅いダイナミクスを調査するために首尾よく使用されてきました。これらの多くの先駆的研究の中で、我々はブタ免疫グロブリン21のセグメント的柔軟性の研究を認める。Taqポリメラーゼ22における結合ドメイン運動;ドメインは、酵母アルコールデヒドロゲナーゼ23の四量体において運動する;基質結合時のホスホグリセリン酸キナーゼの立体構造の変化3;Na+/H+交換調節補因子1(NHERF1)タンパク質におけるドメイン運動の活性化およびアロステリックシグナルの動的伝播4,24,25;水銀イオン還元酵素26のコンパクトな状態のダイナミクス;赤血球27におけるヘモグロビンの拡散とを含む。タンパク質ダイナミクスにおけるさらに最近の2つの研究は、エントロピースプリング28としてのヒト抗体免疫グロブリンG(IgG)の柔軟性と、本質的に障害のあるミエリン塩基性タンパク質(MBP)5のダイナミクスに対する溶媒寄与の特徴を明らかにした5。
本稿では、NSEの基本原理、徹底的なタンパク質ダイナミクス調査に推奨される複数の準備方法、ならびにSNS、SNS-NSEのNSE分光計におけるNSEデータ取得の方法論と実験プロトコルについて説明します。このプロトコルは、通常のヒト抗体タンパク質であるIgGと、本質的に障害のあるタンパク質MBPの2つのタンパク質を特徴付けます。生物物理学的意味合い、例の研究の関連性、および技術の限界について簡単に説明します。
NSE分光法、低速ダイナミクス測定のための方法
NSEは、中性子の飛行時間を利用して、試料中の中性子と原子との準弾性相互作用によるエネルギーの交換(分極の損失)を測定する偏光技術です。NSE分光法の中核には、(1)中性子スピンが磁気強度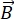 に比例した周波数、すなわちLarmor周波数29で磁場内で歳差運動する能力、および(b)一連の無線周波パルス30を印加するときの偏光信号の操作および再集束を表すスピンエコーまたはハンエコーの2つの基本原理がある。
に比例した周波数、すなわちLarmor周波数29で磁場内で歳差運動する能力、および(b)一連の無線周波パルス30を印加するときの偏光信号の操作および再集束を表すスピンエコーまたはハンエコーの2つの基本原理がある。
NSEプロセスの基本は、図1を使用していくつかの簡単なステップ6,11にまとめることができます。(1)線源(位置1)で生成された中性子ビームは、偏光(位置2)、誘導、輸送(位置3)され、NSE分光器の入口に到着し、そこで最初のπ半フリッパー(位置4)によって90°回転する。(2)偏光ビーム(例えば、中性子磁気モーメント)は、第1磁石の磁力線(第1歳差運動帯、位置5)に対して垂直になり、歳差運動を開始する。(3)磁石の端部では、中性子スピンは磁場強度と内部で過ごした飛行時間(基本的に中性子速度に反比例)に比例した一定の歳差運動角度を蓄積する。個々の中性子速度は、最初の歳差運動ゾーンの最後にある歳差運動角度内で符号化される。(4)サンプル位置に近いパイフリッパー(位置6)はスピンの向きを180°反転させ、歳差運動角の符号を変化させます。(5)中性子は試料の分子(7位)と相互作用し、散乱する。(6)散乱中性子は、第2歳差運動帯(位置8)に入り、歳差運動を行うが、逆向きになる。(7)別のπハーフフリッパー(位置9)を使用して、スピンの向きを水平方向に垂直から回転させる。これにより歳差運動が停止し、歳差運動角度φがcos(φ)に比例した偏光に変換されます。(8)分析装置(10位)は、1つの向きに基づいて中性子を選択する。試料との相互作用が弾力性であれば、中性子の速度は変化しません。中性子は、第1および第2の歳差運動帯で同じ時間を飛行し、蓄積された歳差運動角は完全に回復する。完全な偏光は、元の偏光のエコー(すなわち、スピンエコー)として検出器(位置11)に復元される。(9)しかし、NSEでは散乱は準弾性であるため、中性子と試料分子との間の小さなエネルギー交換は、試料による散乱後の中性子速度が異なる。速度が異なるため、中性子は第2歳差運動帯を飛行するのにさらに時間を費やし、歳差運動角を適切に回復させません。検出器上で部分分極が取り出され、スピン緩和による分極の損失は、中間散乱関数F(Q,t)であるスペクトル関数S(Q,ω)のコスフーリエ変換に比例する。(10) 関数 F(Q, t) の時間パラメータは歳差運動磁場強度に比例する。磁場強度の関数として偏光の損失をスキャンすると、サンプル内の動的プロセスに依存する緩和関数が得られます。

図1:SNS(SNS-NSE)のNSE分光器と、最も重要な機能コンポーネントを含む中性子飛行経路の概略図の写真。 右から左へ:1=中性子源;2 = チョッパー – ベンダー – 偏光子 – 二次シャッターシステム;3 = ビーム輸送ガイド;4 = 最初の90°スピンターンのpi/2フリッパー。5 = 最初の歳差運動ゾーン;6 = 180°スピンターンのためのパイフリッパー。7 = サンプル面積とサンプル環境(ここでは、クライオ炉が示されています)。8 = 第2の歳差運動ゾーン;9 = 2 回目の 90° スピンターンの pi/2 フリッパー。10 = アナライザー;11 = 検出器。(3 の部分、および 2 と 1 の部分は、シールドの内側の青い壁の後ろにあり、チョッパーは原子炉ベースの NSE の速度セレクターに置き換えられています)。 この図の拡大版を表示するには、ここをクリックしてください。
Protocol
Representative Results
Discussion
NSE分光法は、他の分光技術では生成できないタンパク質のダイナミクスのユニークで詳細なビューを提供します。長時間スケールでの測定は、ここに提示されているように、タンパク質の翻訳拡散と回転拡散の両方の観察を提供する。セグメントダイナミクスやその他の内部振動は、短時間スケールでコヒーレント散乱関数 S(Q, t)の強い減衰として現れ、全体的な拡散緩和プロセスか?…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
この研究は、オークリッジ国立研究所が運営する科学ユーザー施設のDOEオフィスであるSpallation Neutron Source(BL-15、BL-6、生物学および化学研究所)のリソースを使用しました。この研究はまた、MLZ-FRM2原子炉ガルヒング(KWS-2、フェニックス-J-NSE)とドイツのフォルシュングツェントルム・ユーリッヒGmbHのJCNS1の資源も使用した。著者は、モデリングの支援とIgGとMBPタンパク質研究の両方への貢献についてRalf Biehl博士とAndreas Stadler博士、NSEデータ削減サポートにPiotr A. Żołnierczuk博士、SANS測定のサポートにChangwoo Do博士、SNS生化学ラボサポートでロンダ・ムーディ博士とケビン・ワイス博士に感謝しています。
Materials
| Bovine MBP protein solution | Sigma-Aldrich | M1891 | lyophilized powder reconstituted in D2O |
| D2O – heavy water | Sigma-Aldrich | Product No. 151882 | liquid |
| Dionized water | in house | – | for washing / cleanning cells |
| DLS instrument | Zetasizer Nano ZS, FZ-Jülich | – | dynamic light scattering instrument |
| Elastic scattering standards | SNS-NSE, ORNL | – | Al2O3 and Graphite powders |
| Ethanol | Sigma-Aldrich | 65350-M | 70% ethanol for cleaning cells |
| IgG protein solution | Sigma-Aldrich | I4506 | lyophilized powder reconstituted in D2O |
| KWS-2 instrument | JCNS outstation at the MLZ, Garching, Germany | – | small angle neutron instrument |
| Liquinox dish detergent | Alconox | – | Phosphate-free liquid lab glassware cleaner |
| Na2HPO4·7H2O | Sigma-Aldrich | Product No.S9390 | disodium phosphate heptahydrate salt |
| NaCl | Sigma-Aldrich | Product No.S9888 | sodium chloride salt |
| NaH2PO4·H2O | Sigma-Aldrich | Product No. S9638 | monosodium phosphate monohydrate salt |
| Nanodrop spectrophotometer | Thermo Scientific | Catalog number: ND-2000 | NanoDrop 2000/2000c Spectrophotometer |
| Neutron alignment camera | NeutronOptics, Grenoble | NOG210222 | 100 x 100 mm camera with Sony IMX249 CMOS sensor |
| Parafilm M – wax parafilm | Bemis | Parafilm M – 5259-04LC PM996 | all-purpose laboratory film in cardboard dispenser |
| Phoenix-J-NSE Spectrometer | JCNS outstation at the MLZ, Garching, Germany | – | neutron spectrometer |
| SasView | https://www.sasview.org/ | ||
| SAXSpace, Anton Paar instrument | FZ-Jülich | – | small angle x-ray instrument |
| Slide-A-Lyzer dialysis membranes | Thermo Scientific | 88400-88405 | Slide-A-Lyzer mini dialysis devices tubes of 3.5 K MWCO |
| SNS Remote Analysis Cluster | Neutron Science Remote Analysis (sns.gov) | https://analysis.sns.gov | |
| SNS-NSE spectrometer | ORNL, Oak Ridge, TN, USA | – | neutron spectrometer |
| Sterile syringe filters | VWR | N.A. PN:28145-501 | 0.2 µm pore size filters |
| Temperature Forcing System (TFS) | SP Scientific | Part Number 100004055 | sample environment equipment |
| Urea -d4 | Sigma-Aldrich | Product No. 176087 | deuterated Urea salt |
| Viscometer | FZ-Jülich | – | falling ball viscometer |
Riferimenti
- Fitter, J., Gutberlet, T., Katsaras, J. . Neutron Scattering in Biology: Techniques and Applications. , (2006).
- Stadler, A., Monkenbusch, M., Biehl, R., Richter, D., Ollivier, J. Neutron spin-echo and TOF reveals protein dynamics in solution. Journal of the Physical Society of Japan. 82, (2013).
- Inoue, R. Large domain fluctuations on 50-ns timescale enable catalytic activity in phosphoglycerate kinase. Biophysical Journal. 99 (7), 2309-2317 (2010).
- Callaway, D. J. E., et al. Controllable activation of nanoscale dynamics in a disordered protein alters binding kinetics. Journal of Molecular Biology. 429 (7), 987-998 (2017).
- Stingaciu, L. R., Biehl, R., Changwoo, D., Richter, D., Stadler, A. M. Reduced internal friction by osmolyte interaction in intrinsically disordered myelin basic protein. Journal of Physical Chemistry Letters. 11 (1), 292-296 (2020).
- Monkenbusch, M., Richter, D. High resolution neutron spectroscopy-a tool for the investigation of dynamics of polymers and soft matter. Comptes Rendus Physique. , (2007).
- Richter, D., Monkenbusch, M., Schwahn, D. Neutron Scattering. Polymer Science: A Comprehensive Reference, 10 Volume Set. , (2012).
- Wilson, C. C. . Single Crystal Neutron Diffraction From Molecular Materials. , (2000).
- Marshall, W. . Theory of thermal neutron scattering. , (1971).
- . Roger Pynn Introduction & Neutron Scattering "Theory" Available from: https://neutrons.ornl.gov/sites/default/files/intro_to_neutron_scattering.pdf (2004)
- Richter, D. Neutron scattering in polymer physics. Physica B: Condensed Matter. 276-278, 22-29 (2000).
- Harroun, T. A., Wignall, G. D., Katsaras, J. Neutron scattering for biology. Neutron Scattering in Biology. , (2006).
- . SNS Available from: https://neutrons.ornl.gov/sna (2020)
- . HFIR Available from: https://neutrons.ornl.gov/hfir (2020)
- . CNCS Available from: https://neutrons.ornl.gov/cncs (2020)
- Perticaroli, S., et al. Description of hydration water in protein (green fluorescent protein) solution. Journal of the American Chemical Society. 139 (3), 1098-1105 (2017).
- Perticaroli, S., Nickels, J. D., Ehlers, G., Sokolov, A. P. Rigidity, secondary structure, and the universality of the boson peak in proteins. Biophysical Journal. 106 (12), 2667-2674 (2014).
- Miao, Y., et al. Coupled flexibility change in cytochrome p450cam substrate binding determined by neutron scattering, NMR, and molecular dynamics simulation. Biophysical Journal. 103 (10), 2167-2176 (2012).
- Mamontov, E., Zamponi, M., Hammons, S., Keener, W. S., Hagen, M., Herwig, K. W. BASIS: A new backscattering spectrometer at the SNS. Neutron News. 19 (3), 22-24 (2008).
- Mamontov, E. Microscopic diffusion processes measured in living planarians. Scientific Reports. 9, 8708 (2018).
- Alpert, Y., Cser, L., Faragó, B., Franěk, F., Mezei, F., Ostanevich, Y. M. Segmental flexibility in pig immunoglobulin G studied by neutron spin-echo technique. Biopolymers. 24 (9), 1769-1784 (1985).
- Bu, Z., Biehl, R., Monkenbusch, M., Richter, D., Callaway, D. J. E. Coupled protein domain motion in Taq polymerase revealed by neutron spin-echo spectroscopy. Proceedings of the National Academy of Sciences of the United States of America. 102 (49), 17646-17651 (2005).
- Biehl, R., et al. Direct observation of correlated interdomain motion in alcohol dehydrogenase. Physical Review Letters. 101, 138102 (2008).
- Farago, B., Li, J., Cornilescu, G., Callaway, D. J. E., Bu, Z. Activation of nanoscale allosteric protein domain motion revealed by neutron spin echo spectroscopy. Biophysical Journal. 99 (10), 3473-3482 (2010).
- Bu, Z., Callaway, D. J. E. Dynamic propagation of long-range allosteric signals by nanoscale protein domain motion revealed by neutron spin echo spectroscopy. Biophysical Journal. 100 (3), 223 (2011).
- Hong, L., et al. Structure and dynamics of a compact state of a multidomain protein, the mercuric ion reductase. Biophysical Journal. 107 (2), 393-400 (2014).
- Longeville, S., Stingaciu, L. -. R. Hemoglobin diffusion and the dynamics of oxygen capture by red blood cells. Scientific Reports. 7, 10448 (2017).
- Stingaciu, L. R., Ivanova, O., Ohl, M., Biehl, R., Richter, D. Fast antibody fragment motion: Flexible linkers act as entropic spring. Scientific Reports. 6, 22148 (2016).
- Hahn, E. L. Nuclear induction due to free larmor precession. Physical Review. 77, 297 (1950).
- Hahn, E. L. Spin echoes. Physical Review. 80, 580 (1950).
- Svergun, D. I., Koch, M. H. J. Small-angle scattering studies of biological macromolecules in solution. Reports on Progress in Physics. 66 (10), 1735-1782 (2003).
- . Sasview Available from: https://www.sasview.org (2020)
- Zhao, J. K., Gao, C. Y., Liu, D. The extended Q-range small-angle neutron scattering diffractometer at the SNS. Journal of Applied Crystallography. 43, 1068-1077 (2010).
- Ohl, M., et al. The high-resolution neutron spin-echo spectrometer for the SNS with τ ≥ 1 µs. Physica B: Condensed Matter. 350, 147-150 (2004).
- . SNS-NSE web page Available from: https://neutrons.ornl.gov/nse (2022)
- Ohl, M., et al. The spin-echo spectrometer at the Spallation Neutron Source (SNS). Nuclear Instruments and Methods in Physics Research, Section A: Accelerators, Spectrometers, Detectors and Associated Equipment. 696, 85-99 (2012).
- Zolnierczuk, P. A., Holderer, O., Pasini, S., Kozielewski, T., Stingaciu, L. R., Monkenbusch, M. Efficient data extraction from neutron time-of-flight spin-echo raw data. Journal of Applied Crystallography. 52 (5), 1022-1034 (2019).
- . Dr Spine hub Available from: https://jugit.fz-juelich.de/nse/drspine (2022)
- Stadler, A. M., et al. Internal nanosecond dynamics in the intrinsically disordered myelin basic protein. Journal of the American Chemical Society. 136 (19), (2014).
- . FZJ Available from: https://www.fz-juelich.de/portal/EN/AboutUs (2022)
- . KWS2 Available from: https://miz-garching.de/kws-2 (2022)
- Moorhouse, M., Barry, P. The protein databank. Bioinformatics Biocomputing and Perl. , (2005).
- Tria, G., Mertens, H. D. T., Kachala, M., Svergun, D. I. Advanced ensemble modelling of flexible macromolecules using X-ray solution scattering. IUCrJ. 2 (2), 207-217 (2015).
- Holderer, O., Monkenbusch, M., Schätzler, R., Kleines, H., Westerhausen, W., Richter, D. The JCNS neutron spin-echo spectrometer J-NSE at the FRM II. Measurement Science and Technology. 90 (4), 043107 (2008).
- Biehl, R., Monkenbusch, M., Richter, D. Exploring internal protein dynamics by neutron spin echo spectroscopy. Soft Matter. 7 (4), 1299-1307 (2011).
- Stingaciu, L. R., Ivanova, O., Ohl, M., Biehl, R., Richter, D. Fast antibody fragment motion: Flexible linkers act as entropic spring. Scientific Reports. 6, 22148 (2016).
- Stadler, A. M., et al. Internal nanosecond dynamics in the intrinsically disordered myelin basic protein. Journal of the American Chemical Society. 136 (19), 6987-6994 (2014).
- Biehl, R., Richter, D. Slow internal protein dynamics in solution. Journal of Physics: Condensed Matter. 26 (50), 503103 (2014).
- Hinsen, K. The molecular modeling toolkit: A new approach to molecular simulations. Journal of Computational Chemistry. 21 (2), 79-85 (2000).
- Uhlenbeck, G. E., Ornstein, L. S. On the theory of the Brownian motion. Physical Review. 36 (5), 823 (1930).
- Wang, M. C., Uhlenbeck, G. E. On the theory of the Brownian motion II. Reviews of Modern Physics. 17, 323 (1945).
- Callaway, D. J. E., Bu, Z. Nanoscale protein domain motion and long-range allostery in signaling proteins-a view from neutron spin echo spectroscopy. Biophysical Reviews. 7 (2), 165-174 (2015).
- Liu, Y. Intermediate scattering function for macromolecules in solution probed by neutron spin echo. Physical Review E. 95, 020501 (2017).
- Liu, Y. Short-time dynamics of proteins in solutions studied by neutron spin echo. Current Opinion in Colloid & Interface Science. 42, 147-156 (2019).

