研究斑马鱼脊椎动物分割的三维尾部外植培养
Summary
在这里,我们介绍了斑马鱼后体轴的三维组织培养方案,从而能够对脊椎动物分割进行实时研究。此除草模型可控制轴伸长、形态源的改变以及细胞下分辨率组织水平的实时成像。
Abstract
脊椎动物胚胎将它们的主要身体轴图案为重复性索米特,椎骨、肌肉和皮肤的前体。当胚胎的尾端后拉长时,从前体间皮(PSM)逐渐分割。索米特形成定期和规模。斑马鱼是一种流行的模型生物体,因为它具有遗传可遗传性,并具有透明的胚胎,允许活成像。然而,在蛋黄化过程中,鱼胚胎被包裹在一个大的四舍五入的蛋黄上。此几何形状限制斑马鱼胚胎中 PSM 组织的实时成像,尤其是在需要接近客观工作距离的更高分辨率下。在这里,我们介绍了一个扁平的三维组织培养方法,用于斑马鱼尾部外植的活成像。尾部外植模仿完整的胚胎,显示轴伸长和缩短罗斯特罗考德索米特长度的比例减慢。我们进一步能够通过去除植物培养来拖延轴伸长速度。这首次使我们能够从轴向拉伸的机械输入中解开信号梯度的化学输入。在未来的研究中,这种方法可以与微流体设置相结合,允许时间控制的药物扰动或脊椎动物分割筛查,而无需任何药物渗透问题。
Introduction
美洲生物分割在自然界中被广泛使用。重复的结构对于横向器官的功能至关重要,如椎骨、肌肉、神经、血管、四肢或身体平面图1中的叶子。由于轴向对称性的生理和几何约束,大多数比拉特里亚的植物,如安妮莉德,节肢动物,和弦-展览分割他们的胚胎组织(如,等,中皮),前后。
脊椎动物胚胎沿着主身体轴依次将它们的半轴线分割成具有物种特异性间隔、计数和大小分布的草体。尽管在一个物种的个体胚胎中具有这种健壮性,但脊椎动物物种之间的软体分割是多才多艺的。细分发生在一个巨大的时间间隔(从斑马鱼的25分钟到人类的5小时),大小(从斑马鱼尾部的约20微米到小鼠的躯干隐士的200μm)和计数(从斑马鱼的32到玉米蛇的300)2。更有趣的是,鱼胚胎可以在广泛的温度下发育(斑马鱼从 +20.5 °C 到 34 °C),同时通过补偿分割间隔和轴向拉长速度来保持其母体完好无损,并具有适当的大小分布。除了这些有趣的特征外,斑马鱼还作为一个有用的模型生物体来研究脊椎动物的分割,因为兄弟姐妹胚胎的外在、同步和透明发育以及它们可访问的遗传工具。从显微镜的角度来看,电传胚胎在笨重的球形蛋黄上发育,伸展和四舍五入周围的胃结组织(图1A)。在本文中,我们介绍了斑马鱼尾巴的扁平三维组织去移植培养物。这种去植系统绕过了蛋黄质量的球形约束,允许获得鱼胚胎的高分辨率活成像,用于蛋黄图案。
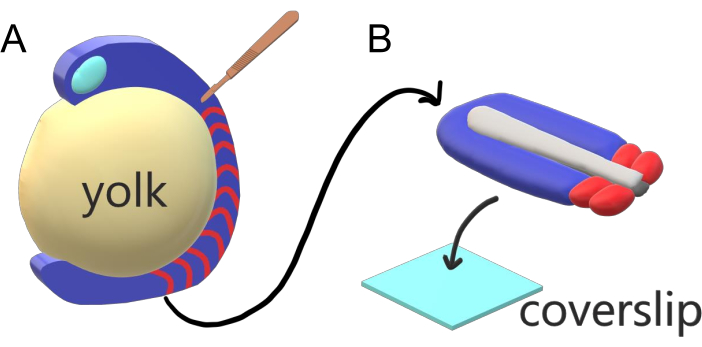
图1:斑马鱼胚胎的滑动室外植系统。(A)斑马鱼胚胎具有活成像的优点,如气化胚胎组织(蓝色)的透明度,但组织围绕一个笨重的球形蛋黄质量(黄色)形成,防止在完整的胚胎中进行近乎客观的高分辨率成像。尾部除外植物可以解剖,从从索米特(红色)组织前部切开的显微外科刀(棕色)开始,然后继续与蛋黄的边界。(B) 解剖的尾部系外植物可放在盖片(浅蓝色)逆向上:保持神经组织(浅灰色)在顶部和诺索德(深灰色)在底部。请单击此处查看此图的较大版本。
Protocol
Representative Results
Discussion
本文介绍了我们最近开发和用于斑马鱼胚胎的组织培养去移植技术的详细协议。我们的技术建立在以前在小鸡8和斑马鱼9,10,11模型生物体的解释方法的基础上。 与此协议准备的尾部外植可以在一个简单的滑动室中存活长达>12小时,继续拉长其主身体轴并分割索米特,直到溶血结束。
<p …Divulgazioni
The authors have nothing to disclose.
Acknowledgements
我们感谢 AECOM 斑马鱼核心设施和辛辛那提儿童兽医服务部的鱼类维护、辛辛那提儿童影像核心的技术援助、迪达尔·萨帕罗夫对视频制作的帮助以及汉娜·海墙编辑手稿。本出版物中报告的研究得到了国家卫生研究院国家普通医学研究所的支持,奖励编号为R35GM140805至E.M.é。内容完全由作者负责,不一定代表国家卫生研究院的官方观点。
Materials
| 1 mL Sub-Q Syringe with PrecisionGlide Needle | Becton, Dickinson and Co. | REF 309597 | for dechorionating embryos and manipulations |
| 200 Proof Ethanol, Anhydrous | Decon Labs | 2701 | for immunostaining |
| Antibiotic Antimycotic Solution (100×) | Sigma-Aldrich | A5955 | for tissue dissection media |
| Calcium Chloride Anhydrous, Powder | Sigma-Aldrich | 499609 | for tissue dissection media |
| Dimethylsulfoxide | Sigma-Aldrich | D5879 | for immunostaining |
| Disposable Scalpel, #10 Stainless Steel | Integra-Miltex | MIL4-411 | for preparing tape slide wells |
| Ethyl 3-aminobenzoate methanesulfonate salt (Tricaine) | Sigma-Aldrich | 886-86-2 | (optional) for anesthesizing tissues older than 20 somites stage |
| Fetal Bovine Serum (FBS) | ThermoFisher | A3160601 | additional for tissue culture media |
| Goat anti-Mouse IgG2b, Alexa Fluor 594 | Invitrogen | Cat#A-21145; RRID: AB_2535781 | secondary antibody for immunostaining |
| L-15 Medium with L-Glutamine w/o Phenol Red | GIBCO | 21083-027 | for tissue dissection media |
| Methanol | Sigma-Aldrich | 179337 | for immunostaining |
| Microsurgical Corneal Knife 2.85 mm Angled Tip Double Bevel Blade | Surgical Specialties | 72-2863 | for tissue dissection |
| Mouse monoclonal anti-ppERK | Sigma-Aldrich | Cat#M8159; RRID:AB_477245 | for ppERK immunostaining |
| NucRed Live 647 ReadyProbes Reagent | Invitrogen | R37106 | (optional) for live staining of cell nuclei |
| Paraformaldehyde Powder, 95% | Sigma-Aldrich | 158127 | for fixation of samples for immunostaining |
| Rat Tail Collagen Coating Solution | Sigma-Aldrich | 122-20 | (optional) for chemically activating slide chambers |
| Stage Top Incubator | Tokai Hit | tokai-hit-stxg | (optional) for temperature control during live imaging |
| Transparent Tape 3/4'' | Scotch | S-9782 | for preparing tape slide wells |
| Triton X-100 | Sigma-Aldrich | X100 | for immunostaining |
| Tween 20 | Sigma-Aldrich | P1379 | for immunostaining |
| Zebrafish: Tg(actb2:2xMCP-NLS-EGFP) | Campbell et al., 2015 | ZFIN: ZDB-TGCONSTRCT-150624-4 | transgenic fish with nuclear localized EGFP |
| Zebrafish: Tg(Ola.Actb:Hsa.HRAS-EGFP) | Cooper et al., 2005 | ZFIN: ZDB-TGCONSTRCT-070117-75 | transgenic fish with cell membrane localized EGFP |
Riferimenti
- Assheton, R. . Growth in length: Embryological Essays. , (1916).
- Gomez, C., et al. Control of segment number in vertebrate embryos. Nature. 454 (7202), 335-339 (2008).
- Westerfield, M. . The Zebrafish Book: a guide for the laboratory use of zebrafish (Danio rerio), 3rd edition. , (1995).
- Icha, J., Weber, M., Waters, J. C., Norden, C. Phototoxicity in live fluorescence microscopy, and how to avoid it. BioEssays. 39 (1700003), (2017).
- Simsek, M. F., Ozbudak, E. M. Spatial fold change of Fgf signaling encodes positional information for segmental determination in zebrafish. Cell Reports. 24 (1), 66-78 (2018).
- Dubrulle, J., Pourquié, O. fgf8 mRNA decay establishes a gradient that couples axial elongation to patterning in the vertebrate embryo. Nature. 427 (6973), 419-422 (2004).
- Diez del Corral, R., et al. Opposing FGF and Retinoid Pathways Control Ventral Neural Pattern, Neuronal Differentiation, and Segmentation during Body Axis Extension. Neuron. 40 (1), 65-79 (2003).
- Stern, H. M., Hauschka, S. D. Neural tube and notochord promote in vitro myogenesis in single somite explants. Biologia dello sviluppo. 167 (1), 87-103 (1995).
- Langenberg, T., Brand, M., Cooper, M. S. Imaging brain development and organogenesis in zebrafish using immobilized embryonic explants. Developmental Dynamics. 228 (3), 464-474 (2003).
- Picker, A., Roellig, D., Pourquié, O., Oates, A. C., Brand, M. Tissue micromanipulation in zebrafish embryos. Methods in molecular biology. 546 (11), 153-172 (2009).
- Manning, A. J., Kimelman, D. Tbx16 and Msgn1 are required to establish directional cell migration of zebrafish mesodermal progenitors. Biologia dello sviluppo. 406 (2), 172-185 (2015).
- Kimmel, C. B., Ballard, W. W., Kimmel, S. R., Ullmann, B., Schilling, T. F. Stages of embryonic development of the zebrafish. Developmental Dynamics. 203 (3), 253-310 (1995).
- Kaufmann, A., Mickoleit, M., Weber, M., Huisken, J. Multilayer mounting enables long-term imaging of zebrafish development in a light sheet microscope. Development. 139, 3242-3247 (2012).

