Induksjon av mikrostreaming ved ikke-sfæriske bobleoscillasjoner i et akustisk levitasjonssystem
Summary
En rask og pålitelig teknikk foreslås for å kontrollere formsvingningene til en enkelt, fanget akustisk boble som er basert på koalescensteknikk mellom to bobler. De steady-state, symmetristyrte bobleformoscillasjonene tillater analyse av væskestrømmen som genereres i nærheten av boblegrensesnittet.
Abstract
Når de ligger nær biologiske barrierer, kan oscillerende mikrobobler øke cellemembranpermeabiliteten, noe som muliggjør internalisering av legemidler og gener. Eksperimentelle observasjoner tyder på at den midlertidige permeabiliseringen av disse barrierene kan skyldes skjærspenning som utøves på cellevev ved kavitasjonsmikrostreaming. Kavitasjonsmikrostreaming er genereringen av virvelstrømmer som oppstår rundt oscillerende ultralydmikrobobler. For å produsere slike væskestrømmer må bobleoscillasjoner avvike fra rent sfæriske svingninger og inkludere enten translasjonsstabilitet eller formmodus. Eksperimentelle studier av bobleinduserte strømmer og skjærspenning på nærliggende overflater er ofte begrenset i omfang på grunn av vanskeligheten med å fange formdeformasjoner av mikrobobler på en stabil og kontrollerbar måte. Vi beskriver utformingen av et akustisk levitasjonskammer for studier av symmetrikontrollerte ikke-sfæriske svingninger. Slik kontroll utføres ved å bruke en koalescensteknikk mellom to nærliggende bobler i et tilstrekkelig intenst ultralydfelt. Kontrollen av ikke-sfæriske svingninger åpner veien for en kontrollert kavitasjon mikrostreaming av en fri overflate-oscillerende mikroboble. Kameraer med høy bildefrekvens gjør det mulig å undersøke kvasi-samtidig den ikke-sfæriske bobledynamikken ved den akustiske tidsskalaen og væskestrømmen på en lavere tidsskala. Det er vist at et stort utvalg av væskemønstre kan oppnås, og at de er korrelert med det modale innholdet i boblegrensesnittet. Vi demonstrerer at selv høyordensformmodusene kan skape væskemønstre over store avstander hvis grensesnittdynamikken inneholder flere moduser, noe som fremhever potensialet for ikke-sfæriske svingninger for målrettet og lokalisert legemiddellevering.
Introduction
I medisin må et administrert legemiddel trenge gjennom mange hindringer i levesystemet før de når de ønskede målene. Imidlertid blir de fleste medisiner raskt renset bort fra blodstrømmen. Målrettingseffektiviteten er lav, og de kan ikke lett krysse cellemembraner, noe som fører til ineffektiv legemiddellevering. For tiden har bruk av mikrobobler i kombinasjon med ultralyd blitt foreslått som en innovativ metode for ikke-invasiv, presis og målrettet levering av medisiner og gener til patologiske vev og celler1. I denne tilnærmingen kan mikrobobler spille en rolle som bærere der gratis legemidler enten injiseres samtidig med en gassboblesuspensjon eller lastes på overflaten. Mikrobobler kan også fungere som en lokal vektor for å refokusere ultralydenergien for å interagere med cellene. I utgangspunktet, under ultralydeksponering, komprimerer og utvider bobler stabilt, et regime som kalles stabil kavitasjon som genererer væskestrømmer og dermed skjærspenning på nærliggende gjenstander. Mikrobobler kan også svinge ikke-lineært og ekspandere til kollaps, i treghetskavitasjonsregimet, og produsere sjokkbølger som forplanter seg radialt fra kollapsstedet2. Det har vist seg at kavitasjon, enten stabil eller treghet, forbedrer permeabiliseringen av cellemembraner, og forbedrer dermed internaliseringen av legemidler i cellen3.
I terapeutiske anvendelser er det svært viktig å forstå mekanismen for boble-celle-interaksjonen, men det er flere barrierer, både fra vitenskapelige og tekniske sider, som hindrer vår kunnskap i å utvikle seg. For det første er det svært vanskelig å fange dynamikken til celler som respons på bobleinduserte mekaniske stimuli4. På den akustiske tidsskalaen kan førsteordens mikrobobleoscillasjoner føre til aktivering av membrankanaler, noe som letter molekylær passasje over biologiske grensesnitt. Dette skjer gjennom direkte svingning av cellemembranen, også kalt “cellulær massasje”5. Kanalaktivering etter direkte mekanisk belastning ble påvist ved hjelp av patch-clamp-teknikker som målte elektrofysiologiske egenskaper til cellemembraner under og etter ultralydeksponering6. Måling av bobleindusert celledynamikk (som betyr hele feltet for deformasjon av cellemembranen) på den akustiske tidsskalaen, vil også gi innsikt i terskelen for membranområdeutvidelse ΔA / A som kreves for å indusere porene i cellemembranen7. Den andre barrieren er å kontrollere det kollapsende bobleregimet for å unngå mikrobobleindusert cellelyse. Boblekollapser og induserte mikrostråler har blitt identifisert som en mekanisme gjennom hvilken membranperforering skjer 8,9. Når den er permeabilisert, reparerer cellemembranen gjennom kalsiumselvforsegling av lipid-dobbeltlagene og fusjon av intracellulære vesikler9. Forekomsten av boblekollapser kan også forårsake dødelige skader på cellen og indusere unødvendige bivirkninger i de omkringliggende. I sensitive applikasjoner som ultralydmediert blod-hjernebarriereåpning er det generelt akseptert at treghetsboblekollapser bør unngås10.
Derfor er det for tiden lagt stor vekt på utformingen av ultralydutslippssekvenser, kombinert med passiv kavitasjonsovervåking og kontroll, for å sikre stabile svingninger av mikrobobler11. I dette stabile regimet har det blitt antatt at stabilt oscillerende bobler spiller en sterk rolle i utløsningen av membranpermeabilisering ved å fremme romlig målrettet skjærspenning på cellemembranen7. Skjærspenningen skyldes væskestrømmene som oppstår i nærheten av de oscillerende boblene. Disse væskestrømmene kalles kavitasjonsmikrostreaming, og som nevnt ovenfor er de en av flere mulige mekanismer som er ansvarlige for økt opptak av ekstracellulære molekyler. Når det gjelder suspensjon av bobler eller celler som in vitro biologiske transfeksjonsanalyser12, kan permeabilisering ved mikrostreaming være mye mer effektiv enn permeabilisering ved boblekollaps. Dette kan vises ved en enkel geometrisk vurdering. I cellesuspensjoner vil sonoporasjon være effektiv hvis flertallet av de suspenderte cellene blir utsatt for tilstrekkelig store mekaniske effekter (som fører til membranpermeabilisering). Det er kjent at boblekollapser er rettet langs retningen av isotrop symmetribrudd, for eksempel bobleveggaksen13 eller bobleboble- og boblecellelinjen som forbinder deres massesenter14. Den produserte mikrostrålen er derfor et romlig lokalisert fenomen langs et endelig antall linjer som forbinder celle- og boblesentrene. Avhengig av celle- og boblekonsentrasjonen, så vel som boblecelleavstanden, kan denne effekten ikke være den mest effektive for å permeabilisere hele antall suspenderte celler. I motsetning til dette er kavitasjonsmikrostreaming et fenomen som forekommer på en langsom tidsskala, med en stor romlig ekspansjon i forhold til bobleradiusen. Væskestrømmen fordeles også rundt boblen, og kan derfor påvirke et større antall celler, på svært lang avstand. Derfor er forståelse av den genererte kavitasjonsmikrostrømmen rundt en oscillerende boble en forutsetning for å kontrollere og kvantifisere det bobleinduserte skjærspenningen som påføres celler.
For å gjøre dette består et foreløpig trinn i å kontrollere de sfæriske og ikke-sfæriske svingningene til en ultralyddrevet boble, da de genererte væskestrømmene induseres av bevegelsen til boblegrensesnittet15,16. Spesielt må formsvingninger av mikrobobler utløses og holdes stabile. Videre må orienteringen av bobleformoscillasjonene kontrolleres for å analysere korrelasjonen mellom boblegrensesnittdynamikken og det induserte mikrostreamingmønsteret riktig. Når man oppsummerer eksisterende litteratur, er det åpenbart at detaljerte eksperimentelle resultater av kavitasjonsindusert mikrostreaming bare er tilgjengelige for bobler festet til en overflate. Veggfestede mikrobobler brukes ofte til å vurdere nøyaktig grensesnittdynamikk og celleinteraksjoner på mikrometerskala under et ultrafast mikroskopisystem. Denne konfigurasjonen er terapeutisk relevant når man vurderer vibrerende mikrobobler plassert på cellemembranen17,18,19. Studien av substratfestet boble kan imidlertid gjøre analysen av bobledynamikk mer komplisert, delvis på grunn av den komplekse naturen til kontaktlinjedynamikk20, og utløsningen av asymmetriske formmodi21. I medisinske og biologiske applikasjoner, bobler som ikke er festet til en vegg er ofte funnet i begrensede geometrier som små fartøy. Dette påvirker bobledynamikken og formustabiliteten betydelig. Spesielt forskyver tilstedeværelsen av en nærliggende vegg trykkterskelen for formmodus som utløser lavere trykkverdier avhengig av formmodusnummer og boblestørrelse22. Veggen påvirker også den bobleinduserte mikrostrømmen med muligens høyere intensitet for den produserte strømmen23.
Blant alle mulige scenarier som mikrobobler kan oppleve (fri eller festet, nær en vegg, kollapser eller stabilt oscillerende), foreslår vi å undersøke den ikke-sfæriske dynamikken til en enkelt boble langt fra noen grense. Det eksperimentelle oppsettet er basert på et akustisk levitasjonssystem24 der en stående ultralydbølge brukes til å fange boblen. Dette scenariet er konsistent med medisinske applikasjoner der en samling av suspenderte bobler og celler sameksisterer i et sonotransfeksjonskammer, for eksempel. Så langt som bobler og celler ikke er for nært, antas det at tilstedeværelsen av en celle ikke påvirker boblegrensesnittdynamikken. Når celler følger de sløyfelignende banene til den kavitasjonsinduserte mikrostrømmen, nærmer de seg syklisk og frastøter seg fra bobleplasseringen, og vi kan anta at celletilstedeværelsen verken påvirker strømningsmønsteret eller dets gjennomsnittlige hastighet. I tillegg er ikke-sfærisk dynamikk og indusert mikrostreaming fra enkeltbobler langt fra grense velkjent fra et teoretisk synspunkt. For å koble den bobleinduserte væskestrømmen til boblekonturdynamikken, er det nødvendig å nøyaktig karakterisere boblegrensesnittdynamikken. For å gjøre dette er det å foretrekke å tilpasse den spatiotemporale skalaen i eksperimentelle studier med hensyn til de som brukes i terapeutikk, slik at oppkjøp med vanlige høyhastighetskameraer (under 1 million bilder / sekund) er mulig ved å bruke store bobler eksitert ved lavere frekvenser. Når man vurderer ubelagte bobler, er egenfrekvensen ω n for en gitt modus n relatert til boblestørrelsen som 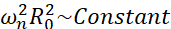 25. Dette radius-egenfrekvensforholdet er litt modifisert når man vurderer avskallede bobler26, men størrelsesordenen til egenfrekvensen ωn forblir den samme. Dermed er undersøkelse av bobler med likevektsradier ~ 50μm i et 30 kHz ultralydfelt lik å studere belagte bobler av radier ~ 3μm i et 1.7 MHz-felt, som foreslått av Dollet et al.27. Lignende formmodusnumre og dermed mikrostreamingmønstre forventes derfor.
25. Dette radius-egenfrekvensforholdet er litt modifisert når man vurderer avskallede bobler26, men størrelsesordenen til egenfrekvensen ωn forblir den samme. Dermed er undersøkelse av bobler med likevektsradier ~ 50μm i et 30 kHz ultralydfelt lik å studere belagte bobler av radier ~ 3μm i et 1.7 MHz-felt, som foreslått av Dollet et al.27. Lignende formmodusnumre og dermed mikrostreamingmønstre forventes derfor.
For å utløse ikke-sfæriske svingninger i boblegrensesnittet, er det nødvendig å overskride en viss trykkterskel som er radiusavhengig, som vist i figur 1. Eksisterende eksperimentelle teknikker er avhengige av økningen av det akustiske trykket for å utløse overflatemoduser (illustrert ved bane (1) i figur 1), enten ved trinnvis trykkøkning28 eller ved modulert amplitudeeksitasjon som er ansvarlig for periodisk utbrudd og utryddelse av overflatemodus29. De viktigste ulempene med disse teknikkene er (i) en tilfeldig orientering av symmetriaksen til overflatesvingningene som ikke kan kontrolleres for å være i avbildningsplanet, (ii) en kort levetid for bobleformsvingningene som gjør analysen av de induserte væskestrømmene vanskelig ved større tidsskalaer, og (iii) den hyppige utløsningen av ustabile formmoduser. Vi foreslår en alternativ teknikk for å krysse trykkterskelen ved et konstant akustisk trykk i radius/trykkkartet, som illustrert ved banen (2) i figur 1. For å gjøre det, er det nødvendig å øke boblestørrelsen slik at den vil være i ustabilitetssonen. En slik økning utføres ved en boblekoalescensteknikk. Koalescensen av to, i utgangspunktet sfærisk oscillerende, mikrobobler utnyttes for å skape en enkelt deformert boble. Hvis det akustiske trykket og boblestørrelsen til den koalescerte boblen er i ustabilitetssonen, utløses overflatemoduser. Vi viste også at koalesensteknikken induserer stabile formsvingninger i et steady-state-regime, samt en kontrollert symmetriakse definert av rettlinjet bevegelse av de to nærliggende boblene. Fordi en stabil formsvingning sikres over minutter, er analysen av bobleindusert væskestrøm mulig ved å så væskemediet med fluorescerende mikropartikler, opplyst av et tynt laserark. Registrering av bevegelsen av de faste mikropartiklene i nærheten av boblegrensesnittet gjør det mulig å identifisere mønsteret av den induserte væskestrømmen30. Det overordnede prinsippet for utløsing av bobleformsvingninger, som fører til en tidsstabil væskestrøm, er illustrert i figur 2.
I den følgende protokollen skisserer vi trinnene som kreves for å skape stabile bobleformoscillasjoner via koalesensteknikken og beskriver målingene av væskestrøm. Dette inkluderer utformingen av det akustiske levitasjonssystemet, den akustiske kalibreringen, boblekjernedannelsen og koalesensteknikken, måling av boblegrensesnittdynamikk og omgivende væskestrøm og bildebehandling.
Protocol
Representative Results
Discussion
Den presenterte prosedyren består av å bruke boblekoalescens for å utløse steady-state, symmetrikontrollerte bobleformoscillasjoner, slik at studiet av den langsiktige væskestrømmen indusert av disse svingningene. Hovedutfordringen i teknikken er kontrollen av ikke-sfæriske svingninger for at en boble blir fanget, langt fra noen grenser.
De fleste av de eksisterende teknikkene som ble foreslått i litteraturen, fokuserte på substratfestede bobler 7,16…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
Dette arbeidet ble støttet av LabEx CeLyA ved Universitetet i Lyon (ANR-10-LABX-0060 / ANR-11-IDEX-0007).
Materials
| Aspherical lens | Thorlabs | AL4050 | Lens of focus 40 mm |
| Continuous wave laser source | CNI | MLL6FN | DPSS laser of wavelength 532nm, energy 400 mW |
| Cylindrical plano-concave lens | Thorlabs | LJ1277L1-A | lens of focus -25?4mm |
| Cylindrical plano-concave lens | Thorlabs | LK1900L1 | lens of focus 250 mm |
| Fluorescent particles | Duke Scientific | R700 | Red polymer fluorescent microspheres |
| Function generator | Agilent | HP33120 | Generator of function feeding the ultrasound transducer |
| High-speed camera | Vision Research | Phantom v12.0 | High-speed recording up to 1 Mfps |
| Liquid medium | Carlo Erba | Water for analysis | Demineralized, undegassed water |
| Multiphysics software | Comsol | None | Softwate for simulating the acoustic field of the levitation chamber |
| Nd:Yag pulsed laser | New Wave Research | Solo III-15 | 5 ns pulse duration, λ=532 nm, 3.5 mm beam diameter, up to 50 mJ |
| Plano-concave lens | Thorlabs | N-BK7 | lens of focus 125 mm |
| Spherical concave lens | Thorlabs | N-SF11 | Bi-concave lens of focus -25mm |
| Ultrasound transducer | SinapTec | Custom-made | Nominal frequency 31kHz, active area 35mm diameter |
| Visualization software | NIH | ImageJ | Software for image processing and analysis in Java |
| XY Linear stage | Newport | M-406 | Displacement stage with micrometric screw |
| Z-axis linear stage | Edmund Optics | 62-299 | Vertical displacement stage with micrometric screw |
Riferimenti
- Roovers, S., et al. The role of ultrasound-driven microbubble dynamics in drug delivery: from microbubble fundamentals to clinical translation. Langmuir. 35 (31), 10173-10191 (2019).
- Liu, H. L., Fan, C. H., Ting, C. Y., Yeh, C. K. Combining microbubbles and ultrasound for drug delivery to brain tumors: current progress and overview. Theranostics. 4 (4), 432-444 (2014).
- Lammertink, B. H. A., et al. Sonochemotherapy: from bench to bedside. Frontiers in Pharmacology. 6, 138 (2015).
- Lajoinie, G., et al. In vitro methods to study bubble-cell interactions: fundamentals and therapeutic applications. Biomicrofluidics. 10, 011501 (2016).
- Van Wamel, A., Bouakaz, A., Versluis, M., de Jong, N. Micromanipulation of endothelial cells: ultrasound-microbubble-cell interaction. Ultrasound in Medicine and Biology. 30, 1255-1258 (2004).
- Tran, T. A., Roger, S., Le Guennec, J. Y., Tranquart, F., Bouakaz, A. Effect of ultrasound-activated microbubbles on the cell electrophysiological properties. Ultrasound in Medicine and Biology. 33, 158-163 (2007).
- Marmottant, P., Hilgenfeldt, S. Controlled vesicle deformation and lysis by single oscillating bubbles. Nature. 423 (6936), 153-156 (2003).
- Prentice, P. A., Cuschieri, K., Dholakia, K., Prausnitz, M., Campbell, P. Membrane disruption by optically controlled microbubble cavitation. Nature Physics. 1, 107-110 (2005).
- Kudo, N., Okada, K., Yamamoto, K. Sonoporation by single-shot pulsed ultrasound with microbubbles adjacent to cells. Biophysical Journal. 96, 4866-4876 (2009).
- Novell, A., et al. A new safety index based on intrapulse monitoring of ultra-harmonic cavitation during ultrasound-induced blood-brain barrier opening procedures. Scientific Reports. 10, 10088 (2020).
- Cornu, C., et al. Ultrafast monitoring and control of subharmonic emissions of an unseeded bubble cloud during pulsed sonication. Ultrasonics Sonochemistry. 42, 697-703 (2018).
- Reslan, L., Mestas, J. L., Herveau, S., Béra, J. C., Dumontet, C. Transfection of cells in suspension by ultrasound cavitation. Journal of Controlled Release. 142 (2), 251-258 (2010).
- Reuter, F., Gonzalez-Avila, S. R., Mettin, R., Ohl, C. D. Flow fields and vortex dynamics of bubbles collapsing near a solid boundary. Physical Review Fluids. 2, 064202 (2017).
- Chew, L. W., Klaseboer, E., Ohl, S. W., Khoo, B. C. Interaction of two differently sized oscillating bubbles in a free field. Physical Review E. 84, 066307 (2011).
- Doinikov, A. A., Bouakaz, A. Acoustic microstreaming around a gas bubble. The Journal of the Acoustical Society of America. 127 (2), 703-709 (2010).
- Tho, P., Manasseh, R., Ooi, A. Cavitation microstreaming patterns in single and multiple bubble systems. Journal of Fluid Mechanics. 576, 191-233 (2007).
- Van Wamel, A., et al. Vibrating microbubbles poking individual cells: Drug transfer into cells via sonoporation. Journal of Controlled Release. 112, 149-155 (2006).
- Helfield, B., Chen, X., Watkins, S. C., Villanueva, F. S. Biophysical insight into mechanisms of sonoporation. PNAS. 113 (36), 9983-9988 (2016).
- Pereno, V., et al. Layered acoustofluidic resonators for the simultaneous optical and acoustic characterization of cavitation dynamics, microstreaming, and biological effects. Biomicrofluidics. 12, 034109 (2018).
- Shklyaev, S., Straube, A. V. Linear oscillations of a compressible hemispherical bubble on a solid substrate. Physics of Fluids. 20, 052102 (2008).
- Fauconnier, M., Bera, J. C., Inserra, C. Nonspherical modes non-degeneracy of a tethered bubble. Physical Review E. 102, 033108 (2020).
- Xi, X., Cegla, F., Mettin, R., Holsteyns, F., Lippert, A. Study of non-spherical bubble oscillations near a surface in a weak acoustic standing wave field. The Journal of the Acoustical Society of America. 135, 1731 (2014).
- Doinikov, A. A., Bouakaz, A. Effect of a distant rigid wall on microstreaming generated by an acoustically driven gas bubble. Journal of Fluid Mechanics. 742, 425-445 (2014).
- Cleve, S., Guédra, M., Inserra, C., Mauger, C., Blanc-Benon, P. Surface modes with controlled axisymmetry triggered by bubble coalescence in a high-amplitude acoustic field. Physical Review E. 98, 033115 (2018).
- Lamb, H. . Hydrodynamics. 6th ed. , (1932).
- Liu, Y., Wang, Q. Stability and natural frequency of nonspherical mode of an encapsulated microbubble in a viscous liquid. Physics of Fluids. 28, 062102 (2016).
- Dollet, B., et al. Nonspherical oscillations of ultrasound contrast agent microbubbles. Ultrasound in Medicine and Biology. 34 (9), 1465-1473 (2008).
- Versluis, M., et al. Microbubble shape oscillations excited through ultrasonic parametric driving. Physical Review E. 82, 026321 (2010).
- Guédra, M., Cleve, S., Mauger, C., Blanc-Benon, P., Inserra, C. Dynamics of nonspherical microbubble oscillations above instability threshold. Physical Review E. 96, 063104 (2017).
- Cleve, S., Guédra, M., Mauger, C., Inserra, C., Blanc-Benon, P. Microstreaming induced by acoustically trapped, non-spherically oscillating microbubbles. Journal of Fluid Mechanics. 875, 597-621 (2019).
- Doinikov, A. A., Cleve, S., Regnault, G., Mauger, C., Inserra, C. Acoustic microstreaming produced by nonspherical oscillations of a gas bubble. I. Case of modes 0 and m. Physical Review E. 100, 033104 (2019).
- Inserra, C., Regnault, G., Cleve, S., Mauger, C., Doinikov, A. A. Acoustic microstreaming produced by nonspherical oscillations of a gas bubble. III. Case of self-interacting modes n-n. Physical Review E. 101, 013111 (2020).
- Prabowo, F., Ohl, C. D. Surface oscillations and jetting from surface attached acoustic driven bubbles. Ultrasonics Sonochemistry. 18 (1), 431-435 (2011).
- Garbin, V., et al. Changes in microbubble dynamics near a boundary revealed by combined; optical micromanipulation and high-speed imaging. Applied Physics Letters. 90, 114103 (2007).
- Collis, J., et al. Cavitation microstreaming and stress fields created by microbubbles. Ultrasonics. 50, 273-279 (2010).
- Loughran, J., Eckersley, R. J., Tang, M. X. Modeling non-spherical oscillations and stability of acoustically driven shelled microbubbles. The Journal of the Acoustical Society of America. 131 (6), 4349-4357 (2012).
- Vos, H. J., Dollet, B., Bosch, J. G., Versluis, M., de Jong, N. Nonspherical vibrations of microbubbles in contact with a wall – a pilot study at low mechanical index. Ultrasound in Medicine and Biology. 34 (4), 685-688 (2008).
- Regnault, G., Mauger, C., Blanc-Benon, P., Inserra, C. Secondary radiation force between two closely spaced acoustic bubbles. Physical Review E. 102, 031101 (2020).

