初期段階の椎間板疾患をシミュレートする炎症性の退行性臓器培養モデル。
Summary
このプロトコルは、初期段階の椎間板変性をシミュレートする炎症誘発性、変性ウシ器官培養の新しい実験モデルを提示する。
Abstract
症候性椎間板(IVD)変性(IDD)は、主要な社会経済的負担であり、炎症および組織の劣化を特徴とする。原因治療の欠如のために、疾患の進行に関与するメカニズムを研究し、治療目標を見つけ、動物モデルの必要性を減らすために、革新的な実験的臓器培養モデルが緊急に必要とされています。ここでは、IDD中に存在する炎症誘発性および同化微小環境を模倣した新しい3次元臓器培養モデルプロトコルを紹介する。
最初に、ウシのカウダルIVDを、組織培養培地で解剖、洗浄、培養した。動的生理学的または病理学的負荷を、1日2時間のカスタムメイドのバイオリアクターに適用した。IVDは、コントロール群(高グルコース培地、生理的負荷、リン酸緩衝生理食塩水注射)および病理学的群(低グルコース培地、病理学的負荷、腫瘍壊死因子α注射)に4日間割り当てられた。IVDsの採取されたパルポスス細胞および酵素結合免疫吸着剤アッセイから遺伝子発現解析を行った。
我々のデータは、対照群と比較して病理学群に負荷を与えた後、炎症性マーカーの高い発現と椎間板高の低下を明らかにした。このプロトコルは、IVDの炎症や変性をシミュレートするために信頼性が高く、さらにアプリケーションの範囲を広げるために拡大することができます。
Introduction
腰痛(LBP)は、すべての年齢の個人に影響を与えることができ、障害の主な原因は、世界1、2、3。LBP に関連する総コストは、年間 1,000 億ドルを超える4,5.症候性椎間板(IVD)変性(IDD)は、炎症および組織劣化を特徴とする状態であり、LBP6、7の主要な原因である。具体的には、IDDは、加速病理、神経疾患、および最終的に障害につながる複数の要因によって誘発され、誘発されるIVDの細胞外マトリックス(ECM)の徐々に進化する内訳によって特徴付けられる。さらに、IDDは、炎症性サイトカインの放出に関連しており、脊椎バイオメカニクス、血管新生、および神経の成長は、痛みの感覚を増加させ、慢性LBP(活動性ディスコパシー)6,8を完全に引き起こす。現在までに、治療の選択肢には、隣接する椎骨の椎間剥離およびそれに続く融合、IVD人工関節の移植、または非ステロイド性抗炎症薬、オピオイド、およびIDD9患者に対する筋弛緩剤などの非外科的アプローチが含まれる。外科的および非外科的な両方の現在の標準的な治療オプションは、部分的にしか有効であり、根本的な生物学的問題9,10に対処することができない。初期の退行性ディスク疾患は、初期の炎症性組織応答、特に腫瘍壊死因子α(TNF-α)発現11の増加を特徴とする。これらの初期のディスク変化は、主にディスクアーキテクチャを破壊することなく細胞レベルで起こり、以前は炎症促進条件12の下で栄養不足によって模倣され得る。したがって、これらの変性機構を調査し、適切な治療標的を見つけるためにin vivo状況の精密なシミュレーションが重要である。さらに、これらの分子特性のシミュレーションでは、ディスクの機械的負荷環境は、IVDの病理学的および生理学的変化において重要な役割を果たす。したがって、これらのアプローチを組み合わせることで、生体内のIVDの複雑な微小環境を模倣する一歩前進を生み出します。現在、私たちの知識を最大限に活用するために、炎症促進と栄養の設定と共に動的ローディングの側面を考慮した研究はありません。
大規模な動物モデルは、インビボ相互作用に関連する潜在的な調査を可能にしますが、コストがかかり、作業集約的です。また、研究における動物モデルの使用は長い間論争の問題であったため、重要な研究課題に答えるために必要な動物の数の減少は大きな関心事です。最後に、IVD研究13,14においてIDDを模倣する理想的な動物モデルは現在存在しない。したがって、IDDおよび関連する炎症および変性プロセスをシミュレートする臓器培養モデルのような費用対効果の高い、信頼性の高い置換を確立する必要がある。近年、初期段階の椎間板疾患をシミュレートする炎症誘発性および退行性臓器培養モデルの確立に本プロトコルを適用して、IDD臓器培養15における抗炎症薬の効果を調べ得た。
ここでは、低栄養性の培地条件下での腫瘍壊死因子α(TNF-α)の直接の日の注入とバイオリアクターでの変性負荷によって引き起こされる、異化および炎症誘発性微小環境を介して、牛椎間板を取得し、早期IDDの状態を誘導する方法を説明する。 図1 は実験モデルを示し、変性および生理的負荷条件をシミュレートするために使用されるバイオリアクターを示す。
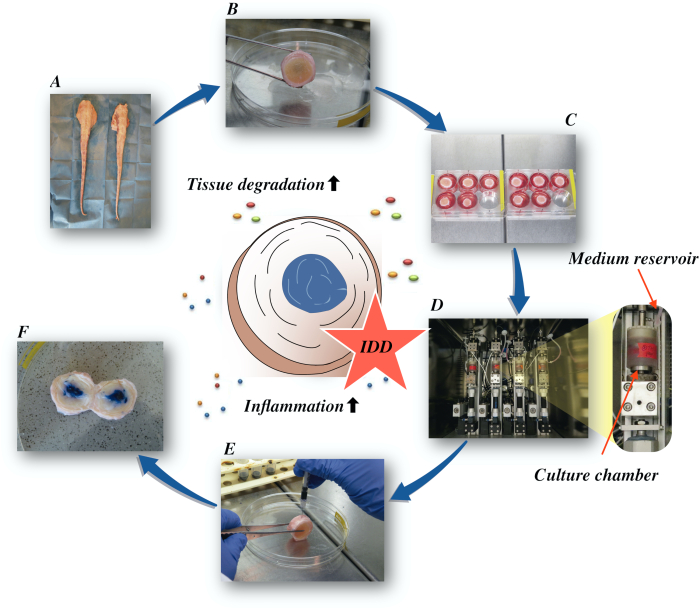
図1: 実験用セットアップの図A: 牛の尾; B: 牛の椎間板を解剖; C: ディスクを培養培地と共にウェルプレートに移す。 D: バイオリアクターでシミュレーションをロードする。 E: 椎間板内注射技術; F: PBS/トリパンブルー染料を注入した後のIVDが分布を明らかにする。IDD:椎間板変性。 この図の大きなバージョンを表示するには、ここをクリックしてください。
Protocol
Representative Results
Discussion
我々はここで変性および炎症性IVDDをシミュレートするための詳細なプロトコルを提供した。このプロトコルは、ディスクに破壊的な影響をもたらす炎症経路の詳細な検査に適用することができる。さらに、このプロトコルは、疾患の進行に関与する有望な治療標的を決定するのに役立つ。
我々は最近、ヒト組換えTNF-αがウシおよびヒトNP細胞21の両方に…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
この作品は、AO財団とアオスパイン・インターナショナルによって支援されました。ババク・サラヴィは、ドイツ脊椎財団とドイツ変形性関節症財団からフェローシップ支援を受けました。ゲルト・ラングは、ドイツのフライブルク大学医学部先端臨床医のためのベルタ・オッテンシュタイン・プログラムの支援を受けました。
Materials
| 1-Bromo-3-chloropropane(BCP) | Sigma-Aldrich, St. Louis, USA | B9673 | |
| Ascorbate-2-phosphate | Sigma-Aldrich, St. Louis, USA | A8960 | |
| Band saw | Exakt Apparatebau, Norderstedt, Germany | model 30/833 | |
| Betadine | Munndipharma, Frankfurt, Germany | ||
| Bovine IL-8 Do.it-Yourself ELISA | Kingfisher Biotech, St. Paul, USA | DIY1028B-003 | |
| Corning ITS Premix | Corning Inc., New York, USA | 354350 | |
| DMEM high glucose | Gibco by life technologies, Carlsbad, USA | 10741574 | |
| DMEM low glucose | Gibco by life technologies, Carlsbad, USA | 11564446 | |
| Ethanol for molecular biology | Sigma-Aldrich, St. Louis, USA | 09-0851 | |
| Fetal Bovine Serum (FBS) | Gibco by life technologies, Carlsbad, USA | A4766801 | |
| Non-essential amino acid solution | Gibco by life technologies, Carlsbad, USA | 11140050 | |
| Penicillin/Streptomycin(P/S) | gibco by life technologies, Carlsbad, USA | 11548876 | |
| Phosphate Buffer Solution, tablet | Sigma-Aldrich, St. Louis, USA | P4417 | |
| Pronase | Sigma-Aldrich, St. Louis, USA | 10165921001 | |
| Primocin | InvivoGen, Sandiego, USA | ant-pm-05 | |
| Pulsavac Jet Lavage System | Zimmer, IN,USA | ||
| TissueLyser II | Quiagen, Venlo, Netherlands | 85300 | |
| Streptavidinn-HRP | Kingfisher Biotech, St. Paul, USA | AR0068-001 | |
| Superscript VILO | Invitrogen by life Technologies, Carlsbad, USA | 10704274 | |
| cDNA Synthesis Kit | Applied Biosystems by life technologies | 10400745 | |
| TaqMan Universal Master Mix | Applied Biosystems by life technologies | ||
| TNF-alpha, recombinant human protein | R&D systems, Minnesota, USA | 210-TA-005 | |
| TRI Reagent | Molecular Research Center, Cincinnati, USA | TR 118 | |
| Tris-EDTA buffer solution | sigma-Aldrich, St. Louis, USA | 93283 | |
| Gene bIL-6 | Applied Biosystems by life technologies | Custom made probes | Primer fw (5′–3′) TTC CAA AAA TGG AGG AAA AGG A Primer rev (5′–3′) TCC AGA AGA CCA GCA GTG GTT Probe (5′FAM/3′TAMRA) CTT CCA ATC TGG GTT CAA TCA GGC GATT |
| Gene bIL8 | Applied Biosystems by life technologies | Bt03211906_m1 | |
| Gene bTNF-alpha | Applied Biosystems by life technologies | Custom made probes | Primer fw (5′–3′) CCT CTT CTC AAG CCT CAA GTA ACA A Primer rev (5′–3′) GAG CTG CCC CGG AGA GTT Probe (5′FAM/3′TAMRA) ATG TCG GCT ACA ACG TGG GCT ACC G |
| GENE bIL1beta | Applied Biosystems by life technologies | Custom made probes | Primer fw (5′–3′) TTA CTA CAG TGA CGA GAA TGA GCT GTT Primer rev (5′–3′) GGT CCA GGT GTT GGA TGC A Probe (5′FAM/3′TAMRA) CTC TTC ATC TGT TTA GGG TCA TCA GCC TCA A |
| RPLP0 | Applied Biosystems by life technologies | Bt03218086_m1 |
Riferimenti
- Vos, T., et al. Global, regional, and national incidence, prevalence, and years lived with disability for 328 diseases and injuries for 195 countries, 1990-2016: a systematic analysis for the Global Burden of Disease Study 2016. The Lancet. 390 (10100), 1211-1259 (2017).
- Hoy, D., et al. Measuring the global burden of low back pain. Best Practice & Research Clinical Rheumatology. 24 (2), 155-165 (2010).
- Thiese, M. S., et al. Prevalence of low back pain by anatomic location and intensity in an occupational population. BMC Musculoskeletal Disorders. 15 (1), 283 (2014).
- Katz, J. N. Lumbar Disc Disorders and Low-Back Pain: Socioeconomic Factors and Consequences. The Journal of Bone and Joint Surgery (American). 88, 21 (2006).
- Vlaeyen, J. W. S., et al. Low back pain. Nature Reviews Disease Primers. 4 (1), 52 (2018).
- Khan, A. N., et al. Inflammatory biomarkers of low back pain and disc degeneration: a review: Biomarkers of disc degeneration and back pain. Annals of the New York Academy of Sciences. 1410 (1), 68-84 (2017).
- Kim, H. S., Wu, P. H., Jang, I. T. Lumbar Degenerative Disease Part 1: Anatomy and Pathophysiology of Intervertebral Discogenic Pain and Radiofrequency Ablation of Basivertebral and Sinuvertebral Nerve Treatment for Chronic Discogenic Back Pain: A Prospective Case Series and Review of Literature. International Journal of Molecular Sciences. 21 (4), 1483 (2020).
- Adams, M. A., Roughley, P. J. What is Intervertebral Disc Degeneration, and What Causes It. Spine. 31 (18), 2151-2161 (2006).
- Wu, P. H., Kim, H. S., Jang, I. T. Intervertebral Disc Diseases Part 2: A Review of the Current Diagnostic and Treatment Strategies for Intervertebral Disc Disease. International Journal of Molecular Sciences. 21 (6), 2135 (2020).
- Lurie, J. D., et al. Surgical Versus Nonoperative Treatment for Lumbar Disc Herniation: Eight-Year Results for the Spine Patient Outcomes Research Trial. Spine. 39 (1), 3-16 (2014).
- Risbud, M. V., Shapiro, I. M. Role of cytokines in intervertebral disc degeneration: pain and disc content. Nature Reviews Rheumatology. 10 (1), 44-56 (2014).
- Ponnappan, R. K., et al. An organ culture system to model early degenerative changes of the intervertebral disc. Arthritis Research & Therapy. 13 (5), 171 (2011).
- O’Connell, G. D., Vresilovic, E. J., Elliott, D. M. Comparison of Animals Used in Disc Research to Human Lumbar Disc Geometry. Spine. 32 (3), 328-333 (2007).
- Stannard, J. T., et al. Development of a whole organ culture model for intervertebral disc disease. Journal of Orthopaedic Translation. 5, 1-8 (2016).
- Li, Z., et al. Preclinical ex-vivo Testing of Anti-inflammatory Drugs in a Bovine Intervertebral Degenerative Disc Model. Frontiers in Bioengineering and Biotechnology. 8, 583 (2020).
- Li, Z., et al. Development of an ex vivo cavity model to study repair strategies in loaded intervertebral discs. European Spine Journal. 25 (9), 2898-2908 (2016).
- Kazezian, Z., Li, Z., Alini, M., Grad, S., Pandit, A. Injectable hyaluronic acid down-regulates interferon signaling molecules, IGFBP3 and IFIT3 in the bovine intervertebral disc. Acta Biomaterialia. 52, 118-129 (2017).
- Caprez, S., Menzel, U., Li, Z., Grad, S., Alini, M., Peroglio, M. Isolation of high-quality RNA from intervertebral disc tissue via pronase predigestion and tissue pulverization. JOR Spine. 1 (2), 1017 (2018).
- Lopa, S., Ceriani, C., Cecchinato, R., Zagra, L., Moretti, M., Colombini, A. Stability of housekeeping genes in human intervertebral disc, endplate and articular cartilage cells in multiple conditions for reliable transcriptional analysis. European Cells & Materials. 31, 395-406 (2016).
- Lang, G., et al. An intervertebral disc whole organ culture system to investigate proinflammatory and degenerative disc disease condition. Journal of Tissue Engineering and Regenerative Medicine. 12 (4), 2051-2061 (2018).
- Du, J., et al. Proinflammatory intervertebral disc cell and organ culture models induced by tumor necrosis factor alpha. JOR Spine. 3, 1104 (2020).
- Purmessur, D., Walter, B. A., Roughley, P. J., Laudier, D. M., Hecht, A. C., Iatridis, J. A role for TNFα in intervertebral disc degeneration: A non-recoverable catabolic shift. Biochemical and Biophysical Research Communications. 433 (1), 151-156 (2013).
- Walter, B. A., Likhitpanichkul, M., Illien-Junger, S., Roughley, P. J., Hecht, A. C., Iatridis, J. C. TNFα Transport Induced by Dynamic Loading Alters Biomechanics of Intact Intervertebral Discs. PLOS One. 10 (3), 0118358 (2015).
- Gullbrand, S. E., et al. A large animal model that recapitulates the spectrum of human intervertebral disc degeneration. Osteoarthritis and Cartilage. 25 (1), 146-156 (2017).
- Willems, N., et al. Safety of intradiscal injection and biocompatibility of polyester amide microspheres in a canine model predisposed to intervertebral disc degeneration: intradiscal application of pea microspheres. Journal of Biomedical Materials Research Part B: Applied Biomaterials. 105 (4), 707-714 (2017).
- Michalek, A. J., Buckley, M. R., Bonassar, L. J., Cohen, I., Iatridis, J. C. The effects of needle puncture injury on microscale shear strain in the intervertebral disc annulus fibrosus. The Spine Journal. 10 (12), 1098-1105 (2010).
- Illien-Jünger, S., et al. The combined effects of limited nutrition and high-frequency loading on intervertebral discs with endplates. Spine. 35 (19), 1744-1752 (2010).
- Gantenbein, B., et al. Organ culture bioreactors–platforms to study human intervertebral disc degeneration and regenerative therapy. Current Stem Cell Research & Therapy. 10 (4), 339-352 (2015).
- Boubriak, O. A., Watson, N., Sivan, S. S., Stubbens, N., Urban, J. P. G. Factors regulating viable cell density in the intervertebral disc: blood supply in relation to disc height. Journal of Anatomy. 222 (3), 341-348 (2013).
- Maroudas, A., Stockwell, R. A., Nachemson, A., Urban, J. Factors involved in the nutrition of the human lumbar intervertebral disc: cellularity and diffusion of glucose in vitro. Journal of Anatomy. 120, 113-130 (1975).
- Beckstein, J. C., Sen, S., Schaer, T. P., Vresilovic, E. J., Elliott, D. M. Comparison of Animal Discs Used in Disc Research to Human Lumbar Disc: Axial Compression Mechanics and Glycosaminoglycan Content. Spine. 33 (6), 166-173 (2008).
- Walter, B. A., Illien-Jünger, S., Nasser, P. R., Hecht, A. C., Iatridis, J. C. Development and validation of a bioreactor system for dynamic loading and mechanical characterization of whole human intervertebral discs in organ culture. Journal of Biomechanics. 47 (9), 2095-2101 (2014).
- Rajan, N. E., et al. Toll-Like Receptor 4 (TLR4) Expression and Stimulation in a Model of Intervertebral Disc Inflammation and Degeneration. Spine. 38 (16), 1343-1351 (2013).
- vanden Akker, G. G., Rorije, A. J., Davidson, E. N. B., vander Kraan, P. M. Phenotypic marker genes distinguish inner and outer annulus fibrosus from nucleus pulposus tissue in the bovine intervertebral disc. Osteoarthritis and Cartilage. 25, 402 (2017).
- Du, J., et al. Functional cell phenotype induction with TGF-β1 and collagen-polyurethane scaffold for annulus fibrosus rupture repair. European Cells & Materials. 39, 1-17 (2020).
- Risbud, M. V., et al. Defining the phenotype of young healthy nucleus pulposus cells: recommendations of the Spine Research Interest Group at the 2014 annual ORS meeting. Journal of Orthopaedic Research: Official Publication of the Orthopaedic Research Society. 33 (3), 283-293 (2015).

