Gebruik van een percutaan ventriculaire hulpapparaat / linker atrium naar femorale slagader bypass-systeem voor cardiogene shock
Summary
In het volgende artikel wordt de stapsgewijze procedure beschreven voor het plaatsen van een apparaat (bijv. Tandemheart) in cardiogene shock (CS) dat een percutaan linkerventrikelhulpapparaat (pLVAD) en een linker atrium-naar-femorale slagaderbypassing (LAFAB) -systeem is dat de linker ventrikel (LV) in CS omzeilt en ondersteunt.
Abstract
Het linker atriale naar femorale arterie bypass (LAFAB) systeem is een mechanisch circulatoire ondersteuning (MCS) apparaat dat wordt gebruikt bij cardiogene shock (CS) dat de linker ventrikel omzeilt door bloed uit het linker atrium (LA) af te voeren en terug te brengen naar de systemische arteriële circulatie via de femorale slagader. Het kan stromen leveren variërend van 2,5-5 l / min, afhankelijk van de grootte van de canule. Hier bespreken we het werkingsmechanisme van LAFAB, beschikbare klinische gegevens, indicaties voor het gebruik ervan bij cardiogene shock, stappen van implantatie, post-procedurele zorg en complicaties in verband met het gebruik van dit apparaat en hun beheer.
We bieden ook een korte video van de procedurele component van apparaattherapie, inclusief de voorbereiding vóór plaatsing, percutane plaatsing van het apparaat via transseptale punctie onder echocardiografische begeleiding en het postoperatieve beheer van apparaatparameters.
Introduction
Cardiogene shock (CS) is een toestand van weefselhypoperfusie met of zonder gelijktijdige hypotensie, waarbij het hart niet in staat is om voldoende bloed en zuurstof te leveren om aan de eisen van het lichaam te voldoen, wat resulteert in orgaanfalen. Het is ingedeeld in stadia A tot E door de Society of Cardiovascular Angiography and Interventions (SCAI): stadium A – patiënten met een risico op CS; stadium B – patiënten in het beginstadium van CS met hypotensie of tachycardie zonder hypoperfusie; stadium C – klassiek CS met koud en nat fenotype dat inotropen / vasopressoren of mechanische ondersteuning vereist om de perfusie te behouden; fase D – verslechtering van de huidige medische of mechanische ondersteuning die escalatie naar meer geavanceerde apparaten vereist; en stadium E – omvat patiënten met circulatoire collaps en refractaire aritmieën die actief een hartstilstand ervaren met voortdurende cardiopulmonale reanimatie1. De meest voorkomende oorzaken van CS zijn acute MI (AMI) die 81% van de gevallen vertegenwoordigt in een recent gerapporteerde analyse2, en acuut gedecompenseerd hartfalen (ADHF). CS wordt klassiek gekenmerkt door congestie en verminderde perfusie, gemanifesteerd door verhoogde vuldrukken (pulmonale capillaire wigdruk [PCWP], linkerventrikel einddiastolische druk [LVEDP], centrale veneuze druk [CVP] en rechterventrikel einddiastolische druk [RVEDP]), verminderde cardiale output (CO), cardiale index (CI), cardiale output (CPO), cardiale output (CPO) en eindorgaanstoring3 . In het verleden waren de enige beschikbare behandelingen voor AMI gecompliceerd door CS vroege revascularisatie en medisch management met inotropen en / of vasopressoren4. Meer recent, met de komst van mechanische circulatoire ondersteuning (MCS) apparaten en de erkenning dat escalatie van vasopressoren geassocieerd is met verhoogde mortaliteit, is er een paradigmaverschuiving geweest in de behandeling van zowel AMI- als ADHF-gerelateerd CS5,6.
In het huidige tijdperk van percutane ventriculaire hulpmiddelen (pVAD) zijn er een aantal MCS-apparaatplatforms / configuraties beschikbaar, die univentriculaire of biventriculaire bloedsomloop- en ventriculaire ondersteuning bieden met en zonder oxygenatiecapaciteit7. Ondanks een gestage toename van het gebruik van pVAD’s voor de behandeling van zowel AMI als ADHF CS, zijn de sterftecijfers grotendeels onveranderd gebleven5. Met opkomend bewijs voor mogelijke klinische voordelen voor het vroegtijdig lossen van de linker ventrikel (LV) in AMI8 en vroeg gebruik van MCS in AMI CS9, blijft het gebruik van MCS toenemen.
Het MCS-apparaat Left Atrial to Femoral Artery Bypass (LAFAB) omzeilt de LV door bloed uit het linkeratrium (LA) af te voeren en via de dijbeenslagader terug te brengen naar de systemische arteriële circulatie (figuur 1). Het wordt ondersteund door een externe centrifugaalpomp die 2,5-5,0 liter per minuut (L / m) debiet biedt (nieuwe generatie pomp, aangeduid als LifeSPARC, geschikt voor maximaal 8 L / m debiet) afhankelijk van de grootte van de canules. Zodra het bloed uit de LA is geëxtraheerd via de transseptale veneuze canule, gaat het door de externe centrifugaalpomp die het bloed terugcirculeert in het lichaam van de patiënt via de arteriële canule die in de femorale slagader is geplaatst.
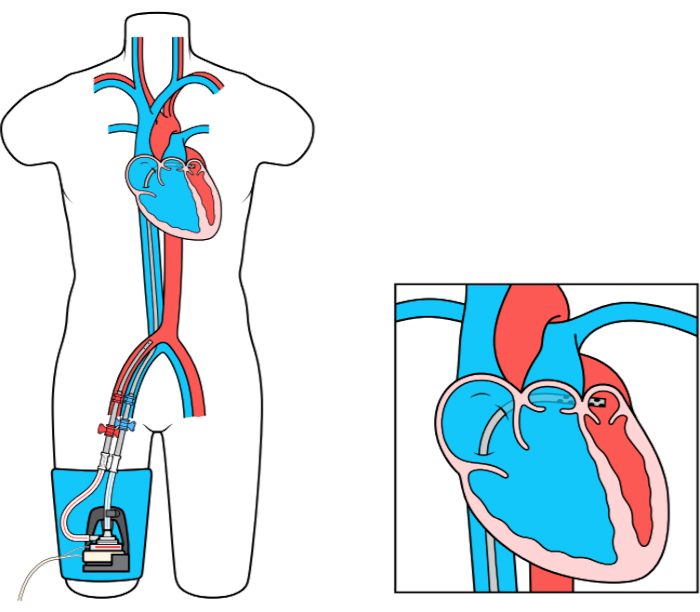
Figuur 1: LAFAB setup. Afbeelding met dank aan TandemLife, een volledige dochteronderneming van LivaNova US Inc. Klik hier om een grotere versie van dit cijfer te bekijken.
Protocol
Representative Results
Discussion
Hemodynamiek van LAFAB-apparaat:
Het hemodynamische profiel van het LAFAB-apparaat onderscheidt zich van andere pVAD’s. Door bloed rechtstreeks uit de LA af te voeren en terug te brengen naar de dijbeenslagader, omzeilt het apparaat de LV volledig. Door dit te doen, vermindert het LV-einddiastolische volume en druk, wat bijdraagt aan een verbeterde LV-geometrie en daardoor een afname van LV-slagwerk bewerkstelligt. Door het bloed echter terug te brengen naar de iliacale slagader/dalen…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
Aan het TandemHeart team van LifeSparc.
Materials
| For LAFAB (TandemHeart) | |||
| Factory Supplied Equipment for circuit connections. | TandemLife | ||
| ProtekSolo 15 Fr or 17 Fr Arterial Cannula | TandemLife | ||
| ProtekSolo 62 cm or 72 cm Transseptal Cannula | TandemLife | ||
| TandemHeart Controller | TandemLife | For adjusting flows/RPM | |
| TandemHeart Pump | LifeSPARC | Centrifugal pump | |
| For RAPAB (ProtekDuo) | |||
| Factory Supplied Equipment to complete the circuit. | TandemLife | ||
| ProtekDuo 29 Fr or 31 Fr Dual Lumen Cannula | TandemLife | ||
| TandemHeart Controller | TandemLife | For adjusting flows/RPM | |
| TandemHeart Pump | LifeSPARC | Centrifugal pump |
Riferimenti
- Baran, D. A., et al. SCAI clinical expert consensus statement on the classification of cardiogenic shock. Catheterization and Cardiovascular Interventions. 94 (1), 29-37 (2019).
- Harjola, V. -. P., et al. Clinical picture and risk prediction of short-term mortality in cardiogenic shock. European Journal of Heart Failure. 17 (5), 501-509 (2015).
- Furer, A., Wessler, J., Burkhoff, D. Hemodynamics of Cardiogenic Shock. Interventional Cardiology Clinics. 6 (3), 359-371 (2017).
- Hochman, J. S., et al. Cardiogenic shock complicating acute myocardial infarction–etiologies, management and outcome: a report from the SHOCK Trial Registry. SHould we emergently revascularize Occluded Coronaries for cardiogenic shocK. Journal of the American College of Cardiology. 36 (3), 1063-1070 (2000).
- Shah, M., et al. Trends in mechanical circulatory support use and hospital mortality among patients with acute myocardial infarction and non-infarction related cardiogenic shock in the United States. Clinical Research in Cardiology. 107 (4), 287-303 (2018).
- van Diepen, S., et al. Contemporary Management of Cardiogenic Shock: A Scientific Statement From the American Heart Association. Circulation. 136 (16), 232-268 (2017).
- Alkhouli, M., et al. Mechanical Circulatory Support in Patients with Cardiogenic Shock. Current Treatment Options in Cardiovascular Medicine. 22 (2), 4 (2020).
- Basir, M. B., et al. Feasibility of early mechanical circulatory support in acute myocardial infarction complicated by cardiogenic shock: The Detroit cardiogenic shock initiative. Catheterization and Cardiovascular Interventions. 91 (3), 454-461 (2018).
- Basir, M. B., et al. Improved Outcomes Associated with the use of Shock Protocols: Updates from the National Cardiogenic Shock Initiative. Catheterization and Cardiovascular Interventions. 93 (7), 1173-1183 (2019).
- Alkhouli, M., Rihal, C. S., Holmes, D. R. Transseptal Techniques for Emerging Structural Heart Interventions. JACC: Cardiovascular Interventions. 9 (24), 2465-2480 (2016).
- Dennis, C., et al. Clinical use of a cannula for left heart bypass without thoracotomy: experimental protection against fibrillation by left heart bypass. Annals of Surgery. 156 (4), 623-637 (1962).
- Dennis, C., et al. Left atrial cannulation without thoracotomy for total left heart bypass. Acta Chirurgica Scandinavica. 123, 267-279 (1962).
- Fonger, J. D., et al. Enhanced preservation of acutely ischemic myocardium with transseptal left ventricular assist. Annals of Thoracic Surgery. 57 (3), 570-575 (1994).
- Thiele, H., et al. Reversal of cardiogenic shock by percutaneous left atrial-to-femoral arterial bypass assistance. Circulation. 104 (24), 2917-2922 (2001).
- Burkhoff, D., et al. A randomized multicenter clinical study to evaluate the safety and efficacy of the TandemHeart percutaneous ventricular assist device versus conventional therapy with intraaortic balloon pumping for treatment of cardiogenic shock. American Heart Journal. 152 (3), 469 (2006).
- Thiele, H., et al. Randomized comparison of intra-aortic balloon support with a percutaneous left ventricular assist device in patients with revascularized acute myocardial infarction complicated by cardiogenic shock. European Heart Journal. 26 (13), 1276-1283 (2005).
- Gregoric, I. D., et al. TandemHeart as a rescue therapy for patients with critical aortic valve stenosis. Annals of Thoracic Surgery. 88 (6), 1822-1826 (2009).
- Kar, B., et al. The percutaneous ventricular assist device in severe refractory cardiogenic shock. Journal of the American College of Cardiology. 57 (6), 688-696 (2011).
- Patel, C. B., Alexander, K. M., Rogers, J. G. Mechanical Circulatory Support for Advanced Heart Failure. Current Treatment Options in Cardiovascular Medicine. 12 (6), 549-565 (2010).
- Tempelhof, M. W., et al. Clinical experience and patient outcomes associated with the TandemHeart percutaneous transseptal assist device among a heterogeneous patient population. Asaio Journal. 57 (4), 254-261 (2011).
- Gregoric, I. D., et al. The TandemHeart as a bridge to a long-term axial-flow left ventricular assist device (bridge to bridge). Texas Heart Institute Journal. 35 (2), 125-129 (2008).
- Bruckner, B. A., et al. Clinical experience with the TandemHeart percutaneous ventricular assist device as a bridge to cardiac transplantation. Texas Heart Institute Journal. 35 (4), 447-450 (2008).
- Agarwal, R., et al. Successful treatment of acute left ventricular assist device thrombosis and cardiogenic shock with intraventricular thrombolysis and a tandem heart. Asaio Journal. 61 (1), 98-101 (2015).
- Vetrovec, G. W. Hemodynamic Support Devices for Shock and High-Risk PCI: When and Which One. Current Cardiology Reports. 19 (10), 100 (2017).
- Al-Husami, W., et al. Single-center experience with the TandemHeart percutaneous ventricular assist device to support patients undergoing high-risk percutaneous coronary intervention. Journal of Invasive Cardiology. 20 (6), 319-322 (2008).
- Vranckx, P., et al. Clinical introduction of the Tandemheart, a percutaneous left ventricular assist device, for circulatory support during high-risk percutaneous coronary intervention. International Journal of Cardiovascular Interventions. 5 (1), 35-39 (2003).
- Vranckx, P., et al. The TandemHeart, percutaneous transseptal left ventricular assist device: a safeguard in high-risk percutaneous coronary interventions. The six-year Rotterdam experience. Euro Intervention. 4 (3), 331-337 (2008).
- Vranckx, P., et al. Assisted circulation using the TandemHeart during very high-risk PCI of the unprotected left main coronary artery in patients declined for CABG. Catheterization and Cardiovascular Interventions. 74 (2), 302-310 (2009).
- Thomas, J. L., et al. Use of a percutaneous left ventricular assist device for high-risk cardiac interventions and cardiogenic shock. Journal of Invasive Cardiology. 22 (8), 360 (2010).
- Vranckx, P., et al. Assisted circulation using the Tandemhear , percutaneous transseptal left ventricular assist device, during percutaneous aortic valve implantation: the Rotterdam experience. Euro Intervention. 5 (4), 465-469 (2009).
- Pitsis, A. A., et al. Temporary assist device for postcardiotomy cardiac failure. The Annals of Thoracic Surgery. 77 (4), 1431-1433 (2004).
- Singh, G. D., Smith, T. W., Rogers, J. H. Targeted Transseptal Access for MitraClip Percutaneous Mitral Valve Repair. Interventional Cardiology Clinics. 5 (1), 55-69 (2016).
- Subramaniam, A. V., et al. Complications of Temporary Percutaneous Mechanical Circulatory Support for Cardiogenic Shock: An Appraisal of Contemporary Literature. Cardiology and Therapy. 8 (2), 211-228 (2019).
- Morley, D., et al. Hemodynamic effects of partial ventricular support in chronic heart failure: Results of simulation validated with in vivo data. The Journal of Thoracic and Cardiovascular Surgery. 133 (1), 21-28 (2007).
- Naidu, S. S. Novel Percutaneous Cardiac Assist Devices. Circulation. 123 (5), 533-543 (2011).
- Kapur, N. K., et al. Hemodynamic Effects of Left Atrial or Left Ventricular Cannulation for Acute Circulatory Support in a Bovine Model of Left Heart Injury. ASAIO Journal. 61 (3), 301-306 (2015).
- Smith, L., et al. Outcomes of patients with cardiogenic shock treated with TandemHeart percutaneous ventricular assist device: Importance of support indication and definitive therapies as determinants of prognosis. Catheterization and Cardiovascular Interventions. 92 (6), 1173-1181 (2018).
- Ergle, K., Parto, P., Krim, S. R. Percutaneous Ventricular Assist Devices: A Novel Approach in the Management of Patients With Acute Cardiogenic Shock. The Ochsner Journal. 16 (3), 243-249 (2016).
- Sultan, I., Kilic, A., Kilic, A.Short-Term Circulatory and Right Ventricle Support in Cardiogenic Shock: Extracorporeal Membrane Oxygenation, Tandem Heart, CentriMag, and Impella. Heart Failure Clinics. 14 (4), 579-583 (2018).
- Bermudez, C., et al. . Percutaneous right ventricular support: Initial experience from the tandemheart experiences and methods (THEME) registry. , (2018).
- Aggarwal, V., Einhorn, B. N., Cohen, H. A. Current status of percutaneous right ventricular assist devices: First-in-man use of a novel dual lumen cannula. Catheterization and Cardiovascular Interventions. 88 (3), 390-396 (2016).
- Kapur, N. K., et al. Mechanical circulatory support devices for acute right ventricular failure. Circulation. 136 (3), 314-326 (2017).
- Kapur, N. K., et al. Mechanical Circulatory Support for Right Ventricular Failure. JACC: Heart Failure. 1 (2), 127-134 (2013).
- Geller, B. J., Morrow, D. A., Sobieszczyk, P. Percutaneous Right Ventricular Assist Device for Massive Pulmonary Embolism. Circulation: Cardiovascular Interventions. 5 (6), 74-75 (2013).
- Bhama, J., et al. Initial Experience with a Percutaneous Dual Lumen Single Cannula Strategy for Temporary Right Ventricular Assist Device Support Following Durable LVAD Therapy. The Journal of Heart and Lung Transplantation. 35 (4), 323 (2013).
- O’Neill, B., et al. Right ventricular hemodynamic support with the PROTEKDuo Cannula. Initial experience from the tandemheart experiences and methods (THEME) registry category. Miscellaneous. , (2018).
- O’Brien, B., et al. Fluoroscopy-free AF ablation using transesophageal echocardiography and electroanatomical mapping technology. Journal of Interventional Cardiac Electrophysiology. 50 (3), 235-244 (2017).
- O’Brien, B., et al. Transseptal puncture — Review of anatomy, techniques, complications and challenges. International Journal of Cardiology. 233, 12-22 (2017).

