Uso di un dispositivo di assistenza ventricolare percutanea / atrio sinistro al sistema di bypass dell'arteria femorale per lo shock cardiogeno
Summary
Il seguente articolo descrive la procedura graduale per il posizionamento di un dispositivo (ad esempio, Tandemheart) in shock cardiogeno (CS) che è un dispositivo di assistenza ventricolare sinistra percutanea (pLVAD) e un sistema di bypass dell’arteria da atriale a femorale sinistro (LAFAB) che bypassa e supporta il ventricolo sinistro (LV) in CS.
Abstract
Il sistema di bypass dell’arteria da atriale a femorale sinistro (LAFAB) è un dispositivo di supporto circolatorio meccanico (MCS) utilizzato nello shock cardiogeno (CS) che bypassa il ventricolo sinistro drenando il sangue dall’atrio sinistro (LA) e restituendolo alla circolazione arteriosa sistemica attraverso l’arteria femorale. Può fornire flussi che vanno da 2,5-5 L/min a seconda delle dimensioni della cannula. Qui, discutiamo il meccanismo d’azione di LAFAB, i dati clinici disponibili, le indicazioni per il suo uso nello shock cardiogeno, le fasi di impianto, le cure post-procedurali e le complicanze associate all’uso di questo dispositivo e alla loro gestione.
Forniamo anche un breve video della componente procedurale della terapia del dispositivo, compresa la preparazione pre-posizionamento, il posizionamento percutaneo del dispositivo tramite puntura transsettale sotto guida ecocardiografica e la gestione post-operatoria dei parametri del dispositivo.
Introduction
Lo shock cardiogeno (CS) è uno stato di ipoperfusione tissutale con o senza ipotensione concomitante, in cui il cuore non è in grado di fornire sangue e ossigeno sufficienti per soddisfare le richieste del corpo, con conseguente insufficienza d’organo. È classificato negli stadi da A a E dalla Society of Cardiovascular Angiography and Interventions (SCAI): stadio A – pazienti a rischio di CS; stadio B – pazienti allo stadio iniziale di CS con ipotensione o tachicardia senza ipoperfusione; stadio C – CS classico con fenotipo freddo e umido che richiede inotropi/vasopressori o supporto meccanico per mantenere la perfusione; stadio D – deterioramento dell’attuale supporto medico o meccanico che richiede l’escalation verso dispositivi più avanzati; e stadio E – include pazienti con collasso circolatorio e aritmie refrattarie che stanno vivendo attivamente l’arresto cardiaco con rianimazione cardiopolmonare in corso1. Le cause più comuni di CS sono l’INFARTO miocardico acuto (AMI) che rappresenta l’81% dei casi in un’analisi recentemente riportata2 e l’insufficienza cardiaca acuta scompensata (ADHF). La CS è classicamente caratterizzata da congestione e compromissione della perfusione, manifestata da elevate pressioni di riempimento (pressione del cuneo capillare polmonare [PCWP], pressione diastolica terminale ventricolare sinistra [LVEDP], pressione venosa centrale [CVP] e pressione diastolica terminale ventricolare destra [RVEDP]), diminuzione della gittata cardiaca (CO), indice cardiaco (CI), potenza cardiaca (CPO) e malfunzionamento dell’organo terminale3 . In passato, gli unici trattamenti disponibili per l’AMI complicata da CS erano la rivascolarizzazione precoce e la gestione medica con inotropi e/o vasopressori4. Più recentemente, con l’avvento dei dispositivi di supporto circolatorio meccanico (MCS) e il riconoscimento che l’escalation dei vasopressori è associata ad un aumento della mortalità, c’è stato un cambiamento di paradigma nel trattamento sia dell’AMI che dell’ADHF correlato CS5,6.
Nell’attuale era dei dispositivi di assistenza ventricolare percutanea (pVAD), sono disponibili numerose piattaforme/configurazioni di dispositivi MCS, che forniscono supporto circolatorio e ventricolare univentricolare o biventricolare con e senza capacità di ossigenazione7. Nonostante il costante aumento dell’uso di pVAD per il trattamento sia di AMI che di ADHF CS, i tassi di mortalità sono rimasti sostanzialmente invariati5. Con l’evidenza emergente di possibili benefici clinici per lo scarico precoce del ventricolo sinistro (LV) in AMI8 e l’uso precoce di MCS in AMI CS9, l’uso di MCS continua ad aumentare.
Il dispositivo MCS LEFT Atrial to Femoral Artery Bypass (LAFAB) bypassa il LV drenando il sangue dall’atrio sinistro (LA) e restituendolo alla circolazione arteriosa sistemica attraverso l’arteria femorale (Figura 1). È supportato da una pompa centrifuga esterna che offre un flusso di 2,5-5,0 litri al minuto (L/m) (pompa di nuova generazione, designata come LifeSPARC, capace di portata fino a 8 L/m) a seconda delle dimensioni delle cannule. Una volta che il sangue viene estratto dalla LA attraverso la cannula venosa transsettale, passa attraverso la pompa centrifuga esterna che ricircola il sangue nel corpo del paziente attraverso la cannula arteriosa posta nell’arteria femorale.
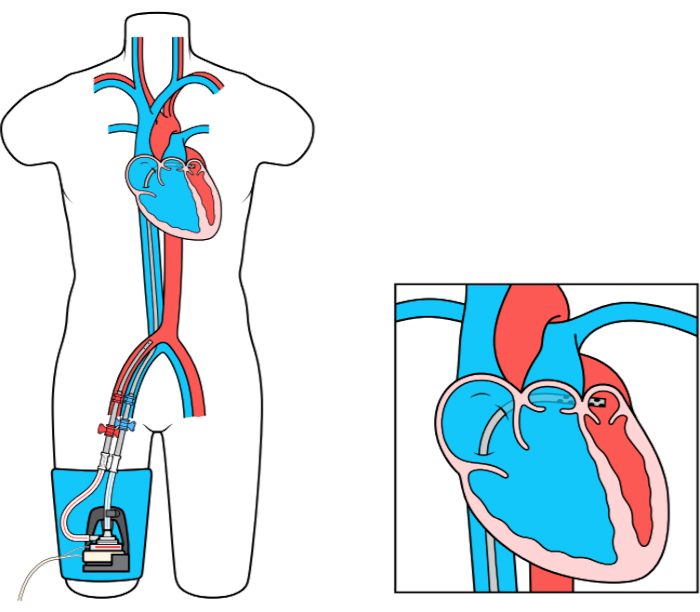
Figura 1: Configurazione LAFAB. Immagine gentilmente concessa da TandemLife, una consociata interamente controllata da LivaNova US Inc. Fare clic qui per visualizzare una versione più grande di questa figura.
Protocol
Representative Results
Discussion
Emodinamica del dispositivo LAFAB:
Il profilo emodinamico del dispositivo LAFAB è distinto dagli altri pVAD. Drenando il sangue direttamente dal LA e restituendolo all’arteria femorale, il dispositivo bypassa completamente il LV. In tal modo, riduce il volume e la pressione diastolica LV end, contribuendo a migliorare la geometria LV e quindi effettuando una diminuzione del lavoro di corsa LV. Tuttavia, restituendo il sangue nell’arteria iliaca / aorta discendente, il postcarico aume…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
Al team TandemHeart di LifeSparc.
Materials
| For LAFAB (TandemHeart) | |||
| Factory Supplied Equipment for circuit connections. | TandemLife | ||
| ProtekSolo 15 Fr or 17 Fr Arterial Cannula | TandemLife | ||
| ProtekSolo 62 cm or 72 cm Transseptal Cannula | TandemLife | ||
| TandemHeart Controller | TandemLife | For adjusting flows/RPM | |
| TandemHeart Pump | LifeSPARC | Centrifugal pump | |
| For RAPAB (ProtekDuo) | |||
| Factory Supplied Equipment to complete the circuit. | TandemLife | ||
| ProtekDuo 29 Fr or 31 Fr Dual Lumen Cannula | TandemLife | ||
| TandemHeart Controller | TandemLife | For adjusting flows/RPM | |
| TandemHeart Pump | LifeSPARC | Centrifugal pump |
Riferimenti
- Baran, D. A., et al. SCAI clinical expert consensus statement on the classification of cardiogenic shock. Catheterization and Cardiovascular Interventions. 94 (1), 29-37 (2019).
- Harjola, V. -. P., et al. Clinical picture and risk prediction of short-term mortality in cardiogenic shock. European Journal of Heart Failure. 17 (5), 501-509 (2015).
- Furer, A., Wessler, J., Burkhoff, D. Hemodynamics of Cardiogenic Shock. Interventional Cardiology Clinics. 6 (3), 359-371 (2017).
- Hochman, J. S., et al. Cardiogenic shock complicating acute myocardial infarction–etiologies, management and outcome: a report from the SHOCK Trial Registry. SHould we emergently revascularize Occluded Coronaries for cardiogenic shocK. Journal of the American College of Cardiology. 36 (3), 1063-1070 (2000).
- Shah, M., et al. Trends in mechanical circulatory support use and hospital mortality among patients with acute myocardial infarction and non-infarction related cardiogenic shock in the United States. Clinical Research in Cardiology. 107 (4), 287-303 (2018).
- van Diepen, S., et al. Contemporary Management of Cardiogenic Shock: A Scientific Statement From the American Heart Association. Circulation. 136 (16), 232-268 (2017).
- Alkhouli, M., et al. Mechanical Circulatory Support in Patients with Cardiogenic Shock. Current Treatment Options in Cardiovascular Medicine. 22 (2), 4 (2020).
- Basir, M. B., et al. Feasibility of early mechanical circulatory support in acute myocardial infarction complicated by cardiogenic shock: The Detroit cardiogenic shock initiative. Catheterization and Cardiovascular Interventions. 91 (3), 454-461 (2018).
- Basir, M. B., et al. Improved Outcomes Associated with the use of Shock Protocols: Updates from the National Cardiogenic Shock Initiative. Catheterization and Cardiovascular Interventions. 93 (7), 1173-1183 (2019).
- Alkhouli, M., Rihal, C. S., Holmes, D. R. Transseptal Techniques for Emerging Structural Heart Interventions. JACC: Cardiovascular Interventions. 9 (24), 2465-2480 (2016).
- Dennis, C., et al. Clinical use of a cannula for left heart bypass without thoracotomy: experimental protection against fibrillation by left heart bypass. Annals of Surgery. 156 (4), 623-637 (1962).
- Dennis, C., et al. Left atrial cannulation without thoracotomy for total left heart bypass. Acta Chirurgica Scandinavica. 123, 267-279 (1962).
- Fonger, J. D., et al. Enhanced preservation of acutely ischemic myocardium with transseptal left ventricular assist. Annals of Thoracic Surgery. 57 (3), 570-575 (1994).
- Thiele, H., et al. Reversal of cardiogenic shock by percutaneous left atrial-to-femoral arterial bypass assistance. Circulation. 104 (24), 2917-2922 (2001).
- Burkhoff, D., et al. A randomized multicenter clinical study to evaluate the safety and efficacy of the TandemHeart percutaneous ventricular assist device versus conventional therapy with intraaortic balloon pumping for treatment of cardiogenic shock. American Heart Journal. 152 (3), 469 (2006).
- Thiele, H., et al. Randomized comparison of intra-aortic balloon support with a percutaneous left ventricular assist device in patients with revascularized acute myocardial infarction complicated by cardiogenic shock. European Heart Journal. 26 (13), 1276-1283 (2005).
- Gregoric, I. D., et al. TandemHeart as a rescue therapy for patients with critical aortic valve stenosis. Annals of Thoracic Surgery. 88 (6), 1822-1826 (2009).
- Kar, B., et al. The percutaneous ventricular assist device in severe refractory cardiogenic shock. Journal of the American College of Cardiology. 57 (6), 688-696 (2011).
- Patel, C. B., Alexander, K. M., Rogers, J. G. Mechanical Circulatory Support for Advanced Heart Failure. Current Treatment Options in Cardiovascular Medicine. 12 (6), 549-565 (2010).
- Tempelhof, M. W., et al. Clinical experience and patient outcomes associated with the TandemHeart percutaneous transseptal assist device among a heterogeneous patient population. Asaio Journal. 57 (4), 254-261 (2011).
- Gregoric, I. D., et al. The TandemHeart as a bridge to a long-term axial-flow left ventricular assist device (bridge to bridge). Texas Heart Institute Journal. 35 (2), 125-129 (2008).
- Bruckner, B. A., et al. Clinical experience with the TandemHeart percutaneous ventricular assist device as a bridge to cardiac transplantation. Texas Heart Institute Journal. 35 (4), 447-450 (2008).
- Agarwal, R., et al. Successful treatment of acute left ventricular assist device thrombosis and cardiogenic shock with intraventricular thrombolysis and a tandem heart. Asaio Journal. 61 (1), 98-101 (2015).
- Vetrovec, G. W. Hemodynamic Support Devices for Shock and High-Risk PCI: When and Which One. Current Cardiology Reports. 19 (10), 100 (2017).
- Al-Husami, W., et al. Single-center experience with the TandemHeart percutaneous ventricular assist device to support patients undergoing high-risk percutaneous coronary intervention. Journal of Invasive Cardiology. 20 (6), 319-322 (2008).
- Vranckx, P., et al. Clinical introduction of the Tandemheart, a percutaneous left ventricular assist device, for circulatory support during high-risk percutaneous coronary intervention. International Journal of Cardiovascular Interventions. 5 (1), 35-39 (2003).
- Vranckx, P., et al. The TandemHeart, percutaneous transseptal left ventricular assist device: a safeguard in high-risk percutaneous coronary interventions. The six-year Rotterdam experience. Euro Intervention. 4 (3), 331-337 (2008).
- Vranckx, P., et al. Assisted circulation using the TandemHeart during very high-risk PCI of the unprotected left main coronary artery in patients declined for CABG. Catheterization and Cardiovascular Interventions. 74 (2), 302-310 (2009).
- Thomas, J. L., et al. Use of a percutaneous left ventricular assist device for high-risk cardiac interventions and cardiogenic shock. Journal of Invasive Cardiology. 22 (8), 360 (2010).
- Vranckx, P., et al. Assisted circulation using the Tandemhear , percutaneous transseptal left ventricular assist device, during percutaneous aortic valve implantation: the Rotterdam experience. Euro Intervention. 5 (4), 465-469 (2009).
- Pitsis, A. A., et al. Temporary assist device for postcardiotomy cardiac failure. The Annals of Thoracic Surgery. 77 (4), 1431-1433 (2004).
- Singh, G. D., Smith, T. W., Rogers, J. H. Targeted Transseptal Access for MitraClip Percutaneous Mitral Valve Repair. Interventional Cardiology Clinics. 5 (1), 55-69 (2016).
- Subramaniam, A. V., et al. Complications of Temporary Percutaneous Mechanical Circulatory Support for Cardiogenic Shock: An Appraisal of Contemporary Literature. Cardiology and Therapy. 8 (2), 211-228 (2019).
- Morley, D., et al. Hemodynamic effects of partial ventricular support in chronic heart failure: Results of simulation validated with in vivo data. The Journal of Thoracic and Cardiovascular Surgery. 133 (1), 21-28 (2007).
- Naidu, S. S. Novel Percutaneous Cardiac Assist Devices. Circulation. 123 (5), 533-543 (2011).
- Kapur, N. K., et al. Hemodynamic Effects of Left Atrial or Left Ventricular Cannulation for Acute Circulatory Support in a Bovine Model of Left Heart Injury. ASAIO Journal. 61 (3), 301-306 (2015).
- Smith, L., et al. Outcomes of patients with cardiogenic shock treated with TandemHeart percutaneous ventricular assist device: Importance of support indication and definitive therapies as determinants of prognosis. Catheterization and Cardiovascular Interventions. 92 (6), 1173-1181 (2018).
- Ergle, K., Parto, P., Krim, S. R. Percutaneous Ventricular Assist Devices: A Novel Approach in the Management of Patients With Acute Cardiogenic Shock. The Ochsner Journal. 16 (3), 243-249 (2016).
- Sultan, I., Kilic, A., Kilic, A.Short-Term Circulatory and Right Ventricle Support in Cardiogenic Shock: Extracorporeal Membrane Oxygenation, Tandem Heart, CentriMag, and Impella. Heart Failure Clinics. 14 (4), 579-583 (2018).
- Bermudez, C., et al. . Percutaneous right ventricular support: Initial experience from the tandemheart experiences and methods (THEME) registry. , (2018).
- Aggarwal, V., Einhorn, B. N., Cohen, H. A. Current status of percutaneous right ventricular assist devices: First-in-man use of a novel dual lumen cannula. Catheterization and Cardiovascular Interventions. 88 (3), 390-396 (2016).
- Kapur, N. K., et al. Mechanical circulatory support devices for acute right ventricular failure. Circulation. 136 (3), 314-326 (2017).
- Kapur, N. K., et al. Mechanical Circulatory Support for Right Ventricular Failure. JACC: Heart Failure. 1 (2), 127-134 (2013).
- Geller, B. J., Morrow, D. A., Sobieszczyk, P. Percutaneous Right Ventricular Assist Device for Massive Pulmonary Embolism. Circulation: Cardiovascular Interventions. 5 (6), 74-75 (2013).
- Bhama, J., et al. Initial Experience with a Percutaneous Dual Lumen Single Cannula Strategy for Temporary Right Ventricular Assist Device Support Following Durable LVAD Therapy. The Journal of Heart and Lung Transplantation. 35 (4), 323 (2013).
- O’Neill, B., et al. Right ventricular hemodynamic support with the PROTEKDuo Cannula. Initial experience from the tandemheart experiences and methods (THEME) registry category. Miscellaneous. , (2018).
- O’Brien, B., et al. Fluoroscopy-free AF ablation using transesophageal echocardiography and electroanatomical mapping technology. Journal of Interventional Cardiac Electrophysiology. 50 (3), 235-244 (2017).
- O’Brien, B., et al. Transseptal puncture — Review of anatomy, techniques, complications and challenges. International Journal of Cardiology. 233, 12-22 (2017).

