Bruk av en perkutan ventrikulær hjelpeenhet / venstre atrium til femoral arterie bypass-system for kardiogent sjokk
Summary
Følgende artikkel beskriver den trinnvise prosedyren for plassering av en enhet (f.eks. tandemheart) i kardiogene støt (CS) som er en perkutan venstre ventrikkelhjelpeenhet (pLVAD) og et venstre atrie til femoral arterie bypass (LAFAB) system som omgår og støtter venstre ventrikel (LV) i CS.
Abstract
Det venstre atrie-til-lårarterie bypass-systemet (LAFAB) er en mekanisk sirkulasjonsstøtteenhet (MCS) som brukes i kardiogent sjokk (CS) som omgår venstre ventrikel ved å tømme blod fra venstre atrium (LA) og returnere det til den systemiske arterielle sirkulasjonen via lårarterien. Det kan gi strømmer fra 2,5-5 l / min, avhengig av størrelsen på kanylen. Her diskuterer vi virkningsmekanismen til LAFAB, tilgjengelige kliniske data, indikasjoner for bruk i kardiogene sjokk, trinn for implantasjon, post-prosedyremessig omsorg og komplikasjoner forbundet med bruk av denne enheten og deres ledelse.
Vi gir også en kort video av prosedyrekomponenten i enhetsterapi, inkludert preplasseringsforberedelse, perkutan plassering av enheten via transseptal punktering under ekkokardiografisk veiledning og postoperativ styring av enhetsparametere.
Introduction
Kardiogent sjokk (CS) er en tilstand av vev hypoperfusjon med eller uten samtidig hypotensjon, der hjertet ikke er i stand til å levere tilstrekkelig blod og oksygen for å møte kroppens krav, noe som resulterer i organsvikt. Det er klassifisert i trinn A til E av Society of Cardiovascular Angiography and Interventions (SCAI): trinn A – pasienter i fare for CS; trinn B – pasienter i begynnelsen av CS med hypotensjon eller takykardi uten hypoperfusjon; trinn C – klassisk CS med kald og våt fenotype som krever inotroper / vasopressorer eller mekanisk støtte for å opprettholde perfusjon; trinn D – forverring på nåværende medisinsk eller mekanisk støtte som krever eskalering til mer avanserte enheter; og stadium E – inkluderer pasienter med sirkulasjonskollaps og ildfaste arytmier som aktivt opplever hjertestans med pågående hjerte- og lungeredning1. De vanligste årsakene til CS er akutt MI (AMI) som representerer 81% av tilfellene i en nylig rapportert analyse2, og akutt dekompensert hjertesvikt (ADHF). CS er klassisk preget av overbelastning og nedsatt perfusjon, manifestert av forhøyet fyllingstrykk (lungekapillær kiletrykk [PCWP], venstre ventrikulært enddiastolisk trykk [LVEDP], sentralt venøst trykk [CVP] og høyre ventrikulær endediastolisk trykk [RVEDP]), redusert hjerteutgang (CO), hjerteindeks (CI), hjerteeffekt (CPO) og end-organ-funksjonsfeil . Tidligere var de eneste tilgjengelige behandlingene for AMI komplisert av CS tidlig revaskularisering og medisinsk styring med inotroper og / eller vasopressorer4. Mer nylig, med fremkomsten av mekaniske sirkulasjonsstøtteenheter (MCS) og erkjennelsen av at eskalering av vasopressorer er forbundet med økt dødelighet, har det vært et paradigmeskifte i behandlingen av både AMI- og ADHF-relatert CS5,6.
I den nåværende epoken med perkutane ventrikulære hjelpeenheter (pVAD) er det en rekke MCS-enhetsplattformer / konfigurasjoner tilgjengelig, som gir univentrikulær eller biventrikulær sirkulasjons- og ventrikulær støtte med og uten oksygeneringsevne7. Til tross for en jevn økning i bruken av pVADer for å behandle både AMI og ADHF CS, har dødeligheten stort sett vært uendret5. Med nye bevis for mulige kliniske fordeler ved tidlig lossing av venstre ventrikel (LV) i AMI8 og tidlig bruk av MCS i AMI CS9, fortsetter bruken av MCS å øke.
Den venstre Atrial til Femoral Artery Bypass (LAFAB) MCS-enheten omgår LV ved å tømme blod fra venstre atrium (LA) og returnere den til den systemiske arterielle sirkulasjonen via lårarterien (figur 1). Den støttes av en ekstern sentrifugalpumpe som tilbyr 2,5-5,0 liter per minutt (L / m) strømning (ny generasjons pumpe, utpekt som LifeSPARC, i stand til opptil 8 l / m strømning) avhengig av størrelsen på kanylene. Når blodet er hentet fra LA via den transseptale venøse kanylen, passerer den gjennom den eksterne sentrifugalpumpen som resirkulerer blodet tilbake i pasientens kropp via arteriell kanyle plassert i lårarterien.
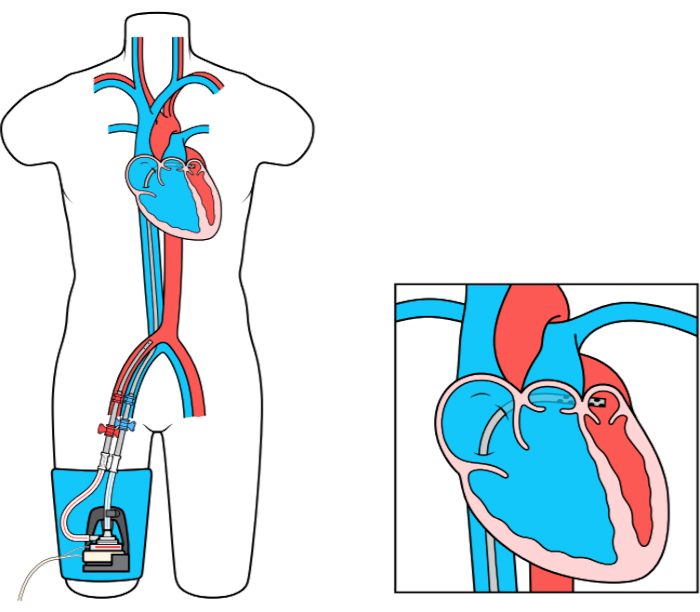
Figur 1: LAFAB-oppsett. Bilde med tillatelse fra TandemLife, et heleid datterselskap av LivaNova US Inc. Klikk her for å se en større versjon av denne figuren.
Protocol
Representative Results
Discussion
Hemodynamikk av LAFAB-enhet:
Den hemodynamiske profilen til LAFAB-enheten er forskjellig fra andre pVADer. Ved å tømme blod direkte fra LA og returnere det til lårarterien, omgår enheten LV helt. Ved å gjøre det reduserer det LV-end diastolisk volum og trykk, noe som bidrar til forbedret LV-geometri, og dermed påvirker en reduksjon i LV-slagarbeidet. Men ved å returnere blodet tilbake i iliac arterien / synkende aorta, etterbelastning øker. Dette resulterer i lasting av LV vi…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
Til TandemHeart-teamet på LifeSparc.
Materials
| For LAFAB (TandemHeart) | |||
| Factory Supplied Equipment for circuit connections. | TandemLife | ||
| ProtekSolo 15 Fr or 17 Fr Arterial Cannula | TandemLife | ||
| ProtekSolo 62 cm or 72 cm Transseptal Cannula | TandemLife | ||
| TandemHeart Controller | TandemLife | For adjusting flows/RPM | |
| TandemHeart Pump | LifeSPARC | Centrifugal pump | |
| For RAPAB (ProtekDuo) | |||
| Factory Supplied Equipment to complete the circuit. | TandemLife | ||
| ProtekDuo 29 Fr or 31 Fr Dual Lumen Cannula | TandemLife | ||
| TandemHeart Controller | TandemLife | For adjusting flows/RPM | |
| TandemHeart Pump | LifeSPARC | Centrifugal pump |
Riferimenti
- Baran, D. A., et al. SCAI clinical expert consensus statement on the classification of cardiogenic shock. Catheterization and Cardiovascular Interventions. 94 (1), 29-37 (2019).
- Harjola, V. -. P., et al. Clinical picture and risk prediction of short-term mortality in cardiogenic shock. European Journal of Heart Failure. 17 (5), 501-509 (2015).
- Furer, A., Wessler, J., Burkhoff, D. Hemodynamics of Cardiogenic Shock. Interventional Cardiology Clinics. 6 (3), 359-371 (2017).
- Hochman, J. S., et al. Cardiogenic shock complicating acute myocardial infarction–etiologies, management and outcome: a report from the SHOCK Trial Registry. SHould we emergently revascularize Occluded Coronaries for cardiogenic shocK. Journal of the American College of Cardiology. 36 (3), 1063-1070 (2000).
- Shah, M., et al. Trends in mechanical circulatory support use and hospital mortality among patients with acute myocardial infarction and non-infarction related cardiogenic shock in the United States. Clinical Research in Cardiology. 107 (4), 287-303 (2018).
- van Diepen, S., et al. Contemporary Management of Cardiogenic Shock: A Scientific Statement From the American Heart Association. Circulation. 136 (16), 232-268 (2017).
- Alkhouli, M., et al. Mechanical Circulatory Support in Patients with Cardiogenic Shock. Current Treatment Options in Cardiovascular Medicine. 22 (2), 4 (2020).
- Basir, M. B., et al. Feasibility of early mechanical circulatory support in acute myocardial infarction complicated by cardiogenic shock: The Detroit cardiogenic shock initiative. Catheterization and Cardiovascular Interventions. 91 (3), 454-461 (2018).
- Basir, M. B., et al. Improved Outcomes Associated with the use of Shock Protocols: Updates from the National Cardiogenic Shock Initiative. Catheterization and Cardiovascular Interventions. 93 (7), 1173-1183 (2019).
- Alkhouli, M., Rihal, C. S., Holmes, D. R. Transseptal Techniques for Emerging Structural Heart Interventions. JACC: Cardiovascular Interventions. 9 (24), 2465-2480 (2016).
- Dennis, C., et al. Clinical use of a cannula for left heart bypass without thoracotomy: experimental protection against fibrillation by left heart bypass. Annals of Surgery. 156 (4), 623-637 (1962).
- Dennis, C., et al. Left atrial cannulation without thoracotomy for total left heart bypass. Acta Chirurgica Scandinavica. 123, 267-279 (1962).
- Fonger, J. D., et al. Enhanced preservation of acutely ischemic myocardium with transseptal left ventricular assist. Annals of Thoracic Surgery. 57 (3), 570-575 (1994).
- Thiele, H., et al. Reversal of cardiogenic shock by percutaneous left atrial-to-femoral arterial bypass assistance. Circulation. 104 (24), 2917-2922 (2001).
- Burkhoff, D., et al. A randomized multicenter clinical study to evaluate the safety and efficacy of the TandemHeart percutaneous ventricular assist device versus conventional therapy with intraaortic balloon pumping for treatment of cardiogenic shock. American Heart Journal. 152 (3), 469 (2006).
- Thiele, H., et al. Randomized comparison of intra-aortic balloon support with a percutaneous left ventricular assist device in patients with revascularized acute myocardial infarction complicated by cardiogenic shock. European Heart Journal. 26 (13), 1276-1283 (2005).
- Gregoric, I. D., et al. TandemHeart as a rescue therapy for patients with critical aortic valve stenosis. Annals of Thoracic Surgery. 88 (6), 1822-1826 (2009).
- Kar, B., et al. The percutaneous ventricular assist device in severe refractory cardiogenic shock. Journal of the American College of Cardiology. 57 (6), 688-696 (2011).
- Patel, C. B., Alexander, K. M., Rogers, J. G. Mechanical Circulatory Support for Advanced Heart Failure. Current Treatment Options in Cardiovascular Medicine. 12 (6), 549-565 (2010).
- Tempelhof, M. W., et al. Clinical experience and patient outcomes associated with the TandemHeart percutaneous transseptal assist device among a heterogeneous patient population. Asaio Journal. 57 (4), 254-261 (2011).
- Gregoric, I. D., et al. The TandemHeart as a bridge to a long-term axial-flow left ventricular assist device (bridge to bridge). Texas Heart Institute Journal. 35 (2), 125-129 (2008).
- Bruckner, B. A., et al. Clinical experience with the TandemHeart percutaneous ventricular assist device as a bridge to cardiac transplantation. Texas Heart Institute Journal. 35 (4), 447-450 (2008).
- Agarwal, R., et al. Successful treatment of acute left ventricular assist device thrombosis and cardiogenic shock with intraventricular thrombolysis and a tandem heart. Asaio Journal. 61 (1), 98-101 (2015).
- Vetrovec, G. W. Hemodynamic Support Devices for Shock and High-Risk PCI: When and Which One. Current Cardiology Reports. 19 (10), 100 (2017).
- Al-Husami, W., et al. Single-center experience with the TandemHeart percutaneous ventricular assist device to support patients undergoing high-risk percutaneous coronary intervention. Journal of Invasive Cardiology. 20 (6), 319-322 (2008).
- Vranckx, P., et al. Clinical introduction of the Tandemheart, a percutaneous left ventricular assist device, for circulatory support during high-risk percutaneous coronary intervention. International Journal of Cardiovascular Interventions. 5 (1), 35-39 (2003).
- Vranckx, P., et al. The TandemHeart, percutaneous transseptal left ventricular assist device: a safeguard in high-risk percutaneous coronary interventions. The six-year Rotterdam experience. Euro Intervention. 4 (3), 331-337 (2008).
- Vranckx, P., et al. Assisted circulation using the TandemHeart during very high-risk PCI of the unprotected left main coronary artery in patients declined for CABG. Catheterization and Cardiovascular Interventions. 74 (2), 302-310 (2009).
- Thomas, J. L., et al. Use of a percutaneous left ventricular assist device for high-risk cardiac interventions and cardiogenic shock. Journal of Invasive Cardiology. 22 (8), 360 (2010).
- Vranckx, P., et al. Assisted circulation using the Tandemhear , percutaneous transseptal left ventricular assist device, during percutaneous aortic valve implantation: the Rotterdam experience. Euro Intervention. 5 (4), 465-469 (2009).
- Pitsis, A. A., et al. Temporary assist device for postcardiotomy cardiac failure. The Annals of Thoracic Surgery. 77 (4), 1431-1433 (2004).
- Singh, G. D., Smith, T. W., Rogers, J. H. Targeted Transseptal Access for MitraClip Percutaneous Mitral Valve Repair. Interventional Cardiology Clinics. 5 (1), 55-69 (2016).
- Subramaniam, A. V., et al. Complications of Temporary Percutaneous Mechanical Circulatory Support for Cardiogenic Shock: An Appraisal of Contemporary Literature. Cardiology and Therapy. 8 (2), 211-228 (2019).
- Morley, D., et al. Hemodynamic effects of partial ventricular support in chronic heart failure: Results of simulation validated with in vivo data. The Journal of Thoracic and Cardiovascular Surgery. 133 (1), 21-28 (2007).
- Naidu, S. S. Novel Percutaneous Cardiac Assist Devices. Circulation. 123 (5), 533-543 (2011).
- Kapur, N. K., et al. Hemodynamic Effects of Left Atrial or Left Ventricular Cannulation for Acute Circulatory Support in a Bovine Model of Left Heart Injury. ASAIO Journal. 61 (3), 301-306 (2015).
- Smith, L., et al. Outcomes of patients with cardiogenic shock treated with TandemHeart percutaneous ventricular assist device: Importance of support indication and definitive therapies as determinants of prognosis. Catheterization and Cardiovascular Interventions. 92 (6), 1173-1181 (2018).
- Ergle, K., Parto, P., Krim, S. R. Percutaneous Ventricular Assist Devices: A Novel Approach in the Management of Patients With Acute Cardiogenic Shock. The Ochsner Journal. 16 (3), 243-249 (2016).
- Sultan, I., Kilic, A., Kilic, A.Short-Term Circulatory and Right Ventricle Support in Cardiogenic Shock: Extracorporeal Membrane Oxygenation, Tandem Heart, CentriMag, and Impella. Heart Failure Clinics. 14 (4), 579-583 (2018).
- Bermudez, C., et al. . Percutaneous right ventricular support: Initial experience from the tandemheart experiences and methods (THEME) registry. , (2018).
- Aggarwal, V., Einhorn, B. N., Cohen, H. A. Current status of percutaneous right ventricular assist devices: First-in-man use of a novel dual lumen cannula. Catheterization and Cardiovascular Interventions. 88 (3), 390-396 (2016).
- Kapur, N. K., et al. Mechanical circulatory support devices for acute right ventricular failure. Circulation. 136 (3), 314-326 (2017).
- Kapur, N. K., et al. Mechanical Circulatory Support for Right Ventricular Failure. JACC: Heart Failure. 1 (2), 127-134 (2013).
- Geller, B. J., Morrow, D. A., Sobieszczyk, P. Percutaneous Right Ventricular Assist Device for Massive Pulmonary Embolism. Circulation: Cardiovascular Interventions. 5 (6), 74-75 (2013).
- Bhama, J., et al. Initial Experience with a Percutaneous Dual Lumen Single Cannula Strategy for Temporary Right Ventricular Assist Device Support Following Durable LVAD Therapy. The Journal of Heart and Lung Transplantation. 35 (4), 323 (2013).
- O’Neill, B., et al. Right ventricular hemodynamic support with the PROTEKDuo Cannula. Initial experience from the tandemheart experiences and methods (THEME) registry category. Miscellaneous. , (2018).
- O’Brien, B., et al. Fluoroscopy-free AF ablation using transesophageal echocardiography and electroanatomical mapping technology. Journal of Interventional Cardiac Electrophysiology. 50 (3), 235-244 (2017).
- O’Brien, B., et al. Transseptal puncture — Review of anatomy, techniques, complications and challenges. International Journal of Cardiology. 233, 12-22 (2017).

