Uso de um dispositivo de assistência ventricular percutâneo/átrio esquerdo para o sistema de bypass da artéria femoral para choque cardiogênico
Summary
O artigo a seguir descreve o procedimento passo a passo para a colocação de um dispositivo (por exemplo, Tandemheart) em choque cardiogênico (SC) que é um dispositivo de assistência ventricular esquerda percutâneo (pLVAD) e um sistema de bypass de artéria femoral esquerdo (LAFAB) que contorna e suporta o ventrículo esquerdo (LV) em CS.
Abstract
O sistema de bypass da artéria atrial esquerda para femoral (LAFAB) é um dispositivo de suporte circulatório mecânico (MCS) usado em choque cardiogênico (CS) que contorna o ventrículo esquerdo drenando sangue do átrio esquerdo (LA) e devolvendo-o à circulação arterial sistêmica através da artéria femoral. Ele pode fornecer fluxos que variam de 2,5-5 L/min, dependendo do tamanho da cânula. Aqui, discutimos o mecanismo de ação do LAFAB, dados clínicos disponíveis, indicações para seu uso em choque cardiogênico, etapas de implantação, cuidados pós-processuais e complicações associadas ao uso deste dispositivo e sua gestão.
Também fornecemos um breve vídeo do componente processual da terapia do dispositivo, incluindo a preparação pré-colocação, a colocação percutânea do dispositivo através de punção transseptal sob orientação ecocardiográfica e o gerenciamento pós-operatório dos parâmetros do dispositivo.
Introduction
O choque cardiogênico (SC) é um estado de hipoperfusão tecidual com ou sem hipotensão concomitante, na qual o coração é incapaz de fornecer sangue e oxigênio suficientes para atender às demandas do corpo, resultando em falência de órgãos. É classificada nos estágios A a E pela Sociedade de Angiografia Cardiovascular e Intervenções (SCAI): estágio A – pacientes em risco para CS; estágio B – pacientes em estágio inicial de CS com hipotensão ou taquicardia sem hipoperfusão; estágio C – CS clássico com fenótipo frio e úmido que requer inotropos/vasopressores ou suporte mecânico para manter a perfusão; estágio D – deterioração no suporte médico ou mecânico atual que requer escalonamento para dispositivos mais avançados; e estágio E – inclui pacientes com colapso circulatório e arritmias refratárias que estão ativamente experimentando parada cardíaca com ressuscitação cardiopulmonar em curso1. As causas mais comuns de CS são MI aguda (AMI) representando 81% dos casos em uma análise recentemente relatada2, e insuficiência cardíaca descompensada aguda (ADHF). CS é classicamente caracterizado por congestionamento e perfusão prejudicada, manifestadas por pressões elevadas de enchimento (pressão de cunha capilar pulmonar [PCWP], pressão ventricular-diatólica esquerda [LVEDP], pressão venosa central [CVP], e pressão ventricular direita de diatólica final [RVEDP]), diminuição da produção cardíaca (CO), índice cardíaco (CI), saída de energia cardíaca (CPO) e mau funcionamento do órgão final3 . No passado, os únicos tratamentos disponíveis para IAM complicados pela CS foram a revascularização precoce e o manejo médico com inotropos e/ou vasopressores4. Mais recentemente, com o advento dos dispositivos de suporte circulatório mecânico (MCS) e o reconhecimento de que a escalada de vasopressores está associada ao aumento da mortalidade, houve uma mudança de paradigma no tratamento tanto do IMI quanto do TDAH relacionado cs5,6.
Na era atual de dispositivos de assistência ventricular percutâneos (pVAD), há uma série de plataformas/configurações de dispositivos MCS disponíveis, que fornecem suporte circulatório e ventricular univentricular ou biventricular com e sem capacidade de oxigenação7. Apesar do aumento constante do uso de pVADs para tratar tanto aMI quanto a ADHF CS, as taxas de mortalidade permaneceram em grande parte inalteradas5. Com evidências emergentes de possíveis benefícios clínicos para o descarregamento precoce do ventrículo esquerdo (LV) em AMI8 e uso precoce de MCS no AMI CS9, o uso de MCS continua a aumentar.
O dispositivo MCS Left Atrial to Femoral Artery Bypass (LAFAB) contorna o LV drenando sangue do átrio esquerdo (LA) e devolvendo-o à circulação arterial sistêmica através da artéria femoral (Figura 1). É suportado por uma bomba centrífuga externa que oferece fluxo de 2,5-5,0 litros por minuto (L/m) (bomba de nova geração, designada como LifeSPARC, capaz de até 8 L/m de fluxo) dependendo do tamanho das cânulas. Uma vez extraído do sangue da LA através da cânula venosa transseptal, ele passa pela bomba centrífuga externa que recircula o sangue de volta para o corpo do paciente através da cânula arterial colocada na artéria femoral.
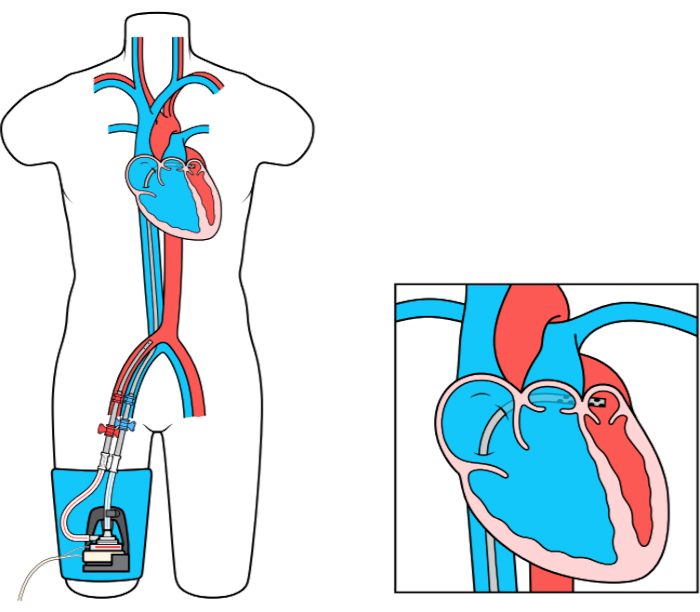
Figura 1: configuração LAFAB. Imagem cortesia da TandemLife, uma subsidiária integral da LivaNova US Inc. Por favor, clique aqui para ver uma versão maior desta figura.
Protocol
Representative Results
Discussion
Hemodinâmica do dispositivo LAFAB:
O perfil hemodinâmico do dispositivo LAFAB é distinto de outros pVADs. Drenando sangue diretamente da la e devolvendo-o à artéria femoral, o dispositivo contorna completamente a LV. Ao fazê-lo, reduz o volume e a pressão diastólicas da extremidade lv, contribuindo para a melhoria da geometria da LV e, assim, efetuando uma diminuição no trabalho de derrame de LV. No entanto, devolvendo o sangue de volta para a artéria ilíaca/aorta descende…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
Para a equipe tandemheart da LifeSparc.
Materials
| For LAFAB (TandemHeart) | |||
| Factory Supplied Equipment for circuit connections. | TandemLife | ||
| ProtekSolo 15 Fr or 17 Fr Arterial Cannula | TandemLife | ||
| ProtekSolo 62 cm or 72 cm Transseptal Cannula | TandemLife | ||
| TandemHeart Controller | TandemLife | For adjusting flows/RPM | |
| TandemHeart Pump | LifeSPARC | Centrifugal pump | |
| For RAPAB (ProtekDuo) | |||
| Factory Supplied Equipment to complete the circuit. | TandemLife | ||
| ProtekDuo 29 Fr or 31 Fr Dual Lumen Cannula | TandemLife | ||
| TandemHeart Controller | TandemLife | For adjusting flows/RPM | |
| TandemHeart Pump | LifeSPARC | Centrifugal pump |
Riferimenti
- Baran, D. A., et al. SCAI clinical expert consensus statement on the classification of cardiogenic shock. Catheterization and Cardiovascular Interventions. 94 (1), 29-37 (2019).
- Harjola, V. -. P., et al. Clinical picture and risk prediction of short-term mortality in cardiogenic shock. European Journal of Heart Failure. 17 (5), 501-509 (2015).
- Furer, A., Wessler, J., Burkhoff, D. Hemodynamics of Cardiogenic Shock. Interventional Cardiology Clinics. 6 (3), 359-371 (2017).
- Hochman, J. S., et al. Cardiogenic shock complicating acute myocardial infarction–etiologies, management and outcome: a report from the SHOCK Trial Registry. SHould we emergently revascularize Occluded Coronaries for cardiogenic shocK. Journal of the American College of Cardiology. 36 (3), 1063-1070 (2000).
- Shah, M., et al. Trends in mechanical circulatory support use and hospital mortality among patients with acute myocardial infarction and non-infarction related cardiogenic shock in the United States. Clinical Research in Cardiology. 107 (4), 287-303 (2018).
- van Diepen, S., et al. Contemporary Management of Cardiogenic Shock: A Scientific Statement From the American Heart Association. Circulation. 136 (16), 232-268 (2017).
- Alkhouli, M., et al. Mechanical Circulatory Support in Patients with Cardiogenic Shock. Current Treatment Options in Cardiovascular Medicine. 22 (2), 4 (2020).
- Basir, M. B., et al. Feasibility of early mechanical circulatory support in acute myocardial infarction complicated by cardiogenic shock: The Detroit cardiogenic shock initiative. Catheterization and Cardiovascular Interventions. 91 (3), 454-461 (2018).
- Basir, M. B., et al. Improved Outcomes Associated with the use of Shock Protocols: Updates from the National Cardiogenic Shock Initiative. Catheterization and Cardiovascular Interventions. 93 (7), 1173-1183 (2019).
- Alkhouli, M., Rihal, C. S., Holmes, D. R. Transseptal Techniques for Emerging Structural Heart Interventions. JACC: Cardiovascular Interventions. 9 (24), 2465-2480 (2016).
- Dennis, C., et al. Clinical use of a cannula for left heart bypass without thoracotomy: experimental protection against fibrillation by left heart bypass. Annals of Surgery. 156 (4), 623-637 (1962).
- Dennis, C., et al. Left atrial cannulation without thoracotomy for total left heart bypass. Acta Chirurgica Scandinavica. 123, 267-279 (1962).
- Fonger, J. D., et al. Enhanced preservation of acutely ischemic myocardium with transseptal left ventricular assist. Annals of Thoracic Surgery. 57 (3), 570-575 (1994).
- Thiele, H., et al. Reversal of cardiogenic shock by percutaneous left atrial-to-femoral arterial bypass assistance. Circulation. 104 (24), 2917-2922 (2001).
- Burkhoff, D., et al. A randomized multicenter clinical study to evaluate the safety and efficacy of the TandemHeart percutaneous ventricular assist device versus conventional therapy with intraaortic balloon pumping for treatment of cardiogenic shock. American Heart Journal. 152 (3), 469 (2006).
- Thiele, H., et al. Randomized comparison of intra-aortic balloon support with a percutaneous left ventricular assist device in patients with revascularized acute myocardial infarction complicated by cardiogenic shock. European Heart Journal. 26 (13), 1276-1283 (2005).
- Gregoric, I. D., et al. TandemHeart as a rescue therapy for patients with critical aortic valve stenosis. Annals of Thoracic Surgery. 88 (6), 1822-1826 (2009).
- Kar, B., et al. The percutaneous ventricular assist device in severe refractory cardiogenic shock. Journal of the American College of Cardiology. 57 (6), 688-696 (2011).
- Patel, C. B., Alexander, K. M., Rogers, J. G. Mechanical Circulatory Support for Advanced Heart Failure. Current Treatment Options in Cardiovascular Medicine. 12 (6), 549-565 (2010).
- Tempelhof, M. W., et al. Clinical experience and patient outcomes associated with the TandemHeart percutaneous transseptal assist device among a heterogeneous patient population. Asaio Journal. 57 (4), 254-261 (2011).
- Gregoric, I. D., et al. The TandemHeart as a bridge to a long-term axial-flow left ventricular assist device (bridge to bridge). Texas Heart Institute Journal. 35 (2), 125-129 (2008).
- Bruckner, B. A., et al. Clinical experience with the TandemHeart percutaneous ventricular assist device as a bridge to cardiac transplantation. Texas Heart Institute Journal. 35 (4), 447-450 (2008).
- Agarwal, R., et al. Successful treatment of acute left ventricular assist device thrombosis and cardiogenic shock with intraventricular thrombolysis and a tandem heart. Asaio Journal. 61 (1), 98-101 (2015).
- Vetrovec, G. W. Hemodynamic Support Devices for Shock and High-Risk PCI: When and Which One. Current Cardiology Reports. 19 (10), 100 (2017).
- Al-Husami, W., et al. Single-center experience with the TandemHeart percutaneous ventricular assist device to support patients undergoing high-risk percutaneous coronary intervention. Journal of Invasive Cardiology. 20 (6), 319-322 (2008).
- Vranckx, P., et al. Clinical introduction of the Tandemheart, a percutaneous left ventricular assist device, for circulatory support during high-risk percutaneous coronary intervention. International Journal of Cardiovascular Interventions. 5 (1), 35-39 (2003).
- Vranckx, P., et al. The TandemHeart, percutaneous transseptal left ventricular assist device: a safeguard in high-risk percutaneous coronary interventions. The six-year Rotterdam experience. Euro Intervention. 4 (3), 331-337 (2008).
- Vranckx, P., et al. Assisted circulation using the TandemHeart during very high-risk PCI of the unprotected left main coronary artery in patients declined for CABG. Catheterization and Cardiovascular Interventions. 74 (2), 302-310 (2009).
- Thomas, J. L., et al. Use of a percutaneous left ventricular assist device for high-risk cardiac interventions and cardiogenic shock. Journal of Invasive Cardiology. 22 (8), 360 (2010).
- Vranckx, P., et al. Assisted circulation using the Tandemhear , percutaneous transseptal left ventricular assist device, during percutaneous aortic valve implantation: the Rotterdam experience. Euro Intervention. 5 (4), 465-469 (2009).
- Pitsis, A. A., et al. Temporary assist device for postcardiotomy cardiac failure. The Annals of Thoracic Surgery. 77 (4), 1431-1433 (2004).
- Singh, G. D., Smith, T. W., Rogers, J. H. Targeted Transseptal Access for MitraClip Percutaneous Mitral Valve Repair. Interventional Cardiology Clinics. 5 (1), 55-69 (2016).
- Subramaniam, A. V., et al. Complications of Temporary Percutaneous Mechanical Circulatory Support for Cardiogenic Shock: An Appraisal of Contemporary Literature. Cardiology and Therapy. 8 (2), 211-228 (2019).
- Morley, D., et al. Hemodynamic effects of partial ventricular support in chronic heart failure: Results of simulation validated with in vivo data. The Journal of Thoracic and Cardiovascular Surgery. 133 (1), 21-28 (2007).
- Naidu, S. S. Novel Percutaneous Cardiac Assist Devices. Circulation. 123 (5), 533-543 (2011).
- Kapur, N. K., et al. Hemodynamic Effects of Left Atrial or Left Ventricular Cannulation for Acute Circulatory Support in a Bovine Model of Left Heart Injury. ASAIO Journal. 61 (3), 301-306 (2015).
- Smith, L., et al. Outcomes of patients with cardiogenic shock treated with TandemHeart percutaneous ventricular assist device: Importance of support indication and definitive therapies as determinants of prognosis. Catheterization and Cardiovascular Interventions. 92 (6), 1173-1181 (2018).
- Ergle, K., Parto, P., Krim, S. R. Percutaneous Ventricular Assist Devices: A Novel Approach in the Management of Patients With Acute Cardiogenic Shock. The Ochsner Journal. 16 (3), 243-249 (2016).
- Sultan, I., Kilic, A., Kilic, A.Short-Term Circulatory and Right Ventricle Support in Cardiogenic Shock: Extracorporeal Membrane Oxygenation, Tandem Heart, CentriMag, and Impella. Heart Failure Clinics. 14 (4), 579-583 (2018).
- Bermudez, C., et al. . Percutaneous right ventricular support: Initial experience from the tandemheart experiences and methods (THEME) registry. , (2018).
- Aggarwal, V., Einhorn, B. N., Cohen, H. A. Current status of percutaneous right ventricular assist devices: First-in-man use of a novel dual lumen cannula. Catheterization and Cardiovascular Interventions. 88 (3), 390-396 (2016).
- Kapur, N. K., et al. Mechanical circulatory support devices for acute right ventricular failure. Circulation. 136 (3), 314-326 (2017).
- Kapur, N. K., et al. Mechanical Circulatory Support for Right Ventricular Failure. JACC: Heart Failure. 1 (2), 127-134 (2013).
- Geller, B. J., Morrow, D. A., Sobieszczyk, P. Percutaneous Right Ventricular Assist Device for Massive Pulmonary Embolism. Circulation: Cardiovascular Interventions. 5 (6), 74-75 (2013).
- Bhama, J., et al. Initial Experience with a Percutaneous Dual Lumen Single Cannula Strategy for Temporary Right Ventricular Assist Device Support Following Durable LVAD Therapy. The Journal of Heart and Lung Transplantation. 35 (4), 323 (2013).
- O’Neill, B., et al. Right ventricular hemodynamic support with the PROTEKDuo Cannula. Initial experience from the tandemheart experiences and methods (THEME) registry category. Miscellaneous. , (2018).
- O’Brien, B., et al. Fluoroscopy-free AF ablation using transesophageal echocardiography and electroanatomical mapping technology. Journal of Interventional Cardiac Electrophysiology. 50 (3), 235-244 (2017).
- O’Brien, B., et al. Transseptal puncture — Review of anatomy, techniques, complications and challenges. International Journal of Cardiology. 233, 12-22 (2017).

