Ros imágenes de células vivas durante el desarrollo neuronal
Summary
Este protocolo describe el uso de un peróxido de hidrógeno genéticamente codificado (H2O2)-biosensoren neuronas de pez cebra cultivadas y larvas para evaluar las funciones fisiológicas de señalización de H 2 O2durante el desarrollo del sistema nervioso. Se puede aplicar a diferentes tipos de células y modificar con tratamientos experimentales para estudiar especies reactivas de oxígeno (ROS) en el desarrollo general.
Abstract
Las especies reactivas de oxígeno (ROS) son moléculas de señalización bien establecidas, que son importantes en el desarrollo normal, la homeostasis y la fisiología. Entre los diferentes ROS, el peróxido de hidrógeno(H2O2)se caracteriza mejor con respecto a los roles en la señalización celular. H2O2 se ha implicado durante el desarrollo en varias especies. Por ejemplo, se ha detectado un aumento transitorio deH2O2 en embriones de pez cebra durante los primeros días después de la fertilización. Además, el agotamiento de una importante fuente celular de H2O2, la NADPH oxidasa (NOX), deteriora el desarrollo del sistema nervioso, como la diferenciación, el crecimiento axonal y la orientación de las células ganglionares de la retina (RGCs) tanto in vivo como in vitro. Aquí, se describe un método para la obtención de imágenes intracelulares H2O2 niveles en las neuronas de pez cebra cultivadas y larvas enteras durante el desarrollo utilizando el genéticamente codificado H2O2-biosensor específico, roGFP2-Orp1. Esta sonda puede expresarse de forma transitoria o estable en larvas de pez cebra. Además, la lectura ratiométrica disminuye la probabilidad de detectar artefactos debido a la expresión génica diferencial o efectos de volumen. En primer lugar, se demuestra cómo aislar y cultivar RGCs derivados de embriones de pez cebra que expresan transitoriamente roGFP2-Orp1. Luego, utilizamos larvas enteras para monitorear los niveles deH2O2 a nivel de tejido. El sensor ha sido validado por la adición deH2O2. Además, esta metodología podría utilizarse para medir los niveles deH2O2 en tipos de células y tejidos específicos mediante la generación de animales transgénicos con expresión de biosensores específicos de tejidos. Como el pez cebra facilita las manipulaciones genéticas y de desarrollo, el enfoque demostrado aquí podría servir como una tubería para probar el papel de H2O2 durante el desarrollo embrionario neuronal y general en vertebrados.
Introduction
La señalización reactiva de especies de oxígeno (ROS) regula el desarrollo y el funcionamiento del sistema nervioso1. Una fuente celular importante de ROS son las NADPH oxidasas (NOX), que son proteínas transmembrana que generan superóxido y peróxido de hidrógeno(H2O2)2. Las enzimas NOX se encuentran en todo el sistema nervioso central (SNC), y el ROS derivado de NOX contribuye al desarrollo neuronal3,4,5,6. Se ha demostrado que el mantenimiento y la diferenciación de las células madre neurales, el establecimiento de la polaridad neuronal, la excrecencia de la neurita y la plasticidad sináptica requieren niveles adecuados de ROS7,8,9,10,11. Por otro lado, la producción incontrolada de ROS por los NOXes contribuye a trastornos neurodegenerativos como la enfermedad de Alzheimer, la esclerosis múltiple y la lesión cerebral traumática12,13,14. Por lo tanto, la producción de ROS fisiológicamente relevante es fundamental para mantener condiciones saludables.
El desarrollo de biosensores codificados genéticamente facilitó enormemente la detección de ROS celular. Una ventaja importante de los biosensores codificados genéticamente es el aumento de la resolución temporal y espacial de la señal ROS, ya que estos sensores se pueden dirigir específicamente a ubicaciones distintas. GFP sensible a redox (roGFP) es un tipo de estos biosensores ROS. La variante roGFP2-Orp1 detecta específicamenteH2O2 a través de su dominio Orp1, que es una proteína de la familia glutatión peroxiredoxina de la levadura15,16. La oxidación de la proteína Orp1 se transfiere a roGFP2 para alterar su conformación (Figura 1A). La sonda exhibe dos picos de excitación cercanos a 405 nm y 480 nm, y un solo pico de emisión a 515 nm. Tras la oxidación, la intensidad de fluorescencia alrededor de los picos de excitación cambia: mientras que la excitación de 405 nm aumenta, la excitación de 480 nm disminuye. Por lo tanto, roGFP2-Orp1 es un biosensor ratiométrico, y los niveles deH2O2se detectan por la relación de intensidades de fluorescencia excitadas en dos longitudes de onda diferentes (Figura 1B). En general, roGFP2-Orp1 es una herramienta versátil para imágenes ROS que se puede utilizar de manera eficiente in vivo.
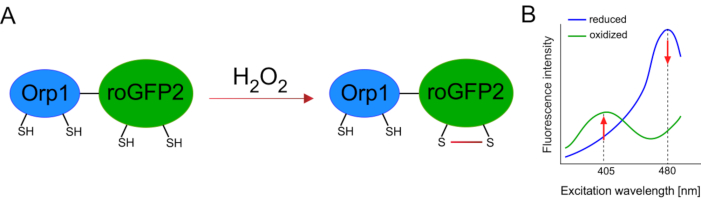
Figura 1:Representación esquemática y espectros de excitación de roGFP2-Orp1. (A)La transferencia de oxidantes se produce entre Orp1 y roGFP2 en respuesta aH2O2,dando lugar a cambios conformacionales en roGFP2. (B) Los espectros de excitación del roGFP2-Orp1 exhiben dos picos de excitación a 405 nm y 480 nm y un pico de emisión única a 515 nm. Tras la oxidación porH2O2, la excitación de 405 nm aumenta mientras que la excitación de 480 nm disminuye. Esto da lugar a una lectura ratiometric para la presencia deH2O2. La cifra ha sido modificada de Bilan y Belousov (2017)16 y Morgan et al. (2011)25. Haga clic aquí para ver una versión más amplia de esta figura.
El sistema modelo Danio rerio (pez cebra) tiene varias ventajas para aplicar biosensores codificados genéticamente. La transparencia óptica de los embriones y larvas permite la obtención de imágenes in vivo no invasivas. Se están desarrollando nuevas herramientas de imagen para lograr una mayor resolución y una penetración más profunda17. Además, existen herramientas establecidas para la manipulación genética (expresión ectópica de ARNm, transgénesis de Tol2, etc.) y la edición del genoma (TALENs, CRISPR/Cas9, etc.), que promueve la generación de animales transgénicos18. A medida que los embriones de pez cebra se desarrollan fuera de la madre, este sistema permite aún más el acceso y la manipulación de los embriones. Por ejemplo, las inyecciones en etapa unicelular y los tratamientos farmacológicos se pueden hacer fácilmente.
Aquí, utilizamos pez cebra para expresar transitoriamente el H2O2-biosensores específicos roGFP2-Orp1 mediante la inyección de ARNm transcrito in vitro. Estos embriones se pueden utilizar tanto para la obtención de imágenes in vitro de neuronas cultivadas como para la obtención de imágenes in vivo (Figura 2). Se describe un protocolo para la disección y chapado de células ganglionares de la retina (RGCs) de embriones de pez cebra seguido de la evaluación de H2O2– niveles en neuronas cultivadas. Entonces, presentamos un método para la proyección de imagen in vivo de roGFP2-Orp1-expresando embriones y larvas usando microscopia confocal. Este enfoque no sólo permite determinar los niveles fisiológicos deH2O2-sino también los cambios potenciales que ocurren en diferentes etapas o condiciones de desarrollo. En general, este sistema proporciona un método confiable para detectarH2O2 en células vivas y animales para estudiar el papel deH2O2 en el desarrollo, la salud y la enfermedad.
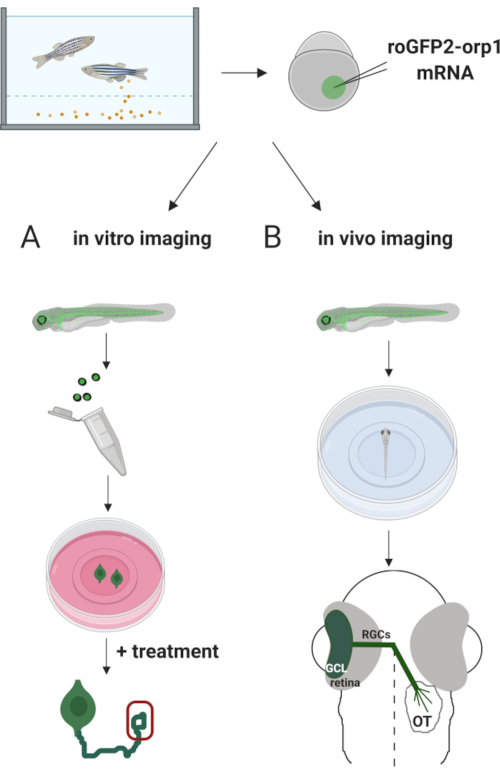
Figura 2. Esquema del enfoque experimental. Brevemente, después de la recolección de embriones, roGFP2-Orp1 ARNm se inyecta en la yema de los embriones de pez cebra en etapa unicelular. Los embriones en desarrollo se pueden utilizar tanto para(A) imágenes in vitro como(B) in vivo. (A)Los embriones GFP-positivos se utilizan para diseccionar retinas para la colección de RGC en 34 hpf. Los RGCs disociados se platean en cubrebocas recubiertas de PDL/laminina en medios ZFCM (+). La proyección de imagen del cono del crecimiento se puede conducir mientras que RGCs extiende sus axones después de 6-24 h de la galjanoplastia. Las células pueden ser sometidas a diferentes tratamientos para medir los posibles cambios en los niveles deH2O2.- Aquí, medimos H2O2-niveles en los conos de crecimiento de RGCs (rojo). (B)Los embriones positivos de GFP se utilizan para la obtención de imágenes in vivo. A la edad deseada, los embriones pueden anestesiarse y montarse en platos con fondo de vidrio de 35 mm para obtener imágenes confocales. Aquí, los embriones se montan ventralmente para la proyección de imagen retiniana. Schematic muestra el desarrollo de la retina en el pez cebra. Los RGCs forman la capa de la célula del ganglio (GCL), que es la capa más interna en retina. Los axones de RGC se convierten en nervio óptico para cruzar midline, formando quiasma óptico. Entonces, los axones de RGC crecen dorsalmente para hacer sinapsis en el tectum óptico en el mesencéfano. Haga clic aquí para ver una versión más amplia de esta figura.
Protocol
Representative Results
Discussion
Hay varios pasos críticos que necesitan atención a lo largo de este protocolo. Creemos que teniendo en cuenta estos puntos mejorará el flujo experimental. Para el cultivo primario de RGC, la esterilidad de la ZFCM (-) es muy importante, ya que este medio de cultivo no contiene antibióticos y la contaminación puede ocurrir antes o durante la toma de imágenes. Para evitarlo, aconsejamos preparar y utilizar ZFCM(-) sólo dentro de un gabinete de bioseguridad y hacer medios ZFCM(-) frescos regularmente (Paso 1.5). Adem…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
Este trabajo fue apoyado por los Institutos Nacionales de Salud (Subvención R01NS117701), la Fundación Nacional de Ciencias (Subvención 1146944-IOS), el Fondo de Investigación de la Médula Espinal Traumática y lesiones cerebrales de Indiana (Subvención 20000289), la Fundación de Investigación Purdue (Subvención 209911) y la Oficina del Vicepresidente Ejecutivo de Investigación y Asociaciones de la Universidad de Purdue (Subvención 210362). Agradecemos al Dr. Cory J. Weaver y Haley Roeder por establecer el protocolo de cultivo de RGC de pez cebra. Agradecemos a Haley Roeder, además, por proporcionar los datos de la Figura 4. Agradecemos a Leah Biasi y Kenny Nguyen por la ayuda con la cultura RGC. Agradecemos a Gentry Lee por editar el texto. Agradecemos al Dr. Tobias Dick por proporcionar roGFP2-Orp1 y al Dr. Qing Deng para el vector pCS2+ que contiene roGFP2-Orp1. La figura 2 se crea con Biorender.com.
Materials
| 35-mm culture dish | Sarstedt | 83-3900 | |
| 35-mm glass bottom dish | MatTek | P35G-1.5-10-C | |
| Agarose | Fisher Scientific | BP160-500 | |
| Borosilicate Glass Capillary Tubes | Sutter/Fisher Scientific | NC9029378 | |
| Calcium Chloride Dihydrate | Fisher Scientific | C79-500 | |
| Cover glass | Corning | 2850-22 | |
| Disposable Petri Dishes (100 x 15 mm) | VWR | 25384-094 | |
| Fetal Bovine Serum | ThermoFisher Scientific | 26140087 | |
| Glucose | Sigma Aldich | G7528 | |
| HEPES | Sigma Aldich | H4034 | |
| Injection Mold | Adaptive Science Tools | TU-1 | |
| Inverted Microscope | Nikon | TE2000 | |
| Laminin | ThermoFisher Scientific | 23017-015 | |
| Laser Scanning Confocal Microscopy | Zeiss | 710 | |
| Leibovitz's L-15 Medium with phenol red | Gibco/Fisher Scientific | 11-415-064 | |
| Leibovitz's L-15 Medium without phenol red | Gibco/Fisher Scientific | 21-083-027 | |
| Low melting agarose | Promega | V2111 | |
| mMessage mMachine SP6 Transcription Kit | Invitrogen | AM1340 | |
| NotI | New England Biolabs | R0189S | |
| PBS | Hyclone/Fisher Scientific | SH3025601 | |
| Penicillin/streptomycin | ThermoFisher Scientific | 15140122 | |
| Phenol Red | Sigma Aldich | P0290 | |
| Phenylthiourea (PTU) | Sigma Aldich | P7629 | |
| Pneumatic PicoPump | World Precision Instruments | PV820 | |
| Poly-D-Lysine (PDL) | Sigma Aldich | P7280 | |
| QiaQUICK PCR Purification Kit | QIAGEN | 28104 | |
| Recombinant mouse slit2 | R&D Systems | 5444-SL-050 | |
| Sodium Pyruvate | Sigma Aldich | P5280 | |
| Steritop 0.22 µm filter | Millipore | S2GPT05RE | |
| TE Buffer | Ambion | AM9860 | |
| Tricaine Methanesulfonate | Sigma Aldich | E10521 | |
| Vertical Pipette Puller | David Kopf Instruments | 700C |
Riferimenti
- Bórquez, D. A., et al. Dissecting the role of redox signaling in neuronal development. Journal of Neurochemistry. 137 (4), 506-517 (2016).
- Bedard, K., Krause, K. -. H. The NOX family of ROS-generating NADPH oxidases: Physiology and pathophysiology. Physiological Reviews. 87 (1), 245-313 (2007).
- Weaver, C. J., Leung, Y. F., Suter, D. M. Expression dynamics of NADPH oxidases during early zebrafish development. Journal of Comparative Neurology. 524 (10), 2130-2141 (2016).
- Terzi, A., Suter, D. M. The role of NADPH oxidases in neuronal development. Free Radical Biology and Medicine. 154, 33-47 (2020).
- Infanger, D. W., Sharma, R. V., Davisson, R. L. NADPH oxidases of the brain: Distribution, regulation, and function. Antioxidants & Redox Signaling. 8 (9-10), 1583-1596 (2006).
- Coyoy, A., Olguin-Albuerne, M., Martinez-Briseno, P., Moran, J. Role of reactive oxygen species and NADPH-oxidase in the development of rat cerebellum. Neurochemistry International. 62 (7), 998-1011 (2013).
- Le Belle, J. E., et al. Proliferative neural stem cells have high endogenous ROS levels that regulate self-renewal and neurogenesis in a PI3K/Akt-dependant manner. Cell Stem Cell. 8 (1), 59-71 (2011).
- Nayernia, Z., et al. Decreased neural precursor cell pool in NADPH oxidase 2-deficiency: from mouse brain to neural differentiation of patient derived iPSC. Redox Biology. 13, 82-93 (2017).
- Wilson, C., Nunez, M. T., González-Billault, C. Contribution of NADPH oxidase to the establishment of hippocampal neuronal polarity in culture. Journal of Cell Science. 128 (16), 2989-2995 (2015).
- Munnamalai, V., et al. Bidirectional interactions between Nox2-type NADPH oxidase and the F-actin cytoskeleton in neuronal growth cones. Journal of Neurochemistry. 130 (4), 526-540 (2014).
- Kishida, K. T., et al. Synaptic plasticity deficits and mild memory impairments in mouse models of chronic granulomatous disease. Molecular and Cellular Biology. 26 (15), 5908-5920 (2006).
- Ravelli, K. G., et al. Nox2-dependent neuroinflammation in an EAE model of multiple sclerosis. Translational Neuroscience. 10 (1), 1-9 (2019).
- Park, L., et al. Nox2-derived radicals contribute to neurovascular and behavioral dysfunction in mice overexpressing the amyloid precursor protein. Proceedings of the National Academy of Sciences. 105 (4), 1347-1352 (2008).
- Schiavone, S., Neri, M., Trabace, L., Turillazzi, E. The NADPH oxidase NOX2 mediates loss of parvalbumin interneurons in traumatic brain injury: Human autoptic immunohistochemical evidence. Scientific Reports. 7 (1), 8752 (2017).
- Gutscher, M., et al. Proximity-based protein thiol oxidation by H2O2-scavenging peroxidases. Journal of Biological Chemistry. 284 (46), 31532-31540 (2009).
- Bilan, D. S., Belousov, V. V. New tools for redox biology: from imaging to manipulation. Free Radical Biology and Medicine. 109, 167-188 (2016).
- Abu-Siniyeh, A., Al-Zyoud, W. Highlights on selected microscopy techniques to study zebrafish developmental biology. Laboratory Animal Research. 36 (1), 12 (2020).
- Sassen, W. A., Koster, R. W. A molecular toolbox for genetic manipulation of zebrafish. Advances in Genomics and Genetics. 5, 151-163 (2015).
- Rosen, J. N., Sweeney, M. F., Mably, J. D. Microinjection of zebrafish embryos to analyze gene function. Journal of Visualized Experiments. (25), e1115 (2009).
- Avdesh, A., et al. Regular care and maintenance of a Zebrafish (Danio rerio) laboratory: An introduction. Journal of Visualized Experiments. (69), e4196 (2012).
- Chen, Z., et al. Primary neuron culture for nerve growth and axon guidance studies in Zebrafish (Danio rerio). PLoS One. 8 (3), 57539 (2013).
- Zhang, L., Leung, Y. F. Microdissection of zebrafish embryonic eye tissues. Journal of Visualized Experiments. (40), e2028 (2010).
- Suter, D. M. Live cell imaging of neuronal growth cone motility and duidance in vitro. Cell Migration: Methods in Molecular Biology. , 65-86 (2011).
- Weaver, C. J., et al. nox2/cybb deficiency affects zebrafish retinotectal connectivity. Journal of Neuroscience. 38 (26), 5854-5871 (2018).
- Morgan, B., Sobotta, M. C., Dick, T. P. Measuring EGSH and H2O2 with roGFP2-based redox probes. Free Radical Biology and Medicine. 51, 1943-1951 (2011).
- Li, Z., et al. Phenylthiourea specifically reduces zebrafish eye size. PLoS One. 7 (6), 40132 (2012).
- Ermakova, Y. G., et al. Red fluorescent genetically encoded indicator for intracellular hydrogen peroxide. Nature Communications. 5, 5222 (2014).
- Oparka, M., et al. Quantifying ROS levels using CM-H2DCFDA and HyPer. Methods. 109, 3-11 (2016).
- Dickinson, B. C., Peltier, J., Stone, D., Schaffer, D. V., Chang, C. J. Nox2 redox signaling maintains essential cell populations in the brain. Nature Chemical Biology. 7 (2), 106-112 (2011).
- Cannon, M. B., Remington, S. J. Redox-sensitive green fluorescent protein: Probes for dynamic intracellular redox responses. A review. Methods in Molecular Biology. 476, 51-65 (2009).
- Meyer, A. J., Dick, T. P. Fluorescent protein-based redox probes. Antioxidants & Redox Signaling. 13 (5), 621-650 (2010).
- Panieri, E., Millia, C., Santoro, M. M. Real-time quantification of subcellular H2O2 and glutathione redox potential in living cardiovascular tissues. Free Radical Biology and Medicine. 109, 189-200 (2017).
- Breus, O., Dickmeis, T. Genetically encoded thiol redox-sensors in the zebrafish model: Lessons for embryonic development and regeneration. Biological Chemistry. , (2020).
- Morgan, B., et al. Real-time monitoring of basal H2O2 levels with peroxiredoxin-based probes. Nature Chemical Biology. 12 (6), 437-443 (2016).
- Terzi, A., Roeder, H., Weaver, C. J., Suter, D. M. Neuronal NADPH oxidase 2 regulates growth cone guidance downstream of slit2/robo2. Developmental Neurobiology. , (2020).
- Bilan, D. S., Belousov, V. V. HyPer family probes: State of the art. Antioxidants & Redox Signaling. 24 (13), 731-751 (2016).
- Ermankova, Y. G., et al. SypHer3s: a genetically encoded fluorescent ratiometric probe with enhanced brightness and an improved dynamic range. Chemistry Communications. 54 (23), 2898-2901 (2018).
- Pak, V. V., et al. Ultrasensitive genetically encoded indicator for hydrogen peroxide identifies roles for the oxidant in cell migration and mitochondrial function. Cell Metabolism. 31 (3), 642-653 (2020).
- Kwan, K. M., et al. The Tol2kit: A multisite gateway-based construction Kit for Tol2 transposon transgenesis constructs. Developmental Dynamics. 236 (11), 3088-3099 (2007).

