Hurtig gitterforberedelse til tidstilslutt kryo-elektronmikroskopi
Summary
Her leverer vi en detaljeret protokol til brug af en hurtig gitterfremstillingsenhed til både hurtig netfremstilling og til hurtig blanding og frysning for at udføre tidsfor løste eksperimenter.
Abstract
Feltet kryo-elektronmikroskopi (cryo-EM) er i rivende udvikling med nye hardware- og behandlingsalgoritmer, der producerer strukturer med højere opløsning og information om mere udfordrende systemer. Prøveforberedelse til cryo-EM gennemgår en lignende revolution med nye tilgange, der udvikles for at erstatte de traditionelle blotting-systemer. Disse omfatter brug af piezo-elektriske dispensere, pin udskrivning og direkte sprøjtning. Som følge af denne udvikling går hastigheden af netforberedelse fra sekunder til millisekunder, hvilket giver nye muligheder, især inden for tidsforberedt kryo-EM, hvor proteiner og substrater hurtigt kan blandes før dykfrysning, fældefangst kortvarige mellemtilstande. Her beskriver vi i detaljer en standardprotokol til fremstilling af gitre på vores interne tidsforberedte EM-enhed både til standard hurtig gitterforberedelse og også til tidsforberedte eksperimenter. Protokollen kræver mindst ca. 50 μL-prøver i koncentrationer på ≥ 2 mg/mL til fremstilling af 4 gitre. Forsinkelsen mellem prøveudbringning og frysning kan være helt ned til 10 ms. En begrænsning er øget istykkelse ved hurtigere hastigheder og sammenlignet med blotting-metoden. Vi håber, at denne protokol vil hjælpe andre med at designe deres egne net gør enheder og dem interesseret i at designe tid-løst eksperimenter.
Introduction
Baggrund
Den seneste udvikling inden for kryo-elektronmikroskopi (cryo-EM) har muliggjort strukturelle undersøgelser af stadig mere komplekse systemer med høj opløsning. Med få undtagelser har sådanne undersøgelser været begrænset til biologiske makromolekyler ved ligevægt1 eller relativt langsomme reaktioner2. Mange processer in vivo forekommer på en hurtigere tidshorisont (millisekunder), og der er stigende interesse for tid løst cryo-EM (TrEM) på disse tidshorisonter3. Det konventionelle kryo-EM-prøvepræparat ved blottingmetoden er imidlertid for langsomt til millisekunder TrEM.
Den blotting metode har andre begrænsninger end dårlig tid opløsning. Proteiner og proteinkomplekser kan lide af denaturering eller foretrukken orientering på gitre4. Det har vist sig at nedsætte eksponeringstiden for luft-vand-grænsefladen under prøveforberedelsen for at afbøde foretrukken orientering og proteindenaturering5,6. Således muliggør hurtig netforberedelse ikke kun millisekunder TrEM, men kan også forbedre gitterkvaliteten.
I øjeblikket er der tre forskellige tilgange til automatiseret gitterforberedelse. Den første tilgang bruger en pin eller kapillær, der holder en lille mængde prøve. Efter at have etableret kontakt mellem væsken og gitteroverfladen ‘skrives’ på gitteret7,8. Prøveansøgningsprocessen er relativt langsom og tager et par sekunder. En alternativ tilgang bruger kontrolleret dråbe generation af en piezo dispenser og selvtransporterende gitre9. Dette gør det muligt hurtigere dispensere at fryse gange, men er stadig begrænset af dråbe og wicking hastighed (i øjeblikket nå 54 ms). Den hidtil hurtigste tilgang er den direkte spraytilgang, hvor prøven forstøves i en sprøjtedyse og de små (~ 10 – 20 μm) og hurtige (> 5 m/s) dråber spredt ved kontakt med kryo-EM-gitteret. Prøvesprayen kan genereres på forskellige måder, såsom airblastforstøvere, overfladeakustiske bølger eller ultralydsfugtere10,11,12,13. Det er vores erfaring, at istykkelsen med den direkte sprøjtemetode er større, men direkte sprøjtning gør det muligt for dispenseren at fryse gange < 10 ms.
I denne protokol beskrives trin for trin, hvordan en tidstilsluttet EM-enhed (TED), der er udstyret med en mikrofluidisk sprøjtedyse, kan bruges til at forberede gitre på en hurtig tidsskala14,15. Enheden er blevet brugt til at forberede gitre med en forsinkelsestid på mindst 6 ms mellem prøveudbringning og frysning og til hurtigt at blande og fryse to prøver. Designet af TED er baseret på en tidligere version16 og ligner andre spraybaserede tidsfor løste cryo-EM-enheder17.
For det første beskrives de fire hoveddele i TED-opsætningen. Kernen i TED er den flydende håndteringsenhed, som er ansvarlig for prøve aspiration og dispensering. Et pneumatisk stempel flytter gitteret gennem sprayen ind i den flydende ethan. Generering af sprayen opnås med mikrofluidiske sprøjtedyser, og frysning sker i en flydende ethanbeholder, som beskrives kort. Endelig fremhæves de ekstra funktioner til styring af gittermiljøet, især fugtighed. Dette efterfølges af detaljerede protokoller for enhedens drift og for udførelse af TrEM-eksperimenter. Repræsentative resultater gives til hurtig netforberedelse og et simpelt TrEM-eksperiment.
Eksperimentel opsætning
Væskehåndteringsenheden
TED’s væskehåndteringssystem er dannet af tre sprøjtedrevpumper (‘pumper 1 – 3’), der hver er udstyret med en roterende ventil (figur 1). En strømforsyning giver pumper 1 – 3 med 24 V DC. Kommunikation med kontrolsoftwaren (skrevet i Visual Basic og C++) sker via en RS232-grænseflade til pumpning 1. Kommandoer distribueres via de serielle I/O-udvidelsesporte fra pumpe 1 til pumper 2-3. Pumper 1-3 er udstyret med glassprøjter (‘sprøjter 1-3’, vi bruger 250 μL/zero dead volume sprøjter her). Hver ventil har to positioner, ‘belastning’ og ‘dispensere’. Lastpositionen anvendes til at aspirere prøven i sprøjten. Et kort stykke (~ 3 – 4 cm) af 1/16 “OK, 0,01′′ ID FEP slanger er forbundet via ETFE / ETFE flangeløse fittings til ‘belastning’ position ventiler 1-3. Dette korte slangestykke når ind i prøvebeholderen (typisk et 1,5 mL eller 0,5 mL plastrør). Dispenseringspositionen fører til sprøjtedysen. Tilslutning mellem dispenserudtaget og sprøjtedysen er lavet af PE slange (~ 20-30 cm længde, 0,043″ O.D., 0,015” ID), med et kort stykke ærmeslange (~ 0,5 cm) og ETFE/ETFE flangeløse fittings.
Det pneumatiske stempel
TED bruger et pneumatisk stempel til at accelerere gitteret og flytte det gennem prøvesprayen ind i væskedehanbeholderen. Tryk pincet holde nettet, skruet ind i en hjemmebygget holder, som er monteret på en dobbelt stang pneumatiske cylinder (Figur 2A).
Trykket leveres fra en stor nitrogengasflaske (størrelse W), der er udstyret med en multistage regulator (0 – 10 bar, ‘hovedtryk’). Fleksibel forstærket PVC-slange (12 mm O.D.) forbinder regulatoren med en 12-port manifold, hvor tryk nitrogen leveres til dysen og det pneumatiske stempel. Gasstrømmen gennem dysen er konstant, reguleret direkte ved nitrogencylinderen (hovedtryk). Forbindelsen til dysen er lavet med PU slanger (4 mm O.D., 2,5 mm I.D.), et kort stykke PE slanger (~ 8 cm længde, 0,043″ O.D., 0,015 “ID) og passende stik. Trykket på det pneumatiske stempel styres gennem en magnetventil. PU slange (4 mm O.D., 2,5 mm ID) forbinder magnetventilen med en regulator og det pneumatiske stempel for at muliggøre et reduceret dyktryk (≤ hovedtryk). Magnetventilen er computerstyret. Der gives en skematisk oversigt over opsætningen i figur 2B.
Bemærk, at med denne opsætning er dyktrykket altid lige eller mindre end sprøjtegastrykket (hovedtryk). Opsætningen kan dog nemt ændres ved at indarbejde en anden regulator opstrøms sprøjtedysen for at tillade højere dykhastigheder ved lavt sprøjtegastryk. Højt tryk (>> 2 bar) kan beskadige PDMS-sprøjtedysen.
FORSIGTIG: Dette er et tryksystem, og ‘hovedtrykket’ skal altid være < 7 bar.
Tryk mellem 0,5 og 2 bar bruges typisk til det pneumatiske stempel og viser en omtrent lineær sammenhæng mellem tryk og hastighed (ved sprayens lodrette position). Dykhastigheder måles med et oscilloskop, der er forbundet i overensstemmelse med et slide potentiometer (10 kΩ) og parallelt med en 2 kΩ modstand (Figur 2C). En strømforsyning giver potentiometeret med 9 V DC. Mens den omtrentlige dykhastighed indstilles før eksperimentet ved at indstille dyktrykket, giver potentiometeret en præcis udlæsning af hastigheden efter eksperimentet.
Sprøjtedyser og flydende ethanbeholder
Fremstilling og drift af gasdynamiske virtuelle dyser til spraybaseret prøvelevering er beskrevet andetsteds i detaljer15. Som beskrevet ovenfor er dispenserudtag af ventiler 1-3 forbundet med dysens flydende indløb (figur 3A). Den tryksatte sprøjtegas er forbundet med dysens gasindtag. Indløbene i PDMS sprøjtedyserne er således, at 0,043″ O.D. PE slanger kan bruges direkte uden behov for fittings. Vores dyse design indeholder en ‘jet-in-jet’ geometri til blanding af to prøver, svarende til den i ref.18beskrevne anordning. Et skema over designet er vist i figur 3B, vises et mikroskopisk billede af en dyse i figur 3C. Layoutet af den mikrofluidiske enhed kræver brug af tre sprøjter til at blande to prøver. Sprøjtedysen er typisk placeret i 1-1,5 cm afstand fra gitteret (under prøveudbringning).
Vi bruger flydende ethan som en cryogen, i en flydende ethan / nitrogenbeholder som anvendes til standard blotting metode. Lodret positionering af den flydende ethanbæger opnås med en laboratorieløftplatform.
Kontrol af sprøjte- og gittermiljøet
Stemplet og spraydysen er indeholdt i en specialbygget PMMA -boks (akrylglas) med en dobbeltdør (Figur 4A). Høj relativ luftfugtighed inde i kassen opnås ved hjælp af et luftbefugtningssystem bag på TED (Figur 4B). Luft leveres af en pumpe og føres ind i en første 10″ beholder (typisk anvendes til under vask vandrensning). Beholderen er fyldt med et lavt (~ 5-10 cm) vandniveau og huser også en luftfugterenhed. Lysnettet til luftfugteren styres af en digital fugtigheds-/temperaturregulator og en fugtigheds-/temperatursensor placeret inde i akrylglaskassen. Controlleren er indstillet til at slukke for pumpen, når den relative luftfugtighed når ≥ 90 %. Luftet luft fra den første beholder pumpes gennem en diffusor, nedsænket i vand i en anden 10 “beholder og derefter kommer ind i akryl glas boks.
FORSIGTIG: Da prøven er aerosoliseret i sprøjtedysen, er farlig biologisk eller kemisk prøve ikke egnet som prøver.
Kørselssekvensen
Knappen Kør script i kontrolsoftwaren starter kørselssekvensen. Denne sekvens af kommandoer kan foruddefineres i en scriptfil og ændres via softwaren. De vigtigste variabler er forklaret her:
Sprøjtehastighed: Sprøjtehastigheden bestemmer den væskestrøm, der bruges af sprøjtepumpen. Flowraten kan beregnes på følgende måde: Sprøjtepumpemotorerne, der anvendes her, har en fast trinstørrelse. Hele spektret af pumpen er opdelt i 48.000 trin. Den anden vigtige faktor er sprøjtevolumen. Vi bruger typisk 250 μL sprøjter. Sprøjtehastigheden i kontrolsoftwaren er indstillet som antal trin/sekund. En sprøjtehastighed på 1000 trin/sekund svarer til:
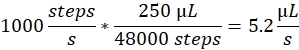
Sprayvolumen: Sprøjtevolumen bestemmer det samlede volumen, der skal sprøjtes. Således bestemmer det også varigheden af sprayen. Sprøjtevolumen i kontrolsoftwaren er indstillet som en række trin. Et sprøjtevolumen på 2000 trin med en sprøjtehastighed på 1000 trin/sekund fører til en sprayvarighed på 2 s og et samlet volumen på 10,4 μL.
Pre-spray tid: Denne variabel definerer tiden mellem indledningen af spray og springet. Det er vigtigt at vælge forsinkelsestiden, så sprayen har tilstrækkelig tid til at stabilisere sig, før du kaster gitteret. Normalt gives sprayen 1,5 – 4 s for at stabilisere, før gitteret kastes. Sprayen opretholdes, indtil gitteret er flyttet igennem. Normalt stoppes væskestrømmen (og dermed sprayen) 0,5 til 1 s efter gitteret er blevet kastet. Ved hjælp af en sprøjtehastighed på 1000 trin /s og en sprayvolumen på 2000 trin er en typisk pre-spray tid 1,5 s, for eksempel.
En eksemplarisk sekvens af kommandoer vises i figur 5A, gitterpositionen over tid er illustreret i figur 5B.
Protocol
Representative Results
Discussion
Protokollerne i dette arbejde kan bruges til hurtig gitterforberedelse ved direkte sprøjtning og TrEM-eksperimenter. Hurtig gitterforberedelse kan bruges til at reducere partikelinteraktioner med luftvandsgrænsefladen5. De vigtigste begrænsninger er den tilgængelige prøvekoncentration og istykkelse på nettet. Inden for disse grænser og forudsat at prøvekvaliteten er god, producerer protokollen gitre, der er egnede til høj opløsning kryo-EM.
Fejlfinding…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
Vi vil gerne takke Molly S.C. Gravett for nyttige diskussioner og ABSL facilitet personale for hjælp med cryo-EM dataindsamling. David P. Klebl er ph.d.-studerende på Wellcome Trust 4-årig ph.d.-program i Astbury Center finansieret af The University of Leeds. FEI Titan Krios mikroskoper blev finansieret af University of Leeds (UoL ABSL award) og Wellcome Trust (108466 / Z / 15 / Z). Dette arbejde blev finansieret af en BBSRC tilskud til Stephen P. Muench (BB / P026397/1) og støttet af forskningsbevillinger til Howard D. White fra American Heart Association (AMR21-236078) og Howard D. White og Vitold Galkin fra US National Institutes of Health (171261).
Materials
| Time resolved device | |||
| acrylic glass box | USA scientific | ||
| digital humidity/temperature controller | THE20 digital humidity/temperature controller | ||
| dual rod pneumatic cylinder | dual rod pneumatic cylinder TN 10×70 | ||
| FEP tubing | Upchurch Scientific 1/16” O.D., 0.01'' I.D. FEP tubing | ||
| flangeless fittings | Upchurch Scientific ETFE/ETFE flangeless fittings | ||
| flexible reinforced PVC tubing | 12 mm OD. flexible reinforced PVC tubing | ||
| glass syringes | Kloehn 250 µL zero-dead volume | ||
| humidifier pump | Interpret Aqua Air AP3 | ||
| liquid ethane container | from Thermo/FEI VitrobotTM Mark IV | ||
| multistage regulator | GASARC class 3 multistage regulator | ||
| negative pressure tweezers | Dumont N5 Inox B negative pressure tweezers | ||
| oscilloscope | Hantek 6022BE oscilloscope | ||
| PE tubing | Scientific Commodities Inc. 0.043” O.D., 0.015” I.D. PE tubing | ||
| power supply | Mean Well GSM160A24-R7B | ||
| power supply | Wanptek KPS305D power supply | ||
| PU tubing | SMC TU0425 4 mm O.D., 2.5 mm I.D. PU tubing | ||
| regulator | Norgren R72G-2GK-RMN | ||
| slide potentiometer | PS100 slide potentiometer | ||
| solenoid valve | SMC NVJ314M solenoid valve | ||
| syringe drive pumps | Kloehn V6 48K model | ||
| Reagents & Materials | |||
| apoferritin from equine spleen | Sigma-Aldrich, A3660 | ||
| ATP | Sigma-Aldrich, A2383 | ||
| cryo-EM grids | Quantifoil 300 mesh Cu, R 1.2/1.3 | ||
| EGTA | Sigma Aldrich E3889 | ||
| F-actin | Provided by H.D. White (for preparation procedure, see ref. 1) | ||
| glow-discharger | Cressington 208 carbon coater with a glow-discharge unit | ||
| HEPES | Sigma-Aldrich, H7006 | ||
| KAc | Sigma-Aldrich, P1190 | ||
| MgCl2 | Sigma-Aldrich, M8266 | ||
| MOPS | Sigma-Aldrich, M1254 | ||
| NaCl | Sigma-Aldrich, S9888 | ||
| Skeletal muscle myosin S1 | Provided by H.D. White (for preparation procedure, see ref. 2) | ||
| Ref 1 | Spudich, J. A. & Watt, S. The regulation of rabbit skeletal muscle contraction I. Biochemical studies of the interaction of the tropomyosin-troponin complex with actin and the proteolytic fragments of myosin. Journal of biological chemistry 246, 4866-4871 (1971). | ||
| Ref 2 | White, H. & Taylor, E. Energetics and mechanism of actomyosin adenosine triphosphatase. Biochimica 15, 5818-5826 (1976). |
Riferimenti
- Murphy, B. J., et al. Rotary substates of mitochondrial ATP synthase reveal the basis of flexible F1-Fo coupling. Science. 364, (2019).
- Benton, D. J., Gamblin, S. J., Rosenthal, P. B., Skehel, J. J. Structural transitions in influenza haemagglutinin at membrane fusion pH. Nature. , 1-4 (2020).
- Dance, A. Molecular motion on ice. Nature Methods. , 1-5 (2020).
- D’Imprima, E., et al. Protein denaturation at the air-water interface and how to prevent it. Elife. 8, 42747 (2019).
- Noble, A. J., et al. Reducing effects of particle adsorption to the air-water interface in cryo-EM. Nature Methods. 15, 793-795 (2018).
- Klebl, D. P., et al. Need for speed: Examining protein behaviour during cryoEM grid preparation at different timescales. BioRxiv. , (2020).
- Ravelli, R. B., et al. Cryo-EM structures from sub-nl volumes using pin-printing and jet vitrification. Nature Communications. 11, 1-9 (2020).
- Arnold, S. A., et al. Blotting-free and lossless cryo-electron microscopy grid preparation from nanoliter-sized protein samples and single-cell extracts. Journal of Structural Biology. 197, 220-226 (2017).
- Razinkov, I., et al. A new method for vitrifying samples for cryoEM. Journal of Structural Biology. 195, 190-198 (2016).
- Feng, X., et al. A fast and effective microfluidic spraying-plunging method for high-resolution single-particle cryo-EM. Structure. 25, 663-670 (2017).
- Ashtiani, D., et al. Delivery of femtolitre droplets using surface acoustic wave based atomisation for cryo-EM grid preparation. Journal of Structural Biology. 203, 94-101 (2018).
- Rubinstein, J. L., et al. Shake-it-off: a simple ultrasonic cryo-EM specimen-preparation device. Acta Crystallographica Section D: Structural Biology. 75, (2019).
- Mäeots, M. -. E., et al. Modular microfluidics enables kinetic insight from time-resolved cryo-EM. Nature Communications. 11, 1-14 (2020).
- Kontziampasis, D., et al. A cryo-EM grid preparation device for time-resolved structural studies. IUCrJ. 6, (2019).
- Klebl, D. P., et al. Sample deposition onto cryo-EM grids: from sprays to jets and back. Acta Crystallographica Section D: Structural Biology. 76, (2020).
- White, H., Thirumurugan, K., Walker, M., Trinick, J. A second generation apparatus for time-resolved electron cryo-microscopy using stepper motors and electrospray. Journal of Structural Biology. 144, 246-252 (2003).
- Kaledhonkar, S., Fu, Z., White, H., Frank, J. . Protein Complex Assembly. , 59-71 (2018).
- Trebbin, M., et al. Microfluidic liquid jet system with compatibility for atmospheric and high-vacuum conditions. Lab on a Chip. 14, 1733-1745 (2014).
- Klebl, D. P., Sobott, F., White, H. D., Muench, S. P. On-grid and in-flow mixing for time-resolved Cryo-EM. Acta Crystallographica Section D: Structural Biology. , (2021).
- He, S., Scheres, S. H. Helical reconstruction in RELION. Journal of Structural Biology. 198, 163-176 (2017).
- Millar, N. C., Geeves, M. A. The limiting rate of the ATP-mediated dissociation of actin from rabbit skeletal muscle myosin subfragment 1. FEBS Letters. 160, 141-148 (1983).
- Kasas, S., Dumas, G., Dietler, G., Catsicas, S., Adrian, M. Vitrification of cryoelectron microscopy specimens revealed by high-speed photographic imaging. Journal of Microscopy. 211, 48-53 (2003).
- Glaeser, R. M., et al. Defocus-dependent Thon-ring fading. bioRxiv. , (2020).
- Bagshaw, C. A beginner’s guide to flow kinetics. The Biochemist. 42, (2020).

