Rask nettforberedelse for tidsavklart kryo-elektronmikroskopi
Summary
Her gir vi en detaljert protokoll for bruk av en rask grid-lage enhet for både rask grid-making og for rask blanding og frysing for å gjennomføre tidsavklarte eksperimenter.
Abstract
Feltet kryo-elektronmikroskopi (cryo-EM) utvikler seg raskt med nye maskinvare- og prosesseringsalgoritmer, og produserer strukturer og informasjon med høyere oppløsning på mer utfordrende systemer. Prøvepreparering for cryo-EM gjennomgår en lignende revolusjon med nye tilnærminger som utvikles for å erstatte de tradisjonelle blottingssystemene. Disse inkluderer bruk av piezo-elektriske dispensere, pintrykk og direkte sprøyting. Som et resultat av denne utviklingen går hastigheten på nettforberedelsene fra sekunder til millisekunder, noe som gir nye muligheter, spesielt innen tidsavsluttet kryo-EM der proteiner og substrater raskt kan blandes før dykkfrysing, fanger kortvarige mellomliggende tilstander. Her beskriver vi i detalj en standardprotokoll for å lage rutenett på vår interne tidsavklarte EM-enhet både for standard rask nettforberedelse og også for tids løste eksperimenter. Protokollen krever minimum ca. 50 μL prøve ved konsentrasjoner på ≥ 2 mg/ml for fremstilling av 4 gitter. Forsinkelsen mellom prøveprogram og frysing kan være så lav som 10 ms. En begrensning er økt istykkelse ved raskere hastigheter og sammenlignet med blottingsmetoden. Vi håper denne protokollen vil hjelpe andre med å designe sine egne grid making enheter og de som er interessert i å designe tidsavklarte eksperimenter.
Introduction
Bakgrunn
Den siste tidens utvikling innen kryo-elektronmikroskopi (cryo-EM) har gjort det mulig å studere stadig mer komplekse systemer med høy oppløsning. Med få unntak har slike studier vært begrenset til biologiske makromolekyler ved likevekt1 eller relativt langsomme reaksjoner2. Mange prosesser in vivo forekommer på en raskere tidsskala (millisekunder), og det er økende interesse for tidsløst kryo-EM (TrEM) på disse tidsskalaene3. Imidlertid er konvensjonell kryo-EM prøvepreparering ved blottingsmetoden for treg for millisekunder TrEM.
Blotting-metoden har andre begrensninger i tillegg til dårlig tidsoppløsning. Proteiner og proteinkomplekser kan lide av denaturering eller foretrukket orientering på rutenett4. Reduksjon av eksponeringstiden for luftvannsgrensesnittet under prøvepreparering har vist seg å redusere foretrukket orientering og protein denaturering5,6. Dermed muliggjør rask nettforberedelse ikke bare millisekunder TrEM, men kan også forbedre rutenettkvaliteten.
For tiden er det tre forskjellige tilnærminger til automatisert nettforberedelse. Den første tilnærmingen bruker en pinne eller kapillær som inneholder en liten mengde prøve. Etter å ha etablert kontakt mellom væsken og rutenettoverflaten, blir prøven “skrevet” på rutenettet7,8. Prøvesøknadsprosessen er relativt langsom og tar noen sekunder. En alternativ tilnærming bruker kontrollert dråpegenerering av en piezo dispenser og selvtransporterende rutenett9. Dette gjør det mulig å fryse raskere til frysetider, men er fortsatt begrenset av dråpe- og fukttransporterende hastighet (når for øyeblikket 54 ms). Den raskeste tilnærmingen så langt er den direkte spraytilnærmingen, der prøven forstøvnes i en sprøytedyse og de små (~ 10 – 20 μm) og raske (> 5 m / s) dråper spredt ved kontakt med kryo-EM-rutenettet. Prøvesprayen kan genereres på forskjellige måter som airblast forstøvere, overflate akustiske bølger eller ultralyd luftfuktere10,11,12,13. Etter vår erfaring er istykkelsen med direkte sprøytingstilnærming større, men direkte sprøyting gjør det mulig å dispensere til frysetider < 10 ms.
Denne protokollen beskriver trinn for trinn hvordan en tidsavklart EM-enhet (TED) utstyrt med en mikrofluidisk sprøytedyse kan brukes til å klargjøre gitter på en rask tidsskala14,15. Enheten har blitt brukt til å klargjøre rutenett med en minimum forsinkelsestid på 6 ms mellom prøveapplikasjon og frysing og for raskt å blande og fryse to prøver. Utformingen av TED er basert på en tidligere versjon16 og ligner på andre spraybaserte tids løste cryo-EM-enheter17.
Først beskrives de fire hoveddelene av TED-oppsettet. Kjernen i TED er væskehåndteringsenheten, som er ansvarlig for prøveaspirasjon og dispensering. Et pneumatisk stempel beveger gitteret gjennom sprayen inn i det flytende etanet. Generering av sprayen oppnås med mikrofluidiske sprøytedyser og frysing gjøres i en flytende etanbeholder, som er beskrevet kort. Til slutt er tilleggsfunksjonene for å kontrollere rutenettmiljøet, spesielt fuktighet, uthevet. Dette etterfølges av detaljerte protokoller for driften av enheten og for å utføre TrEM-eksperimenter. Representative resultater gis for rask nettforberedelse og et enkelt TrEM-eksperiment.
Eksperimentelt oppsett
Væskehåndteringsenheten
Væskehåndteringssystemet til TED dannes av tre sprøytedrivpumper (‘pumper 1 – 3’), hver utstyrt med en roterende ventil (figur 1). En strømforsyning gir pumper 1 – 3 med 24 V DC. Kommunikasjon med kontrollprogramvaren (skrevet i Visual Basic og C++) skjer via et RS232-grensesnitt for å pumpe 1. Kommandoene fordeles gjennom de serielle I/U-ekspansjonsportene fra pumpe 1 til pumpe 2-3. Pumper 1-3 er utstyrt med glasssprøyter (‘sprøyter 1-3’, vi bruker 250 μL / null døde volumsprøyter her). Hver ventil har to posisjoner, “last” og “dispenser”. “Last”-posisjonen brukes til å aspirere prøven inn i sprøyten. Et kort stykke (~ 3 – 4 cm) av 1/16″ O.D., 0.01′′ I.D. FEP-rør er koblet via ETFE/ETFE flensfrie beslag til ‘last’ posisjon av ventiler 1-3. Dette korte slangestykket når inn i prøvebeholderen (vanligvis et 1,5 ml eller 0,5 ml plastrør). “Dispenser”-posisjonen fører til sprøytedysen. Forbindelsen mellom “dispenser”-uttaket og sprøytedysen er laget av PE-rør (~ 20-30 cm lengde, 0,043″ O.D., 0,015″ I.D.), med et kort stykke ermerør (~ 0,5 cm) og ETFE/ETFE flensfrie beslag.
Det pneumatiske stempelet
TED bruker et pneumatisk stempel for å akselerere rutenettet og flytte det gjennom prøvesprayen inn i den flytende etanbeholderen. Pinsett med negativt trykk holder gitteret, skrudd inn i en hjemmebygd holder som er montert på en tostang pneumatisk sylinder (Figur 2A).
Trykket leveres fra en stor nitrogengassflaske (størrelse W), utstyrt med en flertrinnsregulator (0 – 10 bar, ‘hovedtrykk’). Fleksible forsterkede PVC-rør (12 mm O.D.) kobler regulatoren til en 12-porters manifold der trykksatt nitrogen leveres til dysen og det pneumatiske stempelet. Gassstrømmen gjennom dysen er konstant, regulert direkte ved nitrogenflasken (hovedtrykket). Tilkoblingen til munnstykket er laget med PU-rør (4 mm O.D., 2,5 mm I.D.), et kort stykke PE-rør (~ 8 cm lengde, 0,043″ O.D., 0,015″ I.D.) og passende kontakter. Trykket på det pneumatiske stempelet styres gjennom en magnetventil. PU-slangen (4 mm O.D., 2,5 mm I.D.) kobler magnetventilen til en regulator og det pneumatiske stempelet, slik at det blir redusert dykktrykk (≤ hovedtrykk). Magnetventilen er datastyrt. En skjematisk oversikt over oppsettet er angitt i Figur 2B.
Vær oppmerksom på at med dette oppsettet er stupetrykket alltid like eller mindre enn sprøytegasstrykket (hovedtrykket). Oppsettet kan imidlertid enkelt endres ved å inkorporere en annen regulator oppstrøms spraydysen for å tillate høyere stupehastigheter ved lavt sprøytegasstrykk. Høyt trykk (>> 2 bar) kan skade PDMS-sprøytedysen.
FORSIKTIG: Dette er et trykksystem, og “hovedtrykket” skal alltid være < 7 bar.
Trykk mellom 0,5 og 2 bar brukes vanligvis til det pneumatiske stempelet og viser en omtrent lineær sammenheng mellom trykk og hastighet (i sprayens vertikale posisjon). Dykkhastigheter måles med et oscilloskop, koblet i tråd med et skyv potensiometer (10 kΩ) og parallelt med en 2 kΩ motstand (Figur 2C). En strømforsyning gir potensiometeret 9 V DC. Mens den omtrentlige stupehastigheten stilles inn før eksperimentet ved å stille inn stupetrykket, gir potensiometeret en presis avlesning av hastigheten etter eksperimentet.
Spraydyser og flytende etanbeholder
Fabrikasjon og drift av gass-dynamiske virtuelle dyser for spraybasert prøvelevering er beskrevet andre steder i detalj15. Som beskrevet ovenfor er “dispenser”-uttakene til ventilene 1-3 koblet til dysens flytende innløp (figur 3A). Trykkspraygassen er koblet til dysens gassinntak. Innløpene i PDMS-sprøytedysene er slik at 0,043″ O.D. PE-rør kan brukes direkte uten behov for beslag. Vår dysedesign inneholder en “jet-in-jet” geometri for blanding av to prøver, som ligner på enheten beskrevet i ref.18. Et skjema av utformingen vises i figur 3B, et mikroskopisk bilde av en dyse vises i figur 3C. Utformingen av den mikrofluidiske enheten krever bruk av tre sprøyter for å blande to prøver. Sprøytemunnstykket er vanligvis plassert i 1-1,5 cm avstand fra gitteret (under prøvebruk).
Vi bruker flytende etan som kryogen, i en flytende etan/nitrogenbeholder som brukes til standard blotting-metoden. Vertikal posisjonering av væske etankoppen oppnås med en laboratorieløfteplattform.
Kontroll av spray- og rutenettmiljøet
Stempelet og sprøytemunnstykket finnes i en spesialbygd PMMA-boks (akrylglass) med en dobbel dør (figur 4A). Høy relativ luftfuktighet inne i esken oppnås ved et luftfuktingssystem på baksiden av TED (Figur 4B). Luft leveres av en pumpe og mates inn i en første 10″ beholder (vanligvis brukt til rensing av synkevann). Beholderen er fylt med et lavt (~ 5-10 cm) vannnivå og huser også en luftfukterenhet. Nettstrømmen til luftfukteren styres av en digital fuktighets-/temperaturregulator og en fuktighets-/temperatursensor plassert inne i akrylglassboksen. Kontrolleren er satt til å slå av pumpen når den relative luftfuktigheten når ≥ 90 %. Fuktet luft fra den første beholderen pumpes gjennom en diffusor, nedsenket i vann i en annen 10″ beholder og går deretter inn i akrylglassboksen.
FORSIKTIG: Fordi prøven er aerosolisert i sprøytedysen, er ikke farlige biologiske eller kjemiske prøver egnet som prøver.
Kjøresekvensen
Kjør skript-knappen i kontrollprogramvaren starter kjøresekvensen. Denne sekvensen med kommandoer kan forhåndsdeponeres i en skriptfil og endres gjennom programvaren. De viktigste variablene er forklart her:
Sprayhastighet: Sprayhastigheten bestemmer væskestrømningshastigheten som brukes av sprøytepumpen. Strømningshastigheten kan beregnes på følgende måte: Sprøytepumpemotorene som brukes her har en fast trinnstørrelse. Hele pumpens rekkevidde er delt inn i 48 000 trinn. Den andre viktige faktoren er sprøytevolumet. Vi bruker vanligvis 250 μL sprøyter. Sprayhastigheten i kontrollprogramvaren er angitt som antall trinn / sekund. En sprayhastighet på 1000 trinn/sekund tilsvarer:
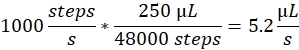
Sprøytevolum: Sprayvolumet bestemmer det totale volumet som skal sprøytes. Dermed bestemmer det også varigheten av sprayen. Sprayvolumet i kontrollprogramvaren er angitt som en rekke trinn. Et sprøytevolum på 2000 trinn, med en sprayhastighet på 1000 trinn / sekund, fører til en sprayvarighet på 2 s og et totalt volum på 10,4 μL.
Pre-spray tid: Denne variabelen definerer tiden mellom initiering av spray og dykk. Det er viktig å velge forsinkelsestiden slik at sprayen har tilstrekkelig tid til å stabilisere seg før du stuper rutenettet. Vanligvis får sprayen 1,5 – 4 s for å stabilisere seg før gitteret stupes. Sprayen opprettholdes til gitteret har beveget seg gjennom. Vanligvis stoppes væskestrømmen (og derfor sprayen) 0,5 til 1 s etter at gitteret er stupt. Ved hjelp av en sprayhastighet på 1000 trinn / s og et sprøytevolum på 2000 trinn, er en typisk forspraytid for eksempel 1,5 s.
En eksemplarisk sekvens med kommandoer vises i Figur 5A, rutenettposisjonen over tid er illustrert i Figur 5B.
Protocol
Representative Results
Discussion
Protokollene i dette arbeidet kan brukes til rask nettforberedelse ved direkte sprøyting og TrEM-eksperimenter. Rask nettforberedelse kan brukes til å redusere partikkelinteraksjoner med luftvanngrensesnittet5. Hovedbegrensningene er tilgjengelig prøvekonsentrasjon og istykkelse på rutenettet. Innenfor disse grensene og forutsatt at prøvekvaliteten er god, produserer protokollen rutenett som passer for høyoppløselig kryo-EM.
Feilsøking
Flyten…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
Vi vil takke Molly S.C. Gravett for nyttige diskusjoner og ABSL-anleggets ansatte for hjelp med cryo-EM-datainnsamling. David P. Klebl er stipendiat ved Wellcome Trust 4-årig ph.d.-program i Astbury-senteret finansiert av University of Leeds. FEI Titan Krios mikroskoper ble finansiert av University of Leeds (UoL ABSL award) og Wellcome Trust (108466/Z/15/Z). Dette arbeidet ble finansiert av et BBSRC-tilskudd til Stephen P. Muench (BB/P026397/1) og støttet av forskningsstipend til Howard D. White fra American Heart Association (AMR21-236078) og Howard D. White og Vitold Galkin fra U.S. National Institutes of Health (171261).
Materials
| Time resolved device | |||
| acrylic glass box | USA scientific | ||
| digital humidity/temperature controller | THE20 digital humidity/temperature controller | ||
| dual rod pneumatic cylinder | dual rod pneumatic cylinder TN 10×70 | ||
| FEP tubing | Upchurch Scientific 1/16” O.D., 0.01'' I.D. FEP tubing | ||
| flangeless fittings | Upchurch Scientific ETFE/ETFE flangeless fittings | ||
| flexible reinforced PVC tubing | 12 mm OD. flexible reinforced PVC tubing | ||
| glass syringes | Kloehn 250 µL zero-dead volume | ||
| humidifier pump | Interpret Aqua Air AP3 | ||
| liquid ethane container | from Thermo/FEI VitrobotTM Mark IV | ||
| multistage regulator | GASARC class 3 multistage regulator | ||
| negative pressure tweezers | Dumont N5 Inox B negative pressure tweezers | ||
| oscilloscope | Hantek 6022BE oscilloscope | ||
| PE tubing | Scientific Commodities Inc. 0.043” O.D., 0.015” I.D. PE tubing | ||
| power supply | Mean Well GSM160A24-R7B | ||
| power supply | Wanptek KPS305D power supply | ||
| PU tubing | SMC TU0425 4 mm O.D., 2.5 mm I.D. PU tubing | ||
| regulator | Norgren R72G-2GK-RMN | ||
| slide potentiometer | PS100 slide potentiometer | ||
| solenoid valve | SMC NVJ314M solenoid valve | ||
| syringe drive pumps | Kloehn V6 48K model | ||
| Reagents & Materials | |||
| apoferritin from equine spleen | Sigma-Aldrich, A3660 | ||
| ATP | Sigma-Aldrich, A2383 | ||
| cryo-EM grids | Quantifoil 300 mesh Cu, R 1.2/1.3 | ||
| EGTA | Sigma Aldrich E3889 | ||
| F-actin | Provided by H.D. White (for preparation procedure, see ref. 1) | ||
| glow-discharger | Cressington 208 carbon coater with a glow-discharge unit | ||
| HEPES | Sigma-Aldrich, H7006 | ||
| KAc | Sigma-Aldrich, P1190 | ||
| MgCl2 | Sigma-Aldrich, M8266 | ||
| MOPS | Sigma-Aldrich, M1254 | ||
| NaCl | Sigma-Aldrich, S9888 | ||
| Skeletal muscle myosin S1 | Provided by H.D. White (for preparation procedure, see ref. 2) | ||
| Ref 1 | Spudich, J. A. & Watt, S. The regulation of rabbit skeletal muscle contraction I. Biochemical studies of the interaction of the tropomyosin-troponin complex with actin and the proteolytic fragments of myosin. Journal of biological chemistry 246, 4866-4871 (1971). | ||
| Ref 2 | White, H. & Taylor, E. Energetics and mechanism of actomyosin adenosine triphosphatase. Biochimica 15, 5818-5826 (1976). |
Riferimenti
- Murphy, B. J., et al. Rotary substates of mitochondrial ATP synthase reveal the basis of flexible F1-Fo coupling. Science. 364, (2019).
- Benton, D. J., Gamblin, S. J., Rosenthal, P. B., Skehel, J. J. Structural transitions in influenza haemagglutinin at membrane fusion pH. Nature. , 1-4 (2020).
- Dance, A. Molecular motion on ice. Nature Methods. , 1-5 (2020).
- D’Imprima, E., et al. Protein denaturation at the air-water interface and how to prevent it. Elife. 8, 42747 (2019).
- Noble, A. J., et al. Reducing effects of particle adsorption to the air-water interface in cryo-EM. Nature Methods. 15, 793-795 (2018).
- Klebl, D. P., et al. Need for speed: Examining protein behaviour during cryoEM grid preparation at different timescales. BioRxiv. , (2020).
- Ravelli, R. B., et al. Cryo-EM structures from sub-nl volumes using pin-printing and jet vitrification. Nature Communications. 11, 1-9 (2020).
- Arnold, S. A., et al. Blotting-free and lossless cryo-electron microscopy grid preparation from nanoliter-sized protein samples and single-cell extracts. Journal of Structural Biology. 197, 220-226 (2017).
- Razinkov, I., et al. A new method for vitrifying samples for cryoEM. Journal of Structural Biology. 195, 190-198 (2016).
- Feng, X., et al. A fast and effective microfluidic spraying-plunging method for high-resolution single-particle cryo-EM. Structure. 25, 663-670 (2017).
- Ashtiani, D., et al. Delivery of femtolitre droplets using surface acoustic wave based atomisation for cryo-EM grid preparation. Journal of Structural Biology. 203, 94-101 (2018).
- Rubinstein, J. L., et al. Shake-it-off: a simple ultrasonic cryo-EM specimen-preparation device. Acta Crystallographica Section D: Structural Biology. 75, (2019).
- Mäeots, M. -. E., et al. Modular microfluidics enables kinetic insight from time-resolved cryo-EM. Nature Communications. 11, 1-14 (2020).
- Kontziampasis, D., et al. A cryo-EM grid preparation device for time-resolved structural studies. IUCrJ. 6, (2019).
- Klebl, D. P., et al. Sample deposition onto cryo-EM grids: from sprays to jets and back. Acta Crystallographica Section D: Structural Biology. 76, (2020).
- White, H., Thirumurugan, K., Walker, M., Trinick, J. A second generation apparatus for time-resolved electron cryo-microscopy using stepper motors and electrospray. Journal of Structural Biology. 144, 246-252 (2003).
- Kaledhonkar, S., Fu, Z., White, H., Frank, J. . Protein Complex Assembly. , 59-71 (2018).
- Trebbin, M., et al. Microfluidic liquid jet system with compatibility for atmospheric and high-vacuum conditions. Lab on a Chip. 14, 1733-1745 (2014).
- Klebl, D. P., Sobott, F., White, H. D., Muench, S. P. On-grid and in-flow mixing for time-resolved Cryo-EM. Acta Crystallographica Section D: Structural Biology. , (2021).
- He, S., Scheres, S. H. Helical reconstruction in RELION. Journal of Structural Biology. 198, 163-176 (2017).
- Millar, N. C., Geeves, M. A. The limiting rate of the ATP-mediated dissociation of actin from rabbit skeletal muscle myosin subfragment 1. FEBS Letters. 160, 141-148 (1983).
- Kasas, S., Dumas, G., Dietler, G., Catsicas, S., Adrian, M. Vitrification of cryoelectron microscopy specimens revealed by high-speed photographic imaging. Journal of Microscopy. 211, 48-53 (2003).
- Glaeser, R. M., et al. Defocus-dependent Thon-ring fading. bioRxiv. , (2020).
- Bagshaw, C. A beginner’s guide to flow kinetics. The Biochemist. 42, (2020).

