Snabb gallerförberedelse för tidsupp lös Cryo-Electron mikroskopi
Summary
Här tillhandahåller vi ett detaljerat protokoll för användning av en snabb nättillverkningsenhet för både snabb nättillverkning och för snabb blandning och frysning för att utföra tidsbefriade experiment.
Abstract
Området kryoelektronmikroskopi (cryo-EM) utvecklas snabbt med nya hårdvaru- och bearbetningsalgoritmer, vilket ger strukturer med högre upplösning och information om mer utmanande system. Provberedningen för cryo-EM genomgår en liknande revolution med nya metoder som utvecklas för att ersatt de traditionella blotting-systemen. Dessa inkluderar användning av piezo-elektriska dispensrar, stiftutskrift och direkt sprutning. Som ett resultat av denna utveckling går nätberedningens hastighet från sekunder till millisekunder, vilket ger nya möjligheter, särskilt när det gäller tidsuppfrista cryo-EM där proteiner och substrat snabbt kan blandas före dykfrysning och fånga kortlivade mellanliggande tillstånd. Här beskriver vi i detalj ett standardprotokoll för att göra rutnät på vår interna tids lösta EM-enhet både för standard snabb nätförberedelse och även för tids lösta experiment. Protokollet kräver minst ca 50 μL prov vid koncentrationer av ≥ 2 mg/ml för beredning av 4 rutnät. Fördröjningen mellan provprogram och frysning kan vara så låg som 10 ms. En begränsning är ökad istjocklek vid snabbare hastigheter och jämfört med blottingmetoden. Vi hoppas att detta protokoll kommer att hjälpa andra att utforma sina egna nättillverkningsanordningar och de som är intresserade av att utforma tids lösta experiment.
Introduction
Bakgrund
Den senaste utvecklingen inom kryoelektronmikroskopi (cryo-EM) har möjliggjort strukturella studier av alltmer komplexa system med hög upplösning. Med få undantag har sådana studier begränsats till biologiska makromolekyler vid jämvikt1 eller relativt långsamma reaktioner2. Många processer in vivo sker i en snabbare tidsskala (millisekunder) och det finns ett ökande intresse för tidsupp lös cryo-EM (TrEM) på dessa tidsskalor3. Konventionell cryo-EM provberedning med blotting-metoden är dock för långsam för millisekskond TrEM.
Blotting-metoden har andra begränsningar än dålig tidsupplösning. Proteiner och proteinkomplex kan drabbas av denaturering eller föredragen orientering på galler4. Att minska exponeringstiden för luft-vatten-gränssnittet under provberedningen har visat sig mildra önskad orientering och proteindenaturering5,6. Således möjliggör snabb nätberedning inte bara millisekekunder trEM utan kan också förbättra nätkvaliteten.
För närvarande finns det tre olika metoder för automatiserad nät förberedelse. Den första metoden använder en stift eller kapillär som rymmer en liten mängd prov. När provet har etablerat kontakt mellan vätskan och gallrets yta “skrivs” det pårutnätet 7,8. Exempel program processen är relativt långsam och tar några sekunder. Ett alternativt tillvägagångssätt använder kontrollerad droppgenerering av en piezo dispenser och självtransporterande galler9. Detta gör det möjligt för snabbare dispens att frysa tider, men begränsas fortfarande av droppe och wicking hastighet (för närvarande når 54 ms). Det snabbaste tillvägagångssättet hittills är den direkta spraymetoden, där provet finfördelas i ett sprutmunstycke och de små (~ 10 – 20 μm) och snabba (> 5 m/s) dropparna sprids vid kontakt med cryo-EM-nätet. Provsprayen kan genereras på olika sätt som luftblästringsatomer, akustiska ytvågor eller ultraljudsfuktare10,11,12,13. Enligt vår erfarenhet är istjockleken med direkt sprutning större men direkt sprutning gör det möjligt att frysa < 10 ms.
Detta protokoll beskriver steg för steg hur en tidsupp lös EM-enhet (TED) utrustad med ett mikrofluidiskt sprutmunstycke kan användas för att förbereda galler på en snabb tidsskala14,15. Enheten har använts för att förbereda galler med en minsta fördröjningstid på 6 ms mellan provapplicering och frysning och för att snabbt blanda och frysa två prover. Utformningen av TED är baserad på en tidigare version16 och liknar andra spraybaserade tidsbefriade cryo-EM-enheter17.
Först beskrivs de fyra huvuddelarna i TED-installationen. Kärnan i TED är vätskehanteringsenheten, som ansvarar för provambition och dispensering. En pneumatisk kolv flyttar gallret genom sprayen till den flytande etanen. Generering av sprayen uppnås med mikrofluidiska sprutmunstycken och frysning sker i en flytande etanbehållare, som beskrivs kortfattat. Slutligen markeras de ytterligare funktionerna för att styra nätmiljön, särskilt fuktighet. Detta följs av detaljerade protokoll för driften av enheten och för att utföra TrEM-experiment. Representativa resultat ges för snabb nätberedning och ett enkelt TrEM-experiment.
Experimentell installation
Vätskehanteringsenheten
TED:s vätskehanteringssystem bildas av tre sprutpumpar (“pumparna 1 – 3”), var och en utrustad med en roterande ventil (figur 1). En strömförsörjning ger pumpar 1 – 3 med 24 V DC. Kommunikationen med styrprogramvaran (skriven i Visual Basic och C++) sker via ett RS232-gränssnitt för att pumpa 1. Kommandona distribueras via de seriella I/O-expansionsportarna från pump 1 till pumparna 2-3. Pumparna 1-3 är utrustade med glassprutor (“sprutor 1-3”, vi använder 250 μL/noll döda volymsprutor här). Varje ventil har två lägen, “last” och “dispense”. Lastläget används för att aspirera prov i sprutan. En kort bit (~ 3 – 4 cm) av 1/16″ O.D., 0.01′′ I.D. FEP-slangar ansluts via ETFE / ETFE flänslösa beslag till “belastnings” -positionen för ventiler 1-3. Denna korta rörbit når in i provbehållaren (vanligtvis ett plaströr på 1,5 ml eller 0,5 ml). Dispenseringsläget leder till sprutmunstycket. Anslutningen mellan “dispense”-uttaget och sprutmunstycket görs genom PE-slangar (~ 20-30 cm längd, 0,043″ O.D., 0,015″ ID), med en kort bit ärmrör (~ 0,5 cm) och ETFE / ETFE flänslösa beslag.
Den pneumatiska kolven
TED använder en pneumatisk kolv för att accelerera gallret och flytta det genom provsprayen till den flytande etanbehållaren. Pincett med undertryck håller gallret, skruvat i en hembyggd hållare som är monterad på en pneumatisk cylinder med dubbla stångar (figur 2A).
Trycket levereras från en stor kvävegascylinder (storlek W), utrustad med en multistageregulator (0- 10 bar, “huvudtryck”). Flexibla förstärkta PVC-slangar (12 mm O.D.) förbinder regulatorn med ett grenrör med 12 portar där trycksatt kväve levereras till munstycket och den pneumatiska kolven. Gasflödet genom munstycket är konstant, reglerat direkt vid kvävecylindern (huvudtrycket). Anslutningen till munstycket är gjord med PU-slangar (4 mm O.D., 2,5 mm I.D.), en kort bit PE-slang (~ 8 cm längd, 0,043″ O.D., 0,015″ I.D.) och lämpliga kontakter. Trycket på den pneumatiska kolven styrs genom en magnetventil. PU-slangar (4 mm O.D., 2,5 mm I.D.) förbinder magnetventilen med en regulator och den pneumatiska kolven för att möjliggöra ett reducerat avsvalkningstryck (≤ huvudtryck). Magnetventilen är datorstyrd. En schematisk översikt över installationen ges i figur 2B.
Observera att med denna inställning är avsvalkningstrycket alltid lika med eller mindre än sprutgastrycket (huvudtrycket). Installationen kan dock enkelt ändras genom att en andra regulator införlivas uppströms sprutmunstycket för att möjliggöra högre avsvalkningshastigheter vid lågt sprutgastryck. Högt tryck (>> 2 bar) kan skada PDMS spraymunstycke.
VARNING: Detta är ett trycksystem och “huvudtrycket” ska alltid vara < 7 bar.
Tryck mellan 0,5 och 2 bar används vanligtvis för den pneumatiska kolven och visar ett ungefär linjärt förhållande mellan tryck och hastighet (i sprayens vertikala läge). Avsvalkningshastigheter mäts med ett oscilloskop, anslutet i linje med en glidpotentiometer (10 kΩ) och parallellt med ett 2 kΩ-motstånd (Figur 2C). En strömförsörjning ger potentiometern 9 V LIKSTRÖM. Medan den ungefärliga avsvalkningshastigheten ställs in före experimentet genom att ställa in avsvalkningstrycket, ger potentiometern en exakt avläsning av hastigheten efter experimentet.
Sprutmunstycken och flytande etanbehållare
Tillverkning och drift av gasdynamiska virtuella munstycken för spraybaserad provleverans har beskrivits någon annanstans i detalj15. Som beskrivits ovan är ventilernas “dispense”-utlopp 1-3 anslutna till munstyckets vätskeinlopp(figur 3A). Den trycksatta spraygasen ansluts till munstyckets gasinlopp. Inloppen i PDMS-sprutmunstyckena är sådana att 0,043″ O.D. PE-slangar kan användas direkt utan behov av beslag. Vår munstycksdesign innehåller en “jet-in-jet”-geometri för blandning av två prover, liknande den anordning som beskrivs i ref.18. Ett ritningsschema för konstruktionen visas i figur 3B, en mikroskopisk bild av ett munstycke visas i figur 3C. Utformningen av den mikrofluidiska enheten kräver användning av tre sprutor för att blanda två prover. Sprutmunstycket är vanligtvis placerat på 1-1,5 cm avstånd från gallret (under provapplicering).
Vi använder flytande etan som kryogen, i en flytande etan/ kvävebehållare som används för standard blotting-metoden. Vertikal positionering av vätskeetankoppen uppnås med en laboratorielyftplattform.
Kontroll av sprut- och nätmiljön
Kolven och sprutmunstycket finns i en specialbyggd PMMA-låda (akrylglas) med dubbeldörr (Figur 4A). Hög relativ luftfuktighet inuti lådan uppnås genom ett luftfuktningssystem på baksidan av TED(figur 4B). Luft levereras av en pump och matas in i en första 10″ behållare (vanligtvis används för vattenrening under diskbänk). Behållaren är fylld med en låg (~ 5-10 cm) vattennivå och rymmer även en luftfuktare. Nätström till luftfuktaren styrs av en digital fukt-/temperaturregulator och en fukt-/temperatursensor som finns inuti akrylglaslådan. Styrenheten är inställd på att stänga av pumpen när den relativa luftfuktigheten når ≥ 90 %. Fuktad luft från den första behållaren pumpas genom en diffusor, nedsänkt i vatten i en andra 10″-behållare och går sedan in i akrylglaslådan.
VARNING: Eftersom provet aerosoliseras i sprutmunstycket är farligt biologiskt eller kemiskt prov inte lämpligt som prover.
Körsekvensen
Knappen Kör skript i kontrollprogramvaran initierar körningssekvensen. Den här kommandosekvensen kan fördefinieras i en skriptfil och ändras via programvaran. De viktigaste variablerna förklaras här:
Sprayhastighet: Sprayhastigheten bestämmer det vätskeflöde som används av sprutpumpen. Flödeshastigheten kan beräknas enligt följande: De sprutpumpsmotorer som används här har en fast stegstorlek. Pumpens hela räckvidd är uppdelad i 48 000 steg. Den andra viktiga faktorn är sprutvolymen. Vi använder vanligtvis 250 μL sprutor. Spruthastigheten i styrprogramvaran är inställd som antal steg/sekund. En spruthastighet på 1000 steg/sekund motsvarar:
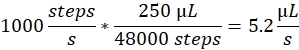
Sprayvolym: Sprayvolymen bestämmer den totala volymen som ska sprutas. Således bestämmer det också sprayens varaktighet. Sprayvolymen i styrprogramvaran är inställd som ett antal steg. En sprayvolym på 2000 steg, med en sprayhastighet på 1000 steg/sekund, leder till en spraylängd på 2 s och en total volym på 10,4 μL.
Pre-spray tid: Denna variabel definierar tiden mellan initiering av sprayen och dopp. Det är viktigt att välja fördröjningstiden så att sprayen har tillräckligt med tid att stabilisera innan du fäller gallret. Vanligtvis ges sprayen 1,5 – 4 s för att stabiliseras innan gallret kastas. Sprayen bibehålls tills gallret har gått igenom. Vanligtvis stoppas vätskeflödet (och därmed sprayen) 0,5 till 1 s efter att gallret har kastats. Med en sprayhastighet på 1000 steg/s och en sprayvolym på 2000 steg är en typisk pre-spraytid till exempel 1,5 s.
En exemplarisk sekvens av kommandon visas i figur 5A, rutnätets position över tiden illustreras i figur 5B.
Protocol
Representative Results
Discussion
Protokollen i detta arbete kan användas för snabb nätberedning genom direkt sprutning och TrEM-experiment. Snabb nätberedning kan användas för att minska partikelinteraktioner med luftvattengränssnittet5. De viktigaste begränsningarna är den tillgängliga provkoncentrationen och istjockleken på nätet. Inom dessa gränser och förutsatt att provkvaliteten är god, producerar protokollet galler som är lämpliga för högupplöst cryo-EM.
Felsökning</s…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
Vi vill tacka Molly S.C. Gravett för hjälpsamma diskussioner och ABSL:s anläggningspersonal för hjälp med kryo-EM-datainsamling. David P. Klebl är doktorand på Wellcome Trusts 4-åriga doktorandprogram i The Astbury Centre finansierat av University of Leeds. FEI Titan Krios mikroskop finansierades av University of Leeds (UoL ABSL award) och Wellcome Trust (108466/Z/15/Z). Detta arbete finansierades av ett BBSRC-anslag till Stephen P. Muench (BB/P026397/1) och stöddes av forskningsanslag till Howard D. White från American Heart Association (AMR21-236078) och Howard D. White och Vitold Galkin från U.S. National Institutes of Health (171261).
Materials
| Time resolved device | |||
| acrylic glass box | USA scientific | ||
| digital humidity/temperature controller | THE20 digital humidity/temperature controller | ||
| dual rod pneumatic cylinder | dual rod pneumatic cylinder TN 10×70 | ||
| FEP tubing | Upchurch Scientific 1/16” O.D., 0.01'' I.D. FEP tubing | ||
| flangeless fittings | Upchurch Scientific ETFE/ETFE flangeless fittings | ||
| flexible reinforced PVC tubing | 12 mm OD. flexible reinforced PVC tubing | ||
| glass syringes | Kloehn 250 µL zero-dead volume | ||
| humidifier pump | Interpret Aqua Air AP3 | ||
| liquid ethane container | from Thermo/FEI VitrobotTM Mark IV | ||
| multistage regulator | GASARC class 3 multistage regulator | ||
| negative pressure tweezers | Dumont N5 Inox B negative pressure tweezers | ||
| oscilloscope | Hantek 6022BE oscilloscope | ||
| PE tubing | Scientific Commodities Inc. 0.043” O.D., 0.015” I.D. PE tubing | ||
| power supply | Mean Well GSM160A24-R7B | ||
| power supply | Wanptek KPS305D power supply | ||
| PU tubing | SMC TU0425 4 mm O.D., 2.5 mm I.D. PU tubing | ||
| regulator | Norgren R72G-2GK-RMN | ||
| slide potentiometer | PS100 slide potentiometer | ||
| solenoid valve | SMC NVJ314M solenoid valve | ||
| syringe drive pumps | Kloehn V6 48K model | ||
| Reagents & Materials | |||
| apoferritin from equine spleen | Sigma-Aldrich, A3660 | ||
| ATP | Sigma-Aldrich, A2383 | ||
| cryo-EM grids | Quantifoil 300 mesh Cu, R 1.2/1.3 | ||
| EGTA | Sigma Aldrich E3889 | ||
| F-actin | Provided by H.D. White (for preparation procedure, see ref. 1) | ||
| glow-discharger | Cressington 208 carbon coater with a glow-discharge unit | ||
| HEPES | Sigma-Aldrich, H7006 | ||
| KAc | Sigma-Aldrich, P1190 | ||
| MgCl2 | Sigma-Aldrich, M8266 | ||
| MOPS | Sigma-Aldrich, M1254 | ||
| NaCl | Sigma-Aldrich, S9888 | ||
| Skeletal muscle myosin S1 | Provided by H.D. White (for preparation procedure, see ref. 2) | ||
| Ref 1 | Spudich, J. A. & Watt, S. The regulation of rabbit skeletal muscle contraction I. Biochemical studies of the interaction of the tropomyosin-troponin complex with actin and the proteolytic fragments of myosin. Journal of biological chemistry 246, 4866-4871 (1971). | ||
| Ref 2 | White, H. & Taylor, E. Energetics and mechanism of actomyosin adenosine triphosphatase. Biochimica 15, 5818-5826 (1976). |
Riferimenti
- Murphy, B. J., et al. Rotary substates of mitochondrial ATP synthase reveal the basis of flexible F1-Fo coupling. Science. 364, (2019).
- Benton, D. J., Gamblin, S. J., Rosenthal, P. B., Skehel, J. J. Structural transitions in influenza haemagglutinin at membrane fusion pH. Nature. , 1-4 (2020).
- Dance, A. Molecular motion on ice. Nature Methods. , 1-5 (2020).
- D’Imprima, E., et al. Protein denaturation at the air-water interface and how to prevent it. Elife. 8, 42747 (2019).
- Noble, A. J., et al. Reducing effects of particle adsorption to the air-water interface in cryo-EM. Nature Methods. 15, 793-795 (2018).
- Klebl, D. P., et al. Need for speed: Examining protein behaviour during cryoEM grid preparation at different timescales. BioRxiv. , (2020).
- Ravelli, R. B., et al. Cryo-EM structures from sub-nl volumes using pin-printing and jet vitrification. Nature Communications. 11, 1-9 (2020).
- Arnold, S. A., et al. Blotting-free and lossless cryo-electron microscopy grid preparation from nanoliter-sized protein samples and single-cell extracts. Journal of Structural Biology. 197, 220-226 (2017).
- Razinkov, I., et al. A new method for vitrifying samples for cryoEM. Journal of Structural Biology. 195, 190-198 (2016).
- Feng, X., et al. A fast and effective microfluidic spraying-plunging method for high-resolution single-particle cryo-EM. Structure. 25, 663-670 (2017).
- Ashtiani, D., et al. Delivery of femtolitre droplets using surface acoustic wave based atomisation for cryo-EM grid preparation. Journal of Structural Biology. 203, 94-101 (2018).
- Rubinstein, J. L., et al. Shake-it-off: a simple ultrasonic cryo-EM specimen-preparation device. Acta Crystallographica Section D: Structural Biology. 75, (2019).
- Mäeots, M. -. E., et al. Modular microfluidics enables kinetic insight from time-resolved cryo-EM. Nature Communications. 11, 1-14 (2020).
- Kontziampasis, D., et al. A cryo-EM grid preparation device for time-resolved structural studies. IUCrJ. 6, (2019).
- Klebl, D. P., et al. Sample deposition onto cryo-EM grids: from sprays to jets and back. Acta Crystallographica Section D: Structural Biology. 76, (2020).
- White, H., Thirumurugan, K., Walker, M., Trinick, J. A second generation apparatus for time-resolved electron cryo-microscopy using stepper motors and electrospray. Journal of Structural Biology. 144, 246-252 (2003).
- Kaledhonkar, S., Fu, Z., White, H., Frank, J. . Protein Complex Assembly. , 59-71 (2018).
- Trebbin, M., et al. Microfluidic liquid jet system with compatibility for atmospheric and high-vacuum conditions. Lab on a Chip. 14, 1733-1745 (2014).
- Klebl, D. P., Sobott, F., White, H. D., Muench, S. P. On-grid and in-flow mixing for time-resolved Cryo-EM. Acta Crystallographica Section D: Structural Biology. , (2021).
- He, S., Scheres, S. H. Helical reconstruction in RELION. Journal of Structural Biology. 198, 163-176 (2017).
- Millar, N. C., Geeves, M. A. The limiting rate of the ATP-mediated dissociation of actin from rabbit skeletal muscle myosin subfragment 1. FEBS Letters. 160, 141-148 (1983).
- Kasas, S., Dumas, G., Dietler, G., Catsicas, S., Adrian, M. Vitrification of cryoelectron microscopy specimens revealed by high-speed photographic imaging. Journal of Microscopy. 211, 48-53 (2003).
- Glaeser, R. M., et al. Defocus-dependent Thon-ring fading. bioRxiv. , (2020).
- Bagshaw, C. A beginner’s guide to flow kinetics. The Biochemist. 42, (2020).

