Produktion af membranfiltrerede faseskiftdecafluorobutan nanodråber fra præformede mikrobubbles
Summary
Denne protokol beskriver en metode til at generere store mængder lipid indkapslede decafluorobutane mikrobubbles ved hjælp af sonde-tip sonikering og efterfølgende kondensere dem i fase-shift nanodroplets ved hjælp af højtryk ekstrudering og mekanisk filtrering.
Abstract
Der er mange metoder, der kan bruges til produktion af vaporizable fase-shift dråber til billeddannelse og terapi. Hver metode bruger forskellige teknikker og varierer i pris, materialer og formål. Mange af disse fremstillingsmetoder resulterer i polydispersepopulationer med ikke-ensartede aktiveringstærskler. Derudover kræver styring af dråbestørrelserne typisk stabile perfluorcarbonvæsker med høje aktiveringstærskler, der ikke er praktiske in vivo. Produktion af ensartede dråbestørrelser ved hjælp af lavkogende punktgasser ville være gavnligt for in vivo imaging og terapi eksperimenter. I denne artikel beskrives en enkel og økonomisk metode til dannelse af størrelsesfiltrerede lipid-stabiliserede faseskift nanodråber med lavkogende punktdecafluorobutan (DFB). En fælles metode til fremstilling af lipidmikrobubbles er beskrevet, ud over en ny metode til at kondensere dem med højtryksekstrudering i et enkelt trin. Denne metode er designet til at spare tid, maksimere effektiviteten og generere større mængder mikrobubble- og nanodråbeløsninger til en lang række applikationer ved hjælp af almindeligt laboratorieudstyr, der findes i mange biologiske laboratorier.
Introduction
Ultralyd kontrast agenter (UCAs) er hastigt stigende i popularitet for billedbehandling og terapi applikationer. Mikrokøb, de oprindeligeucas, er i øjeblikket mainstream agenter, der anvendes i kliniske diagnostiske applikationer. Mikrobobler er gasfyldte kugler, typisk 1-10 μm i diameter, omgivet af lipid, protein eller polymer skaller1. Deres størrelse og in vivo stabilitet kan dog begrænse deres funktionalitet i mange applikationer. Faseskift nanodroplets, som indeholder en overophedet flydende kerne, kan overvinde nogle af disse begrænsninger på grund af deres mindre størrelse og forbedrede cirkulation-liv2. Når den overophedede væskekerne udsættes for varme eller akustisk energi, fordampes den til at danne en gasmikrobubble2,3,4,5. Da fordampningstærsklen er direkte relateret til dråbestørrelse5,6, ville det være meget ønskeligt at formulere dråbeaffjedring med ensartet størrelse for at opnå ensartede aktiveringstærskler. Formuleringsmetoder, der producerer ensartede dråbestørrelser, er ofte komplekse og dyre, mens mere omkostningseffektive tilgange resulterer i polydisperseløsninger7. En anden begrænsning er evnen til at generere stabile faseskiftdråber med lavkogende punkt perfluorcarbon (PFC) gasser, som er afgørende for effektiv aktivering in vivo8. I dette manuskript er en protokol beskrevet til generering af stabile filtrerede lavkogningspunkt fordampelige faseskiftdråber til in vivobilleddannelse og terapiapplikationer.
Der er mange metoder til fremstilling af monodispersed submicron fase-skift dråber7. En af de mest robuste metoder til styring af størrelse er brugen af mikrofluidiske enheder. Disse enheder kan være dyre, har langsomme dråber produktion (~ 104-106 dråber / s)7, og kræver omfattende uddannelse. Mikrofluidiske enheder kræver også generelt gasser med høj kogepunkt for at undgå spontan fordampning og tilstopning af systemet7. En nylig undersøgelse foretaget af de Gracia Lux et al.9 viser imidlertid, hvordan køling af et mikrofluidizer kan bruges til at generere høje koncentrationer af faseskift under mikron (1010-1012/mL) ved hjælp af lavt kogepunktdecafluorobutan (DFB) eller octafluoropropan (OFP).
Generelt er lavkognitsgasser som DFB eller OFP lettere at håndtere ved hjælp af præformede gasbobler. Vaporizable dråber kan fremstilles af prækursor lipid-stabiliseret bobler ved at kondensere gassen ved hjælp af lave temperaturer og forhøjet tryk5,10. Koncentrationen af dråber produceret ved hjælp af denne metode afhænger af prækursor mikrobubble koncentration og effektiviteten af konvertering af bobler til dråber. Koncentreret mikrobobler er blevet rapporteret fra tip sonikering nærmer sig > 1010 MB/mL11, mens en separat undersøgelse har rapporteret dråbe koncentrationer spænder fra ~ 1-3 x1011 dråber / mL fra kondenseret OFP og DFP bobler12. Når monodispersed dråber ikke er et problem, kondensering metoder er de mest ligetil og billigste metoder til at generere lipid-stabiliseret fase-skift dråber ved hjælp af lavkogning punkt PFC’er. Metoder til at generere ensartet størrelse bobler før kondensering kan bidrage til at skabe mere monodisperse populationer af dråber. Det er imidlertid også vanskeligt at generere monodisperse prækursorbobler, hvilket kræver dyrere tilgange såsom mikrofluidics eller gentagne differentialcentrifugeringsteknikker11. En alternativ tilgang til produktion af DFB og OFB nanodroplets er for nylig blevet offentliggjort ved hjælp af spontan nukleation af dråber i liposomer13. Denne metode, udnytte en “Ouzo” effekt, er en enkel måde at generere lavkogning punkt PFC dråber uden at skulle kondensere bobler. Størrelsesfordelingen af PFC-dråberne kan styres af delikat titrering og blanding af PFC-, lipid- og ethanolkomponenter, der bruges til at starte nukleation af dråberne. Det er også værd at bemærke, at blanding af perfluorcarboner kan bruges til at kontrollere stabilitet og aktivering tærskler for nanodroplets14,15. Nyere arbejde af Shakya et al. viser, hvordan aktivering af nanodråbe kan indstilles ved at emulgere højkogningpunkt-PFC’er i et kulbrinte endoskelet for at lette heterogen nukleation i dråbekernen16, hvilket er en tilgang, der kan overvejes sammen med andre former for filtrering af dråbestørrelse.
Når de er dannet, kan faseskiftdråber ekstruderes efter dannelse for at skabe flere monodispersepopulationer. Faktisk er en lignende protokol til den metode, der er beskrevet her, tidligere blevet offentliggjort af Kopechek et al.17 ved hjælp af høj kogepunkt dodecofluorpentane (DDFP) som dråbekernen. Læsere, der søger at bruge faseskiftdråber med højkogningspunkt perfluorcarboner (stabile ved stuetemperatur), bør i stedet henvise til artiklen ovenfor. Generering og ekstrudering af dråber med lav kogepunkt gasser, såsom DFB og OFP, er mere kompliceret og er bedst gribes an ved at kondensere præformede gasbobler.
I denne protokol, en fælles metode til at generere præformede lipid mikrobubbles med en DFB gas kerne ved hjælp af sonde tip sonikering er beskrevet. Dernæst bruges en kommerciel ekstruder til at kondensere præformede mikrobubbles i submicron faseskift nanodråber (figur 1). De resulterende dråber kan derefter aktiveres ved varme og ultralyd. Denne metode kan producere større mængder nanodråbeopløsning end konventionelle kondensmetoder med smallere størrelsesfordelinger uden behov for dyre mikrofluidiske enheder. Produktionen af nanodråbeløsninger med smal størrelsesfordelinger kan sandsynligvis generere mere ensartede fordampningstærskler. Dette vil maksimere deres potentiale for mange applikationer såsom billeddannelse, ablation, lægemiddellevering, og embolisering1,3,4,6.
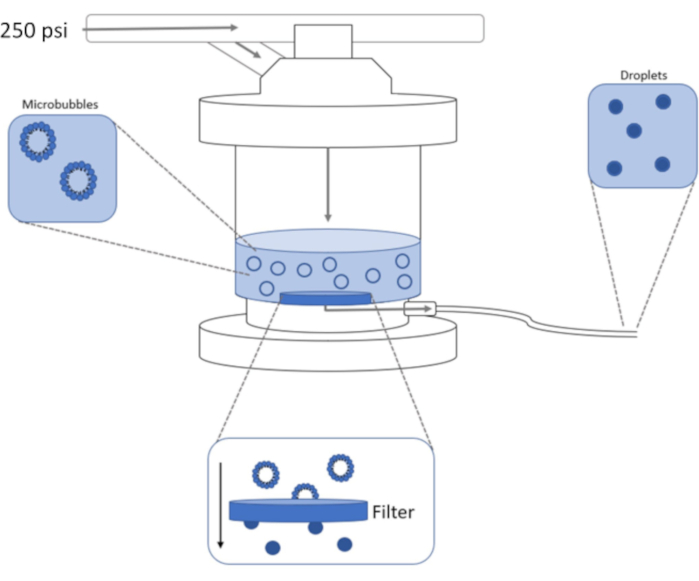
Figur 1: Skematisk af højtryksekstruderingsopsætning til kondenserende præformede mikrobubbles i faseskift nanodråber. Mikrobobbleopløsning tilsættes og er indeholdt i ekstruderkammeret, og 250 psi fra nitrogentanken påføres gennem kammerets indløbsventil. Nitrogengassen vil skubbe mikrobobbleopløsningen gennem filteret i bunden af kammeret og kondensere prøven til nanodråber. Opløsningen skubbes til sidst ud af ekstruder gennem prøveudtagrøret og opsamles. Klik her for at se en større version af dette tal.
Protocol
Representative Results
Discussion
En omfattende mængde litteratur er tilgængelig, der diskuterer formulering, fysik og potentielle anvendelser af mikrobobler og faseskiftdråber til in vivo imaging og terapi. Denne diskussion vedrører eksplicit at generere lipid mikrobubbles og konvertere dem til sub-mikron fase-shift dråber ved hjælp af et lavt kogepunkt DFB gas og højtryk ekstrudering. Den metode, der er skitseret her, er beregnet til at give en relativt enkel metode til fremstilling af store mængder lipidmikrobubbles og DFB faseskiftdråber ved…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
Vi vil gerne takke Dominique James i Dr. Ken Hoyt’s lab for at give TRSP analyse af vaporizable fase-shift nanodroplets
Materials
| 15 mL Centrifuge Tubes | Falcon | 352095 | Collecting and centrifuging droplets |
| 200 nm polycarbonate filter | Whatman | 110606 | Extruder filters |
| 2-methylbutane | Fisher Chemical | 03551-4 | Rapid precooling of microbubble solution prior to extrusion |
| 3-prong clamps X2 | Fisher | 02-217-002 | Holding scintilation vials in place for probe tip sonication |
| 400W Analog Probe Tip Sonicator with Horn | Branson | 101-063-198R | Used to generate lipid microbubbles from lipid solution |
| Bath Sonicator | Fisher Scientific | 15337402 | Used to help breakdown liposomes into unilamellar vesicles |
| Chloroform | Fisher Bioreagents | C298-4 | Used to make lipid film for microbubble preperation |
| Decafluorobutane (Perfluorobutane) Gas | FluoroMed L.P. | 1 kg | generating microbubbles via probe tip sonication |
| Dry Ice | – | – | Rapid precooling of microbubble solution prior to extrusion |
| DSPC Lipid Powder | NOF America | COATSOME MC-8080 | Component of lipid film |
| DSPE-PEG-2K Lipid Powder | NOF America | SUNBRIGHT DSPE-020CN | Component of lipid film |
| General Thermometer | – | – | Used to measure ice bath temperature and 2-methylbutane temperature ( needs to accommodate -20C temperatures) |
| Glass Syringes | Hamilton | 81139 | Used to mix lipids in chloroform |
| Glycerol | Fisher Bioreagents | BP229-1 | Reduces freezing temperature of PBS solution |
| Heating Block | VWR Scientific Products | Heating lipid films and vaporizing droplets | |
| Lipex 10 mL Extruder | Evonik | Commercial high-pressure extrusion system | |
| Mini Vortex Mixer | Fisher brand | 14-955-151 | Used to remove excess chloroform from lipid films |
| Nitrogen Tank | – | – | Used to operate extruder |
| Phosphate Buffer Saline | Fisher Scientific | Hydrate lipid films and washing droplets | |
| Polyester Drain Disk | Whatman | 230600 | Provides support for polycarbonate filter |
| Polypropylene Caps | Fisher Scientific | 298417 | Used for solution storage |
| Propylene Glycol | Fisher Chemical | P355-1 | Reduces freezing temperature of PBS solution |
| Scintiliation Vials | DWK Life Sciences Wheaton | 986532 | Used for lipid films and microbubble generation |
| Small hammer | – | – | Used to break apart dry ice for cooling methylbutane |
| Sonicator Microtip Attachment | Branson | 101148070 | Used to generate microbubbles from lipid solution |
| Steel Container | Medegen | 79310 | Rapid precooling of microbubble solution prior to extrusion ( any container rated to -20C will work) |
| Vacuume Dessicator | Bel-Art SP Scienceware | 08-648-100 | Removes excess chloroform from lipid films |
| 2mL Centrifuge Tube | Fisher | 02682004 | Used for concentrating nanodroplets |
Riferimenti
- Sirsi, S., Borden, M. Microbubble compositions, properties and biomedical applications. Bubble Science Engineering and Technology. 1 (1-2), 3-17 (2009).
- Sheeran, P. S., Dayton, P. A. Phase-change contrast agents for imaging and therapy. Current Pharmaceutical Design. 18 (15), 2152-2165 (2012).
- Mountford, P. A., Smith, W. S., Borden, M. A. Fluorocarbon nanodrops as acoustic temperature probes. Langmuir: The ACS Journal of Surfaces and Colloids. 31 (39), 10656-10663 (2015).
- Mountford, P. A., Thomas, A. N., Borden, M. A. Thermal activation of superheated lipid-coated perfluorocarbon drops. Langmuir: The ACS Journal of Surfaces and Colloids. 31 (16), 4627-4634 (2015).
- Sheeran, P. S., Luois, S., Dayton, P. A., Matsunaga, T. O. Formulation and acoustic studies of a new phase-shift agent for diagnostic and therapeutic ultrasound. Langmuir: The ACS Journal of Surfaces and Colloids. 27 (17), 10412-10420 (2011).
- Sheeran, P. S., Dayton, P. A. Improving the performance of phase-change perfluorocarbon droplets for medical ultrasonography: current progress, challenges, and prospects. Scientifica. 2014, 579684 (2014).
- Sheeran, P. S., et al. Methods of generating submicrometer phase-shift perfluorocarbon droplets for applications in medical ultrasonography. IEEE Transactions on Ultrasonics, Ferroelectrics, and Frequency Control. 64 (1), 252-263 (2017).
- Sheeran, P. S., et al. Decafluorobutane as a phase-change contrast agent for low-energy extravascular ultrasonic imaging. Ultrasound in Medicine & Biology. 37 (9), 1518-1530 (2011).
- de Gracia Lux, C., et al. Novel method for the formation of monodisperse superheated perfluorocarbon nanodroplets as activatable ultrasound contrast agents. RSC Advances. 7 (77), 48561-48568 (2017).
- Mountford, P. A., Sirsi, S. R., Borden, M. A. Condensation phase diagrams for lipid-coated perfluorobutane microbubbles. Langmuir: The ACS Journal of Surfaces and Colloids. 30 (21), 6209-6218 (2014).
- Feshitan, J. A., Chen, C. C., Kwan, J. J., Borden, M. A. Microbubble size isolation by differential centrifugation. Journal of Colloid and Interface Science. 329 (2), 316-324 (2009).
- Wu, S. -. Y., et al. Focused ultrasound-facilitated brain drug delivery using optimized nanodroplets: vaporization efficiency dictates large molecular delivery. Physics in Medicine and Biology. 63 (3), 035002 (2018).
- Li, D. S., et al. Spontaneous Nucleation of stable perfluorocarbon emulsions for ultrasound contrast agents. Nano Letters. 19 (1), 173-181 (2019).
- Sheeran, P. S., Luois, S. H., Mullin, L. B., Matsunaga, T. O., Dayton, P. A. Design of ultrasonically-activatable nanoparticles using low boiling point perfluorocarbons. Biomaterials. 33 (11), 3262-3269 (2012).
- Kawabata, K., Sugita, N., Yoshikawa, H., Azuma, T., Umemura, S. Nanoparticles with multiple perfluorocarbons for controllable ultrasonically induced phase shifting. Japanese Journal of Applied Physics. 44 (6), 4548-4552 (2005).
- Shakya, G., et al. Vaporizable endoskeletal droplets via tunable interfacial melting transitions. Science Advances. 6 (14), 7188 (2020).
- Kopechek, J. A., Zhang, P., Burgess, M. T., Porter, T. M. Synthesis of phase-shift nanoemulsions with narrow size distributions for acoustic droplet vaporization and bubble-enhanced ultrasound-mediated ablation. Journal of Visualized Experiments: JoVE. (67), e4308 (2012).

