Produção de nanodroplets de decafluorobutano filtrados por membrana a partir de microbolhas pré-formadas
Summary
Este protocolo descreve um método de geração de grandes volumes de microbolhas de decafluorobutano encapsuladas lipídicas usando sônica de ponta de sonda e, posteriormente, condensando-as em nanodroplets de mudança de fase usando extrusão de alta pressão e filtração mecânica.
Abstract
Existem muitos métodos que podem ser usados para a produção de gotículas vaporizáveis de mudança de fase para imagem e terapia. Cada método utiliza técnicas diferentes e varia em preço, materiais e propósito. Muitos desses métodos de fabricação resultam em populações polidispersas com limiares de ativação não uniformes. Além disso, controlar os tamanhos das gotículas normalmente requer líquidos perfluorocarbonos estáveis com altos limiares de ativação que não são práticos in vivo. Produzir tamanhos uniformes de gotículas usando gases de ponto de baixa ebulição seria benéfico para experimentos de imagem e terapia in vivo. Este artigo descreve um método simples e econômico para a formação de nanodroplets de mudança de fase estabilizadas lipídicas com decafluorobutano de ponto de baixa ebulição (DFB). Descreve-se um método comum de geração de microbolhas lipídicas, além de um novo método de condensação deles com extrusão de alta pressão em um único passo. Este método foi projetado para economizar tempo, maximizar a eficiência e gerar maiores volumes de soluções de microbolhas e nanodroplet para uma grande variedade de aplicações usando equipamentos de laboratório comuns encontrados em muitos laboratórios biológicos.
Introduction
Os agentes de contraste de ultrassom (UCAs) estão crescendo rapidamente em popularidade para aplicações de imagem e terapia. Os microbolhas, os UCAs originais, são atualmente os principais agentes utilizados em aplicações de diagnóstico clínico. Microbolhas são esferas cheias de gás, tipicamente de 1-10 μm de diâmetro, cercadas por conchas lipídicas, proteicas ou polímeras1. No entanto, seu tamanho e estabilidade in vivo podem limitar sua funcionalidade em muitos aplicativos. Nanodroplets de mudança de fase, que contêm um núcleo líquido superaquecido, podem superar algumas dessas limitações devido ao seu tamanho menor e à melhoria da vida útil da circulação2. Quando exposto ao calor ou à energia acústica, o núcleo líquido superaquecido vaporiza para formar um microbolhas de gás2,3,4,5. Uma vez que o limiar de vaporização está diretamente relacionado com o tamanho da gotícula5,6, formular suspensões de gotículas com tamanho uniforme seria altamente desejável para alcançar limites de ativação consistentes. Métodos de formulação que produzem tamanhos uniformes de gotículas são muitas vezes complexos e caros, enquanto abordagens mais econômicas resultam em soluções polidisperses7. Outra limitação é a capacidade de gerar gotículas de mudança de fase estáveis com gases de perfluorocarbono de ponto de baixa ebulição (PFC), o que é fundamental para uma ativação eficiente no vivo8. Neste manuscrito, é descrito um protocolo para gerar gotículas vaporizáveis de ponto de baixa ebulição filtradas para aplicações de imagem e terapia in vivo.
Existem muitos métodos de produção de gotículas de mudança de fase de submicron monodisperspersed7. Um dos métodos mais robustos de controle de tamanho é o uso de dispositivos microfluidos. Esses dispositivos podem ser caros, ter taxas lentas de produção de gotículas (~104-106 gotículas/s)7 e requerem treinamento extensivo. Dispositivos microfluidos também geralmente requerem gases de ponto de alta ebulição para evitar a vaporização espontânea e o entupimento do sistema7. No entanto, um estudo recente de De Gracia Lux et al.9 demonstra como o resfriamento de um microfluidizador pode ser usado para gerar altas concentrações de mudança de fase sub-micron (1010-1012/mL) usando decafluorobutano de ponto de baixa ebulição (DFB) ou octafluoropropano (OFP).
Em geral, gases de ponto de baixa ebulição, como DFB ou OFP, são mais fáceis de manusear usando bolhas de gás pré-formadas. Gotículas vaporizáveis podem ser produzidas a partir de bolhas precursoras estabilizadas lipídios, condensando o gás usando baixas temperaturas e pressão elevada5,10. A concentração de gotículas produzidas usando este método depende da concentração precursora de microbolhas e eficiência da conversão de bolhas em gotículas. Microbolhas concentradas foram relatadas a partir da sônica de ponta que se aproxima > 1010 MB/mL11, enquanto um estudo separado relatou concentrações de gotículas que variam de ~1-3 x1011 gotículas/mL de bolhas condensadas OFP e DFP12. Quando gotículas monodisperadas não são uma preocupação, os métodos de condensação são os métodos mais simples e de menor custo de gerar gotículas de mudança de fase estabilizadas lipídicas usando PFCs de ponto de baixa ebulição. Métodos de geração de bolhas de tamanho uniforme antes da condensação podem ajudar a criar populações mais monodispersas de gotículas. No entanto, a geração de bolhas precursoras monodisperses também é difícil, exigindo abordagens mais caras, como microfluidos ou técnicas repetidas de centrifugação diferencial11. Uma abordagem alternativa para a produção de nanodroplets DFB e OFB foi publicada recentemente usando nucleação espontânea de gotículas em lipossomos13. Este método, utilizando um efeito “Ouzo”, é uma maneira simples de gerar gotículas PFC de ponto de baixa ebulição sem precisar condensar bolhas. A distribuição de tamanho das gotículas PFC pode ser controlada por delicadas titulação e mistura de componentes PFC, lipídios e etanol usados para iniciar a nucleação das gotículas. Também vale a pena notar que a mistura de perfluorocarbonos pode ser usada para controlar os limiares de estabilidade e ativação de nanodroplets14,15. Trabalhos mais recentes de Shakya et al. demonstram como a ativação de nanodroplets pode ser ajustada ao emulsionar PFCs de alto ponto de ebulição dentro de um endoesqueleto de hidrocarbonetos para facilitar a nucleação heterogênea dentro do núcleo gotícula16, que é uma abordagem que pode ser considerada juntamente com outras formas de filtragem do tamanho de gotícula.
Uma vez formadas, gotículas de mudança de fase podem ser extrudadas após a formação para criar populações mais monodispersas. Na verdade, um protocolo semelhante ao método descrito aqui foi publicado anteriormente por Kopechek et al.17 usando o ponto de ebulição alto dodecofluorpentano (DDFP) como o núcleo gotícula. Os leitores que procuram usar gotículas de mudança de fase com perfluorocarbonos de ponto de alta ebulição (estáveis à temperatura ambiente) devem fazer referência ao artigo acima. Gerar e extrudar gotículas com gases de ponto de ebulição baixos, como DFB e OFP, é mais complicado e é melhor abordado pela condensação de bolhas de gás pré-formadas.
Neste protocolo, é descrito um método comum de geração de microbolhas lipídicas pré-formadas com um núcleo de gás DFB usando a sônica da ponta da sonda. Em seguida, uma extrusora comercial é usada para condensar microbolhas pré-formadas em nanodroplets de mudança de fase de submicron (Figura 1). As gotículas resultantes são então ativadas por calor e ultrassom. Este método pode produzir volumes maiores de solução de nanodroplet do que métodos convencionais de condensação com distribuições de tamanho mais estreitas sem a necessidade de dispositivos microfluidos caros. A produção de soluções de nanodroplet com distribuições de tamanho estreito pode provavelmente gerar mais limites de vaporização uniformes. Isso maximizará seu potencial para inúmeras aplicações, como imagem, ablação, entrega de medicamentos e embolização1,3,4,6.
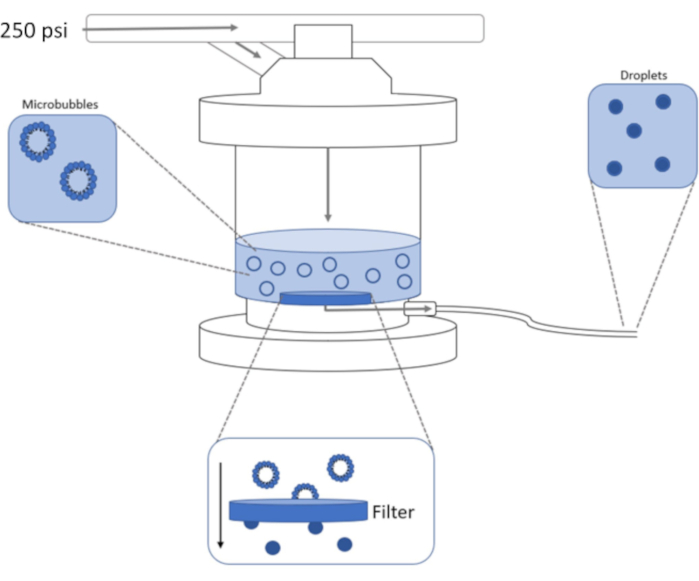
Figura 1: Esquema de configuração de extrusão de alta pressão para condensar microbolhas pré-formadas em nanodroplets de mudança de fase. A solução de microbolhas é adicionada e contida na câmara extrusora, e 250 psi, do tanque de nitrogênio, é aplicada através da válvula de entrada da câmara. O gás nitrogênio empurrará a solução de microbolhas através do filtro na base da câmara, condensando a amostra em nanodroplets. A solução é finalmente empurrada para fora da extrusora através do tubo de saída de amostra e coletada. Clique aqui para ver uma versão maior desta figura.
Protocol
Representative Results
Discussion
Está disponível um corpo abrangente de literatura que discute a formulação, física e aplicações potenciais de microbolhas e gotículas de mudança de fase para imagem e terapia in vivo. Esta discussão diz respeito explicitamente à geração de microbolhas lipídicas e à conversão em gotículas de mudança de fase sub-micron usando um baixo ponto de ebulição de gás DFB e extrusão de alta pressão. O método aqui descrito destina-se a fornecer um método relativamente simples de produzir grandes quantidades …
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
Gostaríamos de agradecer a Dominique James no laboratório do Dr. Ken Hoyt por fornecer análises TRSP de nanodroplets vaporizáveis de mudança de fase
Materials
| 15 mL Centrifuge Tubes | Falcon | 352095 | Collecting and centrifuging droplets |
| 200 nm polycarbonate filter | Whatman | 110606 | Extruder filters |
| 2-methylbutane | Fisher Chemical | 03551-4 | Rapid precooling of microbubble solution prior to extrusion |
| 3-prong clamps X2 | Fisher | 02-217-002 | Holding scintilation vials in place for probe tip sonication |
| 400W Analog Probe Tip Sonicator with Horn | Branson | 101-063-198R | Used to generate lipid microbubbles from lipid solution |
| Bath Sonicator | Fisher Scientific | 15337402 | Used to help breakdown liposomes into unilamellar vesicles |
| Chloroform | Fisher Bioreagents | C298-4 | Used to make lipid film for microbubble preperation |
| Decafluorobutane (Perfluorobutane) Gas | FluoroMed L.P. | 1 kg | generating microbubbles via probe tip sonication |
| Dry Ice | – | – | Rapid precooling of microbubble solution prior to extrusion |
| DSPC Lipid Powder | NOF America | COATSOME MC-8080 | Component of lipid film |
| DSPE-PEG-2K Lipid Powder | NOF America | SUNBRIGHT DSPE-020CN | Component of lipid film |
| General Thermometer | – | – | Used to measure ice bath temperature and 2-methylbutane temperature ( needs to accommodate -20C temperatures) |
| Glass Syringes | Hamilton | 81139 | Used to mix lipids in chloroform |
| Glycerol | Fisher Bioreagents | BP229-1 | Reduces freezing temperature of PBS solution |
| Heating Block | VWR Scientific Products | Heating lipid films and vaporizing droplets | |
| Lipex 10 mL Extruder | Evonik | Commercial high-pressure extrusion system | |
| Mini Vortex Mixer | Fisher brand | 14-955-151 | Used to remove excess chloroform from lipid films |
| Nitrogen Tank | – | – | Used to operate extruder |
| Phosphate Buffer Saline | Fisher Scientific | Hydrate lipid films and washing droplets | |
| Polyester Drain Disk | Whatman | 230600 | Provides support for polycarbonate filter |
| Polypropylene Caps | Fisher Scientific | 298417 | Used for solution storage |
| Propylene Glycol | Fisher Chemical | P355-1 | Reduces freezing temperature of PBS solution |
| Scintiliation Vials | DWK Life Sciences Wheaton | 986532 | Used for lipid films and microbubble generation |
| Small hammer | – | – | Used to break apart dry ice for cooling methylbutane |
| Sonicator Microtip Attachment | Branson | 101148070 | Used to generate microbubbles from lipid solution |
| Steel Container | Medegen | 79310 | Rapid precooling of microbubble solution prior to extrusion ( any container rated to -20C will work) |
| Vacuume Dessicator | Bel-Art SP Scienceware | 08-648-100 | Removes excess chloroform from lipid films |
| 2mL Centrifuge Tube | Fisher | 02682004 | Used for concentrating nanodroplets |
Riferimenti
- Sirsi, S., Borden, M. Microbubble compositions, properties and biomedical applications. Bubble Science Engineering and Technology. 1 (1-2), 3-17 (2009).
- Sheeran, P. S., Dayton, P. A. Phase-change contrast agents for imaging and therapy. Current Pharmaceutical Design. 18 (15), 2152-2165 (2012).
- Mountford, P. A., Smith, W. S., Borden, M. A. Fluorocarbon nanodrops as acoustic temperature probes. Langmuir: The ACS Journal of Surfaces and Colloids. 31 (39), 10656-10663 (2015).
- Mountford, P. A., Thomas, A. N., Borden, M. A. Thermal activation of superheated lipid-coated perfluorocarbon drops. Langmuir: The ACS Journal of Surfaces and Colloids. 31 (16), 4627-4634 (2015).
- Sheeran, P. S., Luois, S., Dayton, P. A., Matsunaga, T. O. Formulation and acoustic studies of a new phase-shift agent for diagnostic and therapeutic ultrasound. Langmuir: The ACS Journal of Surfaces and Colloids. 27 (17), 10412-10420 (2011).
- Sheeran, P. S., Dayton, P. A. Improving the performance of phase-change perfluorocarbon droplets for medical ultrasonography: current progress, challenges, and prospects. Scientifica. 2014, 579684 (2014).
- Sheeran, P. S., et al. Methods of generating submicrometer phase-shift perfluorocarbon droplets for applications in medical ultrasonography. IEEE Transactions on Ultrasonics, Ferroelectrics, and Frequency Control. 64 (1), 252-263 (2017).
- Sheeran, P. S., et al. Decafluorobutane as a phase-change contrast agent for low-energy extravascular ultrasonic imaging. Ultrasound in Medicine & Biology. 37 (9), 1518-1530 (2011).
- de Gracia Lux, C., et al. Novel method for the formation of monodisperse superheated perfluorocarbon nanodroplets as activatable ultrasound contrast agents. RSC Advances. 7 (77), 48561-48568 (2017).
- Mountford, P. A., Sirsi, S. R., Borden, M. A. Condensation phase diagrams for lipid-coated perfluorobutane microbubbles. Langmuir: The ACS Journal of Surfaces and Colloids. 30 (21), 6209-6218 (2014).
- Feshitan, J. A., Chen, C. C., Kwan, J. J., Borden, M. A. Microbubble size isolation by differential centrifugation. Journal of Colloid and Interface Science. 329 (2), 316-324 (2009).
- Wu, S. -. Y., et al. Focused ultrasound-facilitated brain drug delivery using optimized nanodroplets: vaporization efficiency dictates large molecular delivery. Physics in Medicine and Biology. 63 (3), 035002 (2018).
- Li, D. S., et al. Spontaneous Nucleation of stable perfluorocarbon emulsions for ultrasound contrast agents. Nano Letters. 19 (1), 173-181 (2019).
- Sheeran, P. S., Luois, S. H., Mullin, L. B., Matsunaga, T. O., Dayton, P. A. Design of ultrasonically-activatable nanoparticles using low boiling point perfluorocarbons. Biomaterials. 33 (11), 3262-3269 (2012).
- Kawabata, K., Sugita, N., Yoshikawa, H., Azuma, T., Umemura, S. Nanoparticles with multiple perfluorocarbons for controllable ultrasonically induced phase shifting. Japanese Journal of Applied Physics. 44 (6), 4548-4552 (2005).
- Shakya, G., et al. Vaporizable endoskeletal droplets via tunable interfacial melting transitions. Science Advances. 6 (14), 7188 (2020).
- Kopechek, J. A., Zhang, P., Burgess, M. T., Porter, T. M. Synthesis of phase-shift nanoemulsions with narrow size distributions for acoustic droplet vaporization and bubble-enhanced ultrasound-mediated ablation. Journal of Visualized Experiments: JoVE. (67), e4308 (2012).

