Produktion av membranfiltrerade fasförskjutningsdekafluorbutannanodroppar från förformade mikrobubblor
Summary
Detta protokoll beskriver en metod för att generera stora volymer av lipid inkapslade decafluorobutane microbubbles med hjälp av sond-tips ultraljudsbehandling och därefter kondensera dem till fas-skift nanodroplets med högtryck extrudering och mekanisk filtrering.
Abstract
Det finns många metoder som kan användas för produktion av vaporizable fas-shift droppar för avbildning och terapi. Varje metod använder olika tekniker och varierar i pris, material och syfte. Många av dessa tillverkningsmetoder resulterar i polydisperspopulationer med icke-enhetliga aktiveringströsklar. Dessutom kräver styrning av droppstorlekarna vanligtvis stabila perfluorkarbonvätskor med höga aktiveringströsklar som inte är praktiska in vivo. Att producera enhetliga droppar storlekar med låg kokpunkt gaser skulle vara fördelaktigt för in vivo imaging och terapi experiment. Denna artikel beskriver en enkel och ekonomisk metod för bildandet av storlek-filtrerade lipid-stabiliserade fas-skift nanodroppar med låg kokpunkt decafluorobutane (DFB). En vanlig metod för att generera lipidmikrobubblor beskrivs, förutom en ny metod för att kondensera dem med högtrycksprofilering i ett enda steg. Denna metod är utformad för att spara tid, maximera effektiviteten och generera större volymer av mikrobubble- och nanodropletlösningar för en mängd olika tillämpningar med hjälp av vanlig laboratorieutrustning som finns i många biologiska laboratorier.
Introduction
Ultraljud kontrastmedel (UCAs) växer snabbt i popularitet för imaging och terapi applikationer. Microbubbles, de ursprungliga UCAs, är för närvarande de vanliga agenterna som används i kliniska diagnostiska applikationer. Mikrobubblor är gasfyllda sfärer, vanligtvis 1-10 μm i diameter, omgivna av lipid-, protein- eller polymerskal1. Deras storlek och in vivo-stabilitet kan dock begränsa deras funktionalitet i många applikationer. Fasförskjutningsnanodroppar, som innehåller en överhettad vätskekärna, kan övervinna några av dessa begränsningar på grund av deras mindre storlek och förbättrade cirkulationslivslängd2. När den överhettade vätskekärnan utsätts för värme eller akustisk energi förångas den till en gasmikrobubble2,3,4,5. Eftersom förångningströskeln är direkt relaterad till droppstorlek5,6, skulle det vara mycket önskvärt att formulera droppfjädringar med enhetlig storlek för att uppnå konsekventa aktiveringströsklar. Formuleringsmetoder som producerar enhetliga droppstorlekar är ofta komplexa och kostsamma, medan mer kostnadseffektiva metoder resulterar i polydisperselösningar7. En annan begränsning är förmågan att generera stabila fasförskjutningsdroppar med PFC-gaser (Low-boiling Point perfluorocarbon), vilket är avgörande för effektiv aktivering in vivo8. I detta manuskript beskrivs ett protokoll för att generera stabila filtrerade låg kokpunkt vaporizable fas-shift droppar för in vivo imaging och terapi applikationer.
Det finns många metoder för att producera monodispersed submicron fasförskjutning droppar7. En av de mest robusta metoderna för att kontrollera storleken är användningen av mikrofluidiska enheter. Dessa enheter kan vara kostsamma, ha långsam produktion av droppar (~ 104-106 droppar / s) 7 och kräver omfattande utbildning. Mikrofluidiska enheter kräver också i allmänhet gaser med hög kokpunkt för att undvika spontan förångning och igensättning av systemet7. En ny studie av de Gracia Lux et al.9 visar dock hur kylning av en mikrofluidizer kan användas för att generera höga koncentrationer av submikrinfasförskjutning (1010-1012/ml) med låg kokpunkt dekafluorbutan (DFB) eller octafluorpropan (OFP).
I allmänhet är gaser med låg kokpunkt som DFB eller OFP lättare att hantera med förformade gasbubblor. Vaporizable droppar kan produceras från föregångare lipid-stabiliserade bubblor genom att kondensera gasen med låga temperaturer och förhöjt tryck5,10. Koncentrationen av droppar som produceras med denna metod beror på prekursormikrobubblekoncentration och effektiviteten av omvandling av bubblor till droppar. Koncentrerade mikrobubblor har rapporterats från tips ultraljudsbehandling närmar sig > 1010 MB/mL11, medan en separat studie har rapporterat droppkoncentrationer som sträcker sig från ~1-3 x1011 droppar/mL från kondenserade OFP och DFP bubblor12. När monodispersed droppar inte är ett problem, kondensation metoder är de enklaste och lägsta kostnadsmetoderna för att generera lipidstabiliserade fasförskjutning droppar med låg kokpunkt PFC. Metoder för att generera enhetliga storlek bubblor innan kondensering kan bidra till att skapa mer monodisperse populationer av droppar. Att generera monodisperse prekursorbubblor är dock också svårt, vilket kräver dyrare metoder som mikrofluidik eller upprepade differentialcentrifugeringstekniker11. Ett alternativt tillvägagångssätt för att producera DFB och OFB nanodroppar har nyligen publicerats med hjälp av spontana nukleering av droppar i liposomer13. Denna metod, med hjälp av en “Ouzo” -effekt, är ett enkelt sätt att generera PFC-droppar med låg kokpunkt utan att behöva kondensera bubblor. Storleksfördelningen av PFC droppar kan styras genom delikat titrering och blandning av PFC, lipid och etanol komponenter som används för att initiera nukleation av dropparna. Det är också värt att notera att blandning av perfluorkarboner kan användas för att kontrollera stabilitets- och aktiveringströsklar för nanodroppar14,15. Nyare arbete av Shakya et al. visar hur nanodropletaktivering kan justeras genom att emulgera höga kokpunkts-PFC inom ett kolväteendoskelett för att underlätta heterogen nukleation inom droppkärnan16, vilket är ett tillvägagångssätt som kan övervägas tillsammans med andra former av filtrering av droppstorlek.
När de har bildats kan fasförskjutningsdroppar extruderas efter bildandet för att skapa fler monodisperse populationer. Faktum är att ett liknande protokoll som den metod som beskrivs här har publicerats tidigare av Kopechek et al.17 med hjälp av hög kokpunkt dodecofluorpentane (DDFP) som droppkärna. Läsare som försöker använda fasförskjutningsdroppar med hög kokpunkt perfluorkarboner (stabila vid rumstemperatur) bör hänvisa till artikeln ovan istället. Att generera och extrudera droppar med låg kokpunktsgaser, såsom DFB och OFP, är mer komplicerat och kontaktas bäst genom att kondensera förformade gasbubblor.
I detta protokoll beskrivs en vanlig metod för att generera förformade lipid microbubbles med en DFB gas kärna med hjälp av sond tips ultraljudsbehandling. Därefter används en kommersiell extruder för att kondensera förformade mikrobubblor till submicronfasförskjutningsnanodroppar (figur 1). De resulterande dropparna aktiveras sedan med värme och ultraljud. Denna metod kan producera större volymer nanodropletlösning än konventionella kondensationsmetoder med smalare storleksfördelningar utan behov av dyra mikrofluidiska enheter. Produktion av nanodropletlösningar med smala storleksfördelningar kan sannolikt generera mer enhetliga förångningströsklar. Detta kommer att maximera deras potential för många applikationer såsom avbildning, ablation, läkemedelsleverans och embolization1,3,4,6.
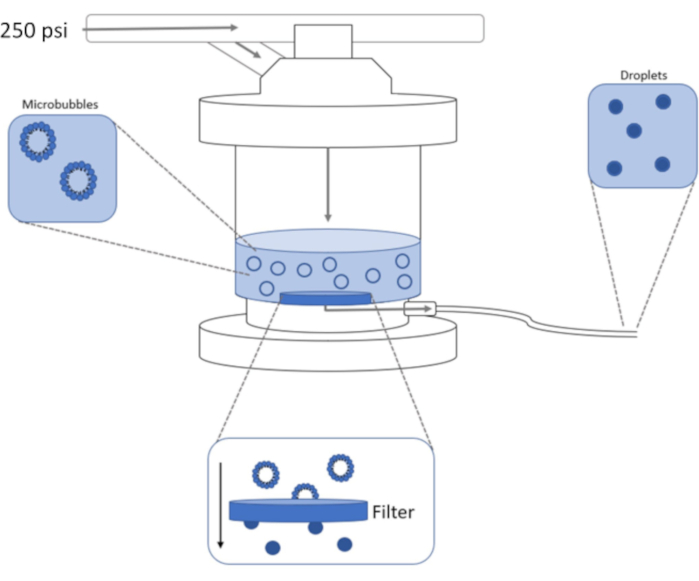
Bild 1: Schematisk högtrycksprofilering för kondensering av förformade mikrobubblor till fasförskjutningsnanodroppar. Mikrobubblelösning tillsätts till och finns i extruderkammaren, och 250 psi, från kvävetanken, appliceras genom kammarens inloppsventil. Kvävegasen kommer att driva mikrobubblelösningen genom filtret vid kammarens botten och kondensera provet till nanodroppar. Lösningen trycks slutligen ut ur extrudern genom provutloppsröret och samlas in. Klicka här för att se en större version av den här figuren.
Protocol
Representative Results
Discussion
En omfattande mängd litteratur finns tillgänglig som diskuterar formulering, fysik och potentiella tillämpningar av microbubbles och fas-skift droppar för in vivo imaging och terapi. Denna diskussion gäller uttryckligen att generera lipidmikrobubblor och omvandla dem till sub-micron fasförskjutning droppar med hjälp av en låg kokpunkt DFB gas och högtryck extrudering. Metoden som beskrivs här är avsedd att ge en relativt enkel metod för att producera stora mängder lipidmikrobubblor och DFB fasförskjutningsd…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
Vi vill tacka Dominique James i Dr. Ken Hoyts labb för att ha tillhandahållit TRSP-analys av vaporizable fas-shift nanodroppar
Materials
| 15 mL Centrifuge Tubes | Falcon | 352095 | Collecting and centrifuging droplets |
| 200 nm polycarbonate filter | Whatman | 110606 | Extruder filters |
| 2-methylbutane | Fisher Chemical | 03551-4 | Rapid precooling of microbubble solution prior to extrusion |
| 3-prong clamps X2 | Fisher | 02-217-002 | Holding scintilation vials in place for probe tip sonication |
| 400W Analog Probe Tip Sonicator with Horn | Branson | 101-063-198R | Used to generate lipid microbubbles from lipid solution |
| Bath Sonicator | Fisher Scientific | 15337402 | Used to help breakdown liposomes into unilamellar vesicles |
| Chloroform | Fisher Bioreagents | C298-4 | Used to make lipid film for microbubble preperation |
| Decafluorobutane (Perfluorobutane) Gas | FluoroMed L.P. | 1 kg | generating microbubbles via probe tip sonication |
| Dry Ice | – | – | Rapid precooling of microbubble solution prior to extrusion |
| DSPC Lipid Powder | NOF America | COATSOME MC-8080 | Component of lipid film |
| DSPE-PEG-2K Lipid Powder | NOF America | SUNBRIGHT DSPE-020CN | Component of lipid film |
| General Thermometer | – | – | Used to measure ice bath temperature and 2-methylbutane temperature ( needs to accommodate -20C temperatures) |
| Glass Syringes | Hamilton | 81139 | Used to mix lipids in chloroform |
| Glycerol | Fisher Bioreagents | BP229-1 | Reduces freezing temperature of PBS solution |
| Heating Block | VWR Scientific Products | Heating lipid films and vaporizing droplets | |
| Lipex 10 mL Extruder | Evonik | Commercial high-pressure extrusion system | |
| Mini Vortex Mixer | Fisher brand | 14-955-151 | Used to remove excess chloroform from lipid films |
| Nitrogen Tank | – | – | Used to operate extruder |
| Phosphate Buffer Saline | Fisher Scientific | Hydrate lipid films and washing droplets | |
| Polyester Drain Disk | Whatman | 230600 | Provides support for polycarbonate filter |
| Polypropylene Caps | Fisher Scientific | 298417 | Used for solution storage |
| Propylene Glycol | Fisher Chemical | P355-1 | Reduces freezing temperature of PBS solution |
| Scintiliation Vials | DWK Life Sciences Wheaton | 986532 | Used for lipid films and microbubble generation |
| Small hammer | – | – | Used to break apart dry ice for cooling methylbutane |
| Sonicator Microtip Attachment | Branson | 101148070 | Used to generate microbubbles from lipid solution |
| Steel Container | Medegen | 79310 | Rapid precooling of microbubble solution prior to extrusion ( any container rated to -20C will work) |
| Vacuume Dessicator | Bel-Art SP Scienceware | 08-648-100 | Removes excess chloroform from lipid films |
| 2mL Centrifuge Tube | Fisher | 02682004 | Used for concentrating nanodroplets |
Riferimenti
- Sirsi, S., Borden, M. Microbubble compositions, properties and biomedical applications. Bubble Science Engineering and Technology. 1 (1-2), 3-17 (2009).
- Sheeran, P. S., Dayton, P. A. Phase-change contrast agents for imaging and therapy. Current Pharmaceutical Design. 18 (15), 2152-2165 (2012).
- Mountford, P. A., Smith, W. S., Borden, M. A. Fluorocarbon nanodrops as acoustic temperature probes. Langmuir: The ACS Journal of Surfaces and Colloids. 31 (39), 10656-10663 (2015).
- Mountford, P. A., Thomas, A. N., Borden, M. A. Thermal activation of superheated lipid-coated perfluorocarbon drops. Langmuir: The ACS Journal of Surfaces and Colloids. 31 (16), 4627-4634 (2015).
- Sheeran, P. S., Luois, S., Dayton, P. A., Matsunaga, T. O. Formulation and acoustic studies of a new phase-shift agent for diagnostic and therapeutic ultrasound. Langmuir: The ACS Journal of Surfaces and Colloids. 27 (17), 10412-10420 (2011).
- Sheeran, P. S., Dayton, P. A. Improving the performance of phase-change perfluorocarbon droplets for medical ultrasonography: current progress, challenges, and prospects. Scientifica. 2014, 579684 (2014).
- Sheeran, P. S., et al. Methods of generating submicrometer phase-shift perfluorocarbon droplets for applications in medical ultrasonography. IEEE Transactions on Ultrasonics, Ferroelectrics, and Frequency Control. 64 (1), 252-263 (2017).
- Sheeran, P. S., et al. Decafluorobutane as a phase-change contrast agent for low-energy extravascular ultrasonic imaging. Ultrasound in Medicine & Biology. 37 (9), 1518-1530 (2011).
- de Gracia Lux, C., et al. Novel method for the formation of monodisperse superheated perfluorocarbon nanodroplets as activatable ultrasound contrast agents. RSC Advances. 7 (77), 48561-48568 (2017).
- Mountford, P. A., Sirsi, S. R., Borden, M. A. Condensation phase diagrams for lipid-coated perfluorobutane microbubbles. Langmuir: The ACS Journal of Surfaces and Colloids. 30 (21), 6209-6218 (2014).
- Feshitan, J. A., Chen, C. C., Kwan, J. J., Borden, M. A. Microbubble size isolation by differential centrifugation. Journal of Colloid and Interface Science. 329 (2), 316-324 (2009).
- Wu, S. -. Y., et al. Focused ultrasound-facilitated brain drug delivery using optimized nanodroplets: vaporization efficiency dictates large molecular delivery. Physics in Medicine and Biology. 63 (3), 035002 (2018).
- Li, D. S., et al. Spontaneous Nucleation of stable perfluorocarbon emulsions for ultrasound contrast agents. Nano Letters. 19 (1), 173-181 (2019).
- Sheeran, P. S., Luois, S. H., Mullin, L. B., Matsunaga, T. O., Dayton, P. A. Design of ultrasonically-activatable nanoparticles using low boiling point perfluorocarbons. Biomaterials. 33 (11), 3262-3269 (2012).
- Kawabata, K., Sugita, N., Yoshikawa, H., Azuma, T., Umemura, S. Nanoparticles with multiple perfluorocarbons for controllable ultrasonically induced phase shifting. Japanese Journal of Applied Physics. 44 (6), 4548-4552 (2005).
- Shakya, G., et al. Vaporizable endoskeletal droplets via tunable interfacial melting transitions. Science Advances. 6 (14), 7188 (2020).
- Kopechek, J. A., Zhang, P., Burgess, M. T., Porter, T. M. Synthesis of phase-shift nanoemulsions with narrow size distributions for acoustic droplet vaporization and bubble-enhanced ultrasound-mediated ablation. Journal of Visualized Experiments: JoVE. (67), e4308 (2012).

