ERRATUM NOTICE
Important: There has been an erratum issued for this article. Read more …
Summary
Этот метод описывает очистку с помощью проточной цитометрии MEP и MKp от бедренных костей, большеберцовой кости и костей таза мышей.
Abstract
Мегакариоциты костного мозга представляют собой крупные полиплоидные клетки, обеспечивающие выработку тромбоцитов крови. Они возникают из гемопоэтических стволовых клеток через мегакариопоэз. Заключительные этапы этого процесса сложны и классически включают бипотентные мегакариоцитарно-эритроцитарные прародители (MEP) и унипотентные мегакариоцитарные прародители (MKp). Эти популяции предшествуют образованию настоящих мегакариоцитов, и, как таковые, их выделение и характеристика могут позволить провести надежный и непредвзятый анализ образования мегакариоцитов. В этом протоколе подробно представлена процедура сбора кроветворных клеток из костного мозга мыши, обогащение гемопоэтических прародителей путем магнитного истощения и, наконец, стратегия сортировки клеток, которая дает высокоочищенные популяции MEP и MKp. Во-первых, клетки костного мозга собираются из бедренной кости, большеберцовой кости, а также подвздошного гребня, кости, которая содержит большое количество кроветворных прародителей. Использование костей подвздошного гребня резко увеличивает общее количество клеток, получаемых на мышь, и, таким образом, способствует более этичному использованию животных. Истощение магнитной линии было оптимизировано с использованием магнитных шариков 450 нм, что позволило очень эффективно сортировать ячейки с помощью проточной цитометрии. Наконец, в протоколе представлена стратегия маркировки и сортировки двух высокоочищеных популяций-прародителя мегакариоцитов: MEP (Lin-Sca-1-c-Kit+CD16/32-CD150+CD9dim)и MKp (Lin- Sca-1-c-Kit+CD16/32-CD150+CD9bright ). Этот метод прост в реализации и обеспечивает достаточно клеточного материала для выполнения i) молекулярной характеристики для более глубокого знания их идентичности и биологии, ii) анализов дифференцировки in vitro, которые обеспечат лучшее понимание механизмов созревания мегакариоцитов, или iii) in vitro моделей взаимодействия с их микросредой.
Introduction
Тромбоциты крови вырабатываются мегакариоцитами. Эти крупные полиплоидные клетки расположены в костном мозге и, как и все клетки крови, получены из гемопоэтических стволовых клеток (HSC)1. Классический путь производства мегакариоцитов в костном мозге берет свое начало от ГСК и предполагает генерацию различных прародителей, которые постепенно ограничивают их дифференцировальный потенциал2. Первым прародителем, подписавшим обязательство по мегакариоцитарной линии, является мегакариоцит-эритроцитарный прародитель (MEP), бипотентный прародитель, способный продуцировать как эритроидныеклетки,так и мегакариоциты3,4,5. Затем MEP производит унипотентный предшественник / предшественник (MKp), который будет дифференцироваться в зрелый мегакариоцит, способный продуцировать тромбоциты. Механизмы, участвующие в генерации этих прародителей, а также их дифференцировка и созревание в мегакариоциты сложны и понятны лишь частично. Кроме того, гетерогенность популяции MEP с точки зрения потенциала дифференцировки и внутреннего уровня приверженности этих клеток все еще неясна. Чтобы расшифровать эти процессы, важно получить (или иметь доступ) очищенные популяции MEP и MKp для тонкомолекулярного и одноклеточного анализа.
Несколько исследований продемонстрировали особые комбинации маркеров клеточной поверхности для идентификации прародителей, приверженных мегакариоцитарной линии у мышей6,7,8. Из них был разработан метод, позволяющий очищать MEP и MKp от мышей. Этот метод был оптимизирован для получения клеток в достаточном количестве и качестве для большого количества анализов. С учетом этических соображений и для того, чтобы свести к минимуму количество животных, участвующих в экспериментах, мы собрали костный мозг из бедренной и большеберцовой костей, а также из подвздошного гребня. Эта кость содержит высокую частоту и количество кроветворных прародителей и большую часть времени повреждается во время длительного сбора костной ткани. Здесь представлен подробный метод надежного сбора этой кости.
Вторым критерием оптимизации является создание высокоочищеных клеточных популяций. Флуоресцентная активированная сортировка клеток (FACS) является методом выбора для получения очищенных популяций интересующих клеток. Тем не менее, низкие урожаи достигаются, когда интересуемая популяция клеток очень редка. Таким образом, необходимы процедуры обогащения. В этом протоколе была выбрана процедура отрицательного отбора с использованием магнитных шариков.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
Протоколы с участием животных были выполнены в соответствии с Комитетом CREMEAS по этике экспериментов на животных Страсбургского университета (Comité Régional d'Ethique en Matière d'Expérimentation Animale Strasbourg. Номер разрешения: E67-482-10).
1. Коллекция мышиных костей
- Приносить животное в жертву в соответствии с институциональными рекомендациями.
ПРИМЕЧАНИЕ: Данные, представленные в этой рукописи, были получены от мышей C57Bl/6 в возрасте от 8 до 12 недель. Количество полученных клеток и частота цитируемых популяций могут варьироваться в зависимости от возраста и штамма мыши. - Опрыскиваем тело 70% этанолом.
- С помощью ножниц сделайте 0,5-1 см разрез кожи перпендикулярно позвоночнику и разорвите кожу по всему телу. Стяните кожу с нижней части тела и удалите кожу.
- Поместите животное на подушечку для рассечения лицевой стороной вниз. Найдите тазовые кости, скользя пальцами по открытому позвоночнику сверху вниз. Чтобы найти подвздошный гребень, определите небольшую шишку в поясничной области вблизи задних конечностей (переднесуберная область тазовой кости). На рисунке 1A,B представлено схематическое изображение анатомии мыши.

Рисунок 1:Анатомия мыши. (A) Рентген мыши, показывающий задние кости. Обратите внимание на пространство между тазовой костью и позвоночником (желтая стрелка), куда необходимо вставить ножницы, чтобы правильно отделить задние конечности от тела мыши (желтая пунктирная линия). (B)Схематическое изображение костей, богатых костным мозгом, представляющих интерес. Тазовые кости изображены красным цветом, бедренные кости фиолетовым, а большеберцовые кости — зеленым. (C) Схематическое изображение тазовой кости мыши. Подвздошная кость соответствует богатой костному мозгу части тазовой кости и выделена красным цветом. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
- Поместите ножницы параллельно позвоночнику против позвонков и вплотную к бугоре подвздошного гребня. Приступайте к разрезанию мышц вдоль стороны позвоночника над тазовой костью, скользя ножницами вдоль позвонков вплоть до хвоста.
ПРИМЕЧАНИЕ: Этот первый участок мышц также может быть выполнен с помощью лезвия скальпеля. - Поместите ножницы параллельно позвоночнику и приступайте к разрезанию между позвонками и подвздошным гребнем, как показано желтой пунктирной линией на рисунке 1А. Убедитесь, что вы остаетесь как можно ближе к позвонкам. Отрежьте оставшиеся мышцы, чтобы отсоедать конечность от тела.
ПРИМЕЧАНИЕ: Сопротивления должно быть практически нет. - Повторите с другой стороны, чтобы отсоедать вторую конечность.
- Перенесите конечности на чистую поверхность и выбросьте остальную часть тела в соответствии с институциональными рекомендациями.
- Обнажите тазовые, бедренные и большеберцовые кости, удалив как можно больше окружающих тканей с помощью щипцов и скальпелей.
- Осторожно вывихнуть головку бедренной кости от тазовой кости, удерживая дистальный конец бедренной кости щипцами, осторожно нарезая мышцы вокруг сочленения скальпелями. Пошевелить костями, чтобы облегчить вывих.
- Соскоблите оставшуюся мышцу с тазовой кости и разрежьте скальпелем в середине полости, которая держала головку бедренной кости. Подвздошная кость сохраняется, так как она богата кроветворными прародителями, в то время как треугольная очень тонкая сторона кости отбрасывается, как показано на рисунке 1C.
- Удалите остаточные ткани вокруг подвздошной кости скальпелем и поместите очищенную кость в стерильный PBS, дополненный 2% сывороткой для новорожденных телят (PBS-2% NBCS).
- С помощью ножниц отрежьте стопу от ноги на лодыжке.
- Удерживайте нижнюю часть большеберцовой кости щипцами и соскоблите мышцу вверх к колену. Отбросьте малоберцовые кости и перережьте скальпелем большеберцовое плато. Поместите большеберцовую кость в стерильный PBS-2%NBCS.
- Удалите остаточные ткани вокруг бедренной кости скальпелями.
- Удерживать верхнюю сторону бедренной кости щипцами; поместите лезвие скальпеля у основания коленной чашечки. Приложить силу к коленной чашечке параллельно бедренной кости до отслоения коленной чашечки. Поместите бедренную комть в стерильный PBS-2%NBCS. Снятие коленной чашечки обеспечивает чистый доступ для введения иглы для промывки костного мозга.
2. Магнитное истощение положительных клеток линии
- В ламинарной проточная тумба переложите кости в стерильную чашку Петри, наполненную стерильным PBS-2%NBCS.
- Скальпелем отрезают головку бедренной кости.
- Заполните шприц 1 мл стерильным PBS-2%NBCS и прикрепите иглу 21 Г к выходу.
- Наполните 5 мл полипропилеленовой трубки 2 мл стерильного PBS-2%NBCS.
- Удерживать бедренную комку щипцами; аккуратно вставьте иглу в канавку, оставшуюся после снятия коленной чашечки. Приложите вращение к игле во время введения, чтобы избежать затыкания иглы. Убедитесь, что игла полностью вставлена в кость до скоса.
- Перенесите кость иглой в трубку, содержащую 2 мл PBS-2%NBCS. Дозируют и аспирируют PBS-2%NBCS из шприца до тех пор, пока кость не очистится.
- Извлеките иглу из бедренной кости и вставьте ее в отверстие на противоположной стороне, где была головка бедренной кости. Снова дозируют и аспирируют буфер и выбрасывают кость.
- За подвздошный гребень и большеберцовую кость держат кость щипцами; аккуратно вставьте иглу в открытую сторону. Приложите вращение к игле во время введения, чтобы избежать затыкания иглы. Убедитесь, что игла полностью вставлена в кость до скоса. Перенесите кость иглой в трубку, содержащую 2 мл PBS-2%NBCS. Дозируют и аспирируют PBS-2%NBCS из шприца до тех пор, пока кость не очистится. Выбросьте кости.
ПРИМЕЧАНИЕ: Кости до трех мышей могут быть смыты в одну и ту же трубку. Объедините суспензии клеток. - Пропустите объединенную клеточную суспензию через крышку клеточного сетчатого фильтра размером 40 мкм, помещенную на стерильную полистирольную трубку 5 мл.
- Приступайте к подсчету ячеек.
ПРИМЕЧАНИЕ: Подсчет клеток может быть выполнен с помощью любого гемоцитометра, с использованием Trypan Blue для оценки жизнеспособности или с помощью любого автоматизированного счетчика клеток. Одна мышь обычно дает 105 ± 7 x 106 ячеек. - Отберите в сторону 100 мкл клеточной суспензии в качестве общего костного мозга, добавьте 500 мкл PBS-2% NBCS и сохраните его на льду для процедуры окрашивания.
- Гранулируют фильтрованную суспензию центрифугированием при 400 х г в течение 5 мин при 4 °С и выбрасывают супернатант.
ПРИМЕЧАНИЕ: Эритроциты могут быть лизированы путем повторного использования гранулы в свежеприготовленном растворе лизиса(1/10-я часть в dH2O). Инкубировать в течение 5 мин до тех пор, пока суспензия не станет прозрачной и ярко-красной и добавить 10 объемов стерильного ПБС. Приступают к промывке клеток в PBS-2%NBCS центрифугированием при 400 х г в течение 5 мин при 4 °C. Будьте осторожны при удалении супернатанта, так как ячейка гранулы очень рыхлые. Выполните вторую промывку PBS-2%NBCS центрифугированием при 400 х г в течение 5 мин при 4 °C и перейдите к шагу 2.13. - Повторно суспендируют клеточную гранулу в свежеприготовленном коктейле первичных антител с соотношением 100 мкл на 1 х 107 клеток. Инкубировать на льду в течение 30-45 мин.
| Антитело | Разбавление |
| Гр-1-биотин | 1:500 |
| B220-биотин | 1:500 |
| Мак-1-биотин | 1:500 |
| CD3-биотин | 1:500 |
| CD4-биотин | 1:500 |
| CD5-биотин | 1:500 |
| CD8-биотин | 1:500 |
| TER119-биотин | 1:1000 |
| CD127-биотин | 1:500 |
Таблица 1.
- Отложите 10 мкл клеточной суспензии в стерильную полистирольную трубку 5 мл с маркировкой Lin-Pos Fraction. Добавьте 90 мкл PBS-2%NBCS и сохраните его на льду для процедуры окрашивания.
- Продолжают промывать клетки дважды стерильным PBS-2%NBCS центрифугированием при 400 х г в течение 5 мин при 4 °C. Обязательно сделайте последнюю стирку в стерильной полипропиленовой трубке 5 мл.
- Во время этапов стирки подготовьте бусины к магнитному истощению.
- Повторно суспендирование бусин во флаконе путем тщательного вихря в течение 30 с.
- Перенесите объем шариков, соответствующий двум шарикам на ячейку-мишень, в полипропиленовую трубку объемом 5 мл.
- Дважды вымойте бусины PBS-2%NBCS, поместив трубку на магнит и сняв буфер для стирки с помощью стерильной стеклянной пипетки Пастера.
- Повторное суспендирование шариков в 500 мкл стерильного PBS-2NBCS%.
- Повторно суспендировать гранулы меченых клеток в 250 мкл шариков и аккуратно перемешать в течение 5 мин на льду. Добавьте 2 мл стерильного PBS-2%NBCS и аккуратно перемешайте. Не встряхивайте трубку.
- Поместите трубку на магнит на 2 мин.
- Приступайте к сбору немагнитной фракции стерильной стеклянной пипеткой Пастера и добавляйте ее на оставшиеся 250 мкл магнитных шариков. Запечатайте трубку парапленкой.
- Поместите трубку на трубчатый валик на 20 мин при 4 °C.
- Добавьте 2 мл стерильного PBS-2%NBCS и аккуратно перемешайте. Не встряхивайте трубку.
- Поместите трубку в магнит на 2 мин.
- Приступайте к сбору немагнитной фракции в стерильную полипропиленовую трубку 5 мл с маркировкой Lin-Neg Fraction со стерильной стеклянной пипеткой Пастера.
- Гранулируют ячейки центрифугированием при 400 х г в течение 5 мин при 4 °С и удаляют супернатант.
- Повторное суспендирование немуагнитных клеток в 500 мкл стерильного PBS-2%NBCS.
- Приступайте к подсчету ячеек.
ПРИМЕЧАНИЕ: Одна мышь обычно дает 3,9 ± 1,1 x 106 ячеек. Типичные окрашивания линий до и после истощения представлены на рисунке 2B.
3. Клеточная сортировка прародителей мегакариоцитов с помощью проточной цитометрии
- Возьмите трубки с маркировкой Total Bone Bone Marrow, Lin-Pos Fraction и Lin-Neg Fraction.
- Приступайте к разделению содержимого трубки Total Bone BoneRow поровну на шесть стерильных полистирольных трубок объемом 5 мл. Маркировка тубок цифрами 1-6.
- Приступайте к маркировке трубки Lin-Pos Fraction цифрой 7.
- Приступайте к расщеплению содержимого трубки Lin-Neg Fraction следующим образом.
- Переложить 50 мкл в стерильную 5 мл полистирольную трубку, содержащую 250 мкл стерильного PBS-2%NBCS. Затем разделите его содержание поровну на 3 стерильные полистирольные трубки по 5 мл. Маркируют эти трубки цифрами 8-10.
- Оставшимся 450 мкл клеточной суспензии Lin-Neg Fraction соответствует трубке с номером 11.
- Добавьте антитела к пробиркам, как описано в таблице 2.
| Тюбик | Ярлык | Коктейль антител |
| Общий костный мозг | ||
| 1 | Незапятнанный контроль | |
| 2 | Управление с одним окрашиванием | CD45-FITC (1/200) |
| 3 | Управление с одним окрашиванием | CD45-PE (1/200) |
| 4 | Управление с одним окрашиванием | ТЕР119-БТР (1/200) |
| 5 | Управление с одним окрашиванием | CD45-PECy7 (1/200) |
| 6 | Управление с одним окрашиванием | CD45-APC-Cy7 биотин (1/200) |
| Фракция Лин-Пос | ||
| 7 | Управление с одним окрашиванием | Управление с одним окрашиванием. Стрептавидин-БТР-Cy7 (1/500) |
| Фракция Лин-Нег | ||
| 8 | Управление FMO FITC | c-kit-APC (1/200) + Sca-1-PE (1/200) + CD16/32-PE (1/200) + CD150-PECy7 (1/200) + Стрептавидин-APC-Cy7 (1/500) |
| 9 | Управление FMO PE | CD9-FITC (1/200) + c-kit-APC (1/200) + CD150-PECy7 (1/200) + Стрептавидин-APC-Cy7 (1/500) |
| 10 | Управление FMO PECy7 | CD9-FITC (1/200) + c-kit-APC (1/200) + Sca-1-PE (1/200) + CD16/32-PE (1/200) + Стрептавидин-APC-Cy7 (1/500) |
| 11 | Положительная труба для сортировки | CD9-FITC (1/200) + c-kit-APC (1/200) + Sca-1-PE (1/200) + CD16/32-PE (1/200) + CD150-PECy7 (1/200) + Стрептавидин-APC-Cy7 (1/500) |
Таблица 2.
- Насиживают на льду в течение 30-45 мин в темное время суток.
- Промыть клетки стерильным PBS-2%NBCS центрифугированием при 400 х г в течение 5 мин при 4 °C.
- Повторно суспендируют гранулы клеток следующим образом.
- Для пробирок от 1 до 10 повторно суспендируют гранулу в 300 мкл стерильного PBS-2%NBCS, дополненного 7AAD (2,5 мкг/мл финала) (PBS-7AAD).
ВНИМАНИЕ: 7AAD является интеркалантом ДНК и поэтому должен обрабатываться с помощью соответствующих СИЗ (перчаток). - Для трубки 11 повторно суспендируют гранулу в стерильном PBS-7AAD в максимальной концентрации 5 х10 6 клеток на мл и минимальном объеме 1 мл.
- Для пробирок от 1 до 10 повторно суспендируют гранулу в 300 мкл стерильного PBS-2%NBCS, дополненного 7AAD (2,5 мкг/мл финала) (PBS-7AAD).
- Подготовьте две полипропиленовые коллекторные трубки с маркировкой MEP и MKp, содержащие 2 мл PBS-2%NBCS.
ПРИМЕЧАНИЕ: Альтернативно, клетки могут быть собраны в культуральная среда или буфер лизиса клеток в зависимости от последующего применения для отсортированных клеток. Использование полистирольных трубок не рекомендуется из-за возможного вмешательства в заряженные капли, содержащие интересующих клетки. - Держите все трубки на льду в темноте.
- Перейдите к настройке сортировщика ячеек.
- Используйте трубки 1-7 для установки напряжения и компенсации, трубки 7-10 для определения сортировочных затворов для интересующих популяций клеток и трубку 11 для сортировки ячеек.
- Первые шаги стратегии гастина направлены на исключение дублетов и мертвых клеток из анализа, как описано на рисунке 3. Определите одиночные жизнеспособные ячейки и отобразите точечный график SSC-vs Lin-APC-Cy7, чтобы подтвердить эффективность истощения линии. Из Lin- ячеек устанавливается затвор для отбора ячеек положительных для c-kit и отрицательных или тусклых для Sca-1 и CD16/32. Точечный график экспрессии CD9 против CD150 для выбранных клеток позволяет идентифицировать четыре популяции.
ПРИМЕЧАНИЕ: Клетки MEP и MKp положительны для CD150. Можно определить три уровня экспрессии для CD9 (neg, dim и high). MKp экспрессирует высокий уровень CD9 и MEP экспресс CD9 при промежуточном уровне интенсивности флуоресценции. Популяция MEP соответствует Lin- c-Kit+ Sca-1-CD16/32-/dim CD150+ CD9dim, а популяция MKp соответствует Lin- c-Kit+ Sca-1-CD16/32-/dim CD150+ CD9яркий. Различение между CD9 высокими и CD9 тусклыми популяциями для CD150-положительных клеток установлено на основе максимального уровня экспрессии CD9 в отрицательной популяции CD150. Одна мышь обычно дает 5,3 ± 0,6 x 103 МКп и 27,2 ± 2,4 x 103 MEP.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Фенотипический анализ клеток, идентифицированных как MEP и MKp, проводили методом проточной цитометрии. Клетки были помечены флуоресцентными конъюгированными антителами к CD41a и CD42c, классическим маркерам мегакариоцитарных и тромбоцитарных линий. Оба маркера были экспрессированы клетками популяции MKp, в то время как эти маркеры еще не обнаружены на поверхности клеток популяции MEP(Рисунок 4Ai,4Aii). Полиплоидия является отличительной чертой мегакариоцитов. Содержание ДНК отсортированных популяций также было проанализировано и продемонстрировано, что клетки в основном 2N для популяции MEP и небольшая часть клеток MKp составляет 4N, но более высокая плоидность не обнаруживается в этих популяциях значительно(рисунок 4Aiii).
Чтобы подтвердить идентичность отсортированных клеточных популяций, было проведено несколько дифференцировочных анализов для оценки их способности дифференцироваться в сторону мегакариоцитарных и эритроидных линий. Во-первых, были проведены полутвердые клоногенные анализы для количественной оценки мегакариоцитарных прародителей (КОЕ-МК) и эритроидных прародителей (БФУ-Е). КОЕ-МК были обнаружены как в популяциях MEP, так и в MKp, но не в другой протестированной популяции(рисунок 4B). BFU-E не были обнаружены в популяции MKp, но были обнаружены в популяции MEP и популяциидим-клеток CD150-CD9(рисунок 4C).
Дифференцировка отсортированных клеток наблюдалась также в жидкой культуре в присутствии низкой концентрации кроветворных цитокинов. Репрезентативные изображения из микроскопического наблюдения на3-й день дифференцировки показывают, что MEP и MKp продуцируют в основном мегакариоциты, которые идентифицируются как крупныеклетки (Рисунок 5Aiii,5Aiv). Мегакариоциты были идентифицированы с использованием экспрессии CD41 и CD42c и представляют собой 53,9 ± 10,4% и 82,0 ± 2,0% клеток, продуцируемых из клеточных популяций MEP и MKp соответственно(рисунок 5B). Примечательно, что плоидия мегакариоцитов, полученных с использованием ДНК-маркера Hoescht 33242, была больше для мегакариоцитов, полученных из популяции MKp, по сравнению с популяцией MEP, предполагающей более зрелое состояние(рисунок 5C). Наконец, клетки, полученные из каждой популяции на3-й день, подвергали проплатлет-образуятельному анализу9. Было замечено, что только клетки, полученные из популяции MKp, были способны к излучению проплатлетов в этом состоянии(рисунок 5D). Это говорит о более продвинутой стадии созревания популяции MKp. Кроме того, когда продолжительность культивируемой культуры увеличивается до 4-5 дней, мегакариоциты, генерируемые MEP, также будут расширять проплацелеты.

Рисунок 2:Магнитное истощение выделенных (Lin) клеток. (A) Схематическое представление протокола магнитного истощения. Во-первых, несортированные клетки костного мозга маркируются биотин-конъюгированной коктейлем антимышьих антител крыс. Затем клетки инкубируют с помощью магнитных шариков, покрытых анти-крысиным Ig, и впоследствии подвергают магнитному истощению с использованием сильного магнита. Магнит будет удерживать меченую магнитную фракцию Lin+ на стенках трубки, в то время как немаркированная немуагнитная Lin-negative фракция будет собрана в новую трубку. (B)Клетки, зафиксированные линией, могут быть идентифицированы с использованием флуоресцентного конъюгированного стрептавидина. Типичный анализ экспрессии линии в клетках до магнитного истощения (общий костный мозг) и после магнитного истощения (Lin-Фракция) N = 21. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 3:Стратегия сортировки ячеек. (A) Выбор событий, соответствующих жизнеспособным одиночным ячейкам. (B) Отбор населения в Европарламент и МКП. (i) Популяция Лин Нег выбирается из жизнеспособных одноклеточных событий. (ii)Затем выбираются прародители, экспрессивающие c-kit и имеющие низкую или нультивную экспрессию антигена Sca-1 или CD16/32. (iii)Уровни экспрессии CD9 и CD150 определяют четыре клеточные популяции. MKp определяются как CD9яркиеCD150+ ячейки, MEP определяются как CD9dimCD150+. Более высокий предел экспрессии CD9 для cd9dimCD150+ популяции основан на максимальном уровне экспрессии CD9 для CD150- клеток. С целью анализа также были отсортированы CD9dimCD150- клетки (Прагениторы) и CD9-CD150- (Double Negative: DN). (C)Сортировочные затворы ячеек основаны на элементах управления Fluorescence Minus One (FMO). (i)Управление FMO для затворов CD9 (ii) Управление FMO для затворов CD150. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 4:Характеристика клеточных популяций MEP и MKp. (A) Анализ проточной цитометрии(i)экспрессии CD41,(ii)экспрессии CD42c и(iii)содержания ДНК (Hoechst33342) в популяциях CD9+CD150dim (MEP) и CD9+CD150ярких (MKp). (B) Количественная оценка КОЕ-МК из отсортированных клеточных популяций. CD9-CD150- (DN), CD9+CD150- (Prog), CD9+CD150dim (MEP) и CD9+CD150яркие (MKp) популяции клеток были отсортированы и покрыты коллагеновым гелем в соответствии с инструкциями производителя. (C) Количественная оценка BFU-E из отсортированных клеточных популяций. CD9-CD150- (DN), CD9+CD150- (Prog), CD9+CD150dim (MEP) и CD9+CD150яркие (MKp) популяции клеток были отсортированы и покрыты метилцеллюлозным гелем в соответствии с инструкциями производителя. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 5:Потенциал дифференциации MEP и MKp. CD9-CD150-(DN), CD9+CD150-(Prog), CD9+CD150dim(MEP) и CD9+CD150яркие(MKp) клеточные популяции культивировали в течение трех дней в среде StemSpan с добавлением SCF (7,5 нг / мл), Flt-3 (5 нг / мл), IL-6 (1 нг / мл) и TPO (10 нг / мл). (A) Репрезентативные изображения были сделаны с помощью фазово-контрастной микроскопии. (B) Процент CD41+CD42c+ мегакариоцитов затем оценивали с помощью проточной цитометрии. N = 3. (C)Уровень плоидности CD41+CD42c+ мегакариоцитов затем оценивали с помощью Hoechst с помощью проточной цитометрии. N = 3. (D) Клетки, полученные на 3-й день из CD9-CD150-(DN), CD9+CD150-(Prog), CD9+CD150dim(MEP) и CD9+CD150ярких(MKp) клеточных популяций, были собраны и культивированы в среде DMEM, дополненной 50 нг / мл TPO, 10% сывороткой для телят плода и 100 Ед / мл гирудина. (i)Пропорция проплателетообразующих мегакариоцитов в культуре определялась микроскопическим наблюдением. Мегакариоциты были идентифицированы на основе их размера и/или наличия проплацетов. N = 2. ii)Репрезентативная фотография проплатлета, несущего мегакариоцит, с помощью фазово-контрастной микроскопии. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Способ, описанный в данной работе, позволяет экстракцию и очистку мышиных MEP и MKp. Важным параметром в оптимизации протокола было получение достаточного количества клеток, которые были бы совместимы с большинством молекулярных и клеточных анализов. Общая практика сбора костной ткани мыши для извлечения кроветворных клеток обычно заключается в сборе как бедренных, так и большеберцовых костей каждой мыши. Таким образом, тазовая кость, еще один источник кроветворного материала, часто упускается из виду. Причинами, по которым не собирают подвздошный гребень, является плохое знание внутренней анатомии скелета мыши и тот факт, что пользователи классически собирают задние конечности, разрезая поперек или чуть выше головки бедренной кости. Кроме того, часто предполагается, что клетки костного мозга не будут эффективно вымываться из кости подвздошного гребня из-за наличия трабекул, которые отсутствуют в центральной части большеберцовой и бедренной костей. В этом протоколе рассматриваются эти две проблемы и представлен стандартизированный, надежный и эффективный по времени метод, который позволяет правильно промывать каждую заднюю кость, включая тазовую кость. В частности, использование подвздошной кости дает 105 ± 7 х 106 клеток на мышь, в то время как классический метод обычно дает 42 ± 5 х 106 клеток. Основным преимуществом этого метода является сокращение числа животных, необходимых для получения заданного количества клеток-мишеней, что обеспечивает более этичные и экономически эффективные экспериментальные условия. Поэтому эта процедура также применима для любого исследования, требующего суспензии клеток костного мозга, такого как выделение гемопоэтических стволовых клеток10 или анализ поведения кроветворного прародителя в полутвердых условиях11.
Сортировка клеток с использованием проточной цитометрии является мощным методом с большим преимуществом с точки зрения чистоты по сравнению с методами магнитного обогащения, но выход сортировки клеток для редких популяций может быть ниже, чем для более распространенных популяций. Поэтому магнитное истощение нежелательных клеток заранее является полезным методом увеличения частоты интересующих клеток. Здесь процедура магнитного истощения отличается от рекомендации производителя и учитывает неоднородность в экспрессии поверхностных маркеров, используемых для удаления нежелательных положительных клеток линии. С типичными, одношагическими протоколами, клетки с положительной линией с самой высокой экспрессией поверхностных маркеров быстро насыщают магнитные шарики. Они предотвратят последующий захват оставшихся меченых клеток конкуренцией и стерическими помехами, тем самым значительно снижая эффективность истощения. Для решения этой проблемы было разработано двухступенчатое магнитное истощение, которое позволяет последовательно удалять все клетки, положительные линии, что позволяет проводить строгие истощения, пригодные для сортировки клеток.
Другим критическим параметром для достижения эффективного истощения является соответствующая маркировка условий нежелательных клетк, положительных по линии. Поэтому титрование антител было специально оптимизировано. Использование более высоких концентраций антител приведет к чрезмерному розеттингу магнитных шариков и неспецифическом истощению интересующих клеток, отрицательно относящихся к линии. Использование высокоочищеных популяций клеток MEP и MKp является важным инструментом в изучении мегакариопоэсиса. Чтобы прояснить механизмы, контролирующие этот процесс, исследование изучило роль клеточного микроокружения и показало, что популяция стромальных клеток печени плода будет поддерживать дифференцировку MKp10. Отсортированная популяция также может быть использована для молекулярного или одноклеточного анализа. Это будет особенно актуально, учитывая возникающее понятие мегакариоцитарно-смещенного HSC12,13,14. Производство мегакариоцитов непосредственно из популяции HSC без генерации бипотентного прародителя было бы аварийным путем в ответ на стресс13.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Авторы заявляют об отсутствии конкурирующих финансовых интересов.
Acknowledgments
Авторы хотели бы поблагодарить Моник Фройнд, Катрин Циссель и Кетти за техническую помощь. Эта работа была поддержана ARMESA (Ассоциация исследований и развития в области медицины и санте publique) и грантом ANR-17-CE14-0001-01 для Henri.de la. Саль.
Materials
| Name | Company | Catalog Number | Comments |
| 21-gauge needles | BD Microlance | 301155 | |
| 7AAD | Sigma-Aldrich | A9400 | |
| Antibody Gr-1-biotin | eBioscience | 13-5931-85 | Magnetic depletion |
| Antibody B220-biotin | eBioscience | 13-0452-85 | Magnetic depletion |
| Antibody Mac-1-biotin | eBioscience | 13-0112-85 | Magnetic depletion |
| Antibody CD3e-biotin | eBioscience | 13-0031-85 | Magnetic depletion |
| Antibody CD4-biotin | eBioscience | 13-9766-82 | Magnetic depletion |
| Antibody CD5-biotin | eBioscience | 13-0051-85 | Magnetic depletion |
| Antibody CD8a-biotin | eBioscience | 13-0081-85 | Magnetic depletion |
| Antibody TER119-biotin | eBioscience | 13-5921-85 | Magnetic depletion |
| Antibody CD127-biotin | eBioscience | 13-1271-85 | Magnetic depletion |
| Antibody CD45-FITC | eBioscience | 11-0451-85 | Cell sorting |
| Antibody CD45-PE | eBioscience | 12-0451-83 | Cell sorting |
| Antibody TER119-APC | eBioscience | 17-5921-83 | Cell sorting |
| Antibody CD45-PECy7 | eBioscience | 25-0451-82 | Cell sorting |
| Antibody CD45-biotin | eBioscience | 13-0451-85 | Cell sorting |
| Antibody CD9-FITC | eBioscience | 11-0091-82 | Cell sorting |
| Antibody c-kit-APC | eBioscience | 17-1171-83 | Cell sorting |
| Antibody Sca-1-PE | eBioscience | 12-5981-83 | Cell sorting |
| Antibody CD16/32-PE | eBioscience | 12-0161-83 | Cell sorting |
| Antibody CD150-PECy7 | eBioscience | 25-1502-82 | Cell sorting |
| Culture medium StemSpan-SFEM | Stemcell technologies | #09650 | |
| Dissection pad | Fisher Scientific | 10452395 | |
| DPBS | Life Technologies | 14190-094 | |
| Ethanol | vWR Chemicals | 83813.360 | |
| Forceps | Euronexia | P-120-AS | |
| Glass pasteur pipette | Dutscher | 42011 | |
| Magnet : DynaMag-5 | Thermo Fisher Scientific | 12303D | |
| Magnetic beads: Dynabeads Sheep Anti-Rat IgG | Thermo Fisher Scientific | 11035 | |
| Megacult | Stemcell technologies | #04970 | |
| MethoCult SF M3436 | Stemcell technologies | #03436 | |
| Newborn Calf Serum | Dutscher | 50750-500 | |
| Red Cell Lysis solution | BD Bioscience | 555899 | |
| Scalpels | Fisher Scientific | 12308009 | |
| Scissors | Euronexia | C-165-ASB | |
| Sterile 1 mL syringes | BD Bioscience | 303172 | |
| Sterile 15mL tubes | Sarstedt | 62.554.502 | |
| Sterile 5mL polypropylene tubes | Falcon | 352063 | |
| Sterile 5mL polystyrene tubes | Falcon | 352054 | |
| Sterile tubes with 70µm cell strainer cap | Falcon | 352235 | |
| Sterile petri dish | Falcon | 353003 | |
| Streptavidin-APC-Cy7 | BD Biosciences | 554063 | Cell sorting |
| Tube roller | Benchmark Scientific | R3005 |
References
- Kaushansky, K. Historical review: megakaryopoiesis and thrombopoiesis. Blood. 111 (3), 981-986 (2008).
- Akashi, K., Traver, D., Miyamoto, T., Weissman, I. L. A clonogenic common myeloid progenitor that gives rise to all myeloid lineages. Nature. 404 (6774), 193-197 (2000).
- Debili, N., et al. Characterization of a bipotent erythro-megakaryocytic progenitor in human bone marrow. Blood. 88 (4), 1284-1296 (1996).
- Forsberg, E. C., Serwold, T., Kogan, S., Weissman, I. L., Passegué, E. New evidence supporting megakaryocyte-erythrocyte potential of flk2/flt3+ multipotent hematopoietic progenitors. Cell. 126 (2), 415-426 (2006).
- Vannucchi, A. M., et al. Identification and characterization of a bipotent (erythroid and megakaryocytic) cell precursor from the spleen of phenylhydrazine-treated mice. Blood. 95 (8), 2559-2568 (2000).
- Pronk, C. J., et al. Elucidation of the phenotypic, functional, and molecular topography of a myeloerythroid progenitor cell hierarchy. Cell Stem Cell. 1 (4), 428-442 (2007).
- Nakorn, T. N., Miyamoto, T., Weissman, I. L. Characterization of mouse clonogenic megakaryocyte progenitors. Proceedings of the National Academy of Sciences of the United States of America. 100 (1), 205-210 (2003).
- Ng, A. P., et al. Characterization of thrombopoietin (TPO)-responsive progenitor cells in adult mouse bone marrow with in vivo megakaryocyte and erythroid potential. Proceedings of the National Academy of Sciences of the United States of America. 109 (7), 2364-2369 (2012).
- Strassel, C., et al. Hirudin and heparin enable efficient megakaryocyte differentiation of mouse bone marrow progenitors. Experimental Cell Research. 318 (1), 25-32 (2012).
- Brouard, N., et al. A unique microenvironment in the developing liver supports the expansion of megakaryocyte progenitors. Blood Advances. 1 (21), 1854-1866 (2017).
- Boscher, J., Gachet, C., Lanza, F., Léon, C. Megakaryocyte culture in 3D methylcellulose-based hydrogel to improve cell maturation and study the impact of stiffness and confinement. Journal of Visualized Experiments:JOVE. , (2021).
- Sanjuan-Pla, A., et al. Platelet-biased stem cells reside at the apex of the haematopoietic stem-cell hierarchy. Nature. 502 (7470), 232-236 (2013).
- Haas, S., et al. Inflammation-driven fast-track differentiation of HSCs into the megakaryocytic lineage. Experimental Hematology. 42 (8), 14 (2014).
- Shin, J. Y., Hu, W., Naramura, M., Park, C. Y. High c-Kit expression identifies hematopoietic stem cells with impaired self-renewal and megakaryocytic bias. The Journal of Experimental Medicine. 211 (2), 217-231 (2014).
Tags
Биология выпуск 171Erratum
Formal Correction: Erratum: Isolation of Mouse Megakaryocyte Progenitors
Posted by JoVE Editors on 07/28/2021.
Citeable Link.
An erratum was issued for: Isolation of Mouse Megakaryocyte Progenitors. A figure was updated.
Figure 2 was updated from:
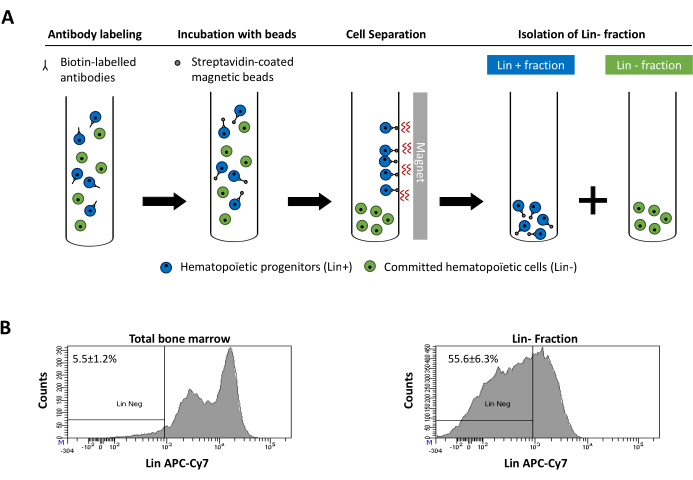
Figure 2: Magnetic depletion of lineage committed (Lin) cells. (A) Schematic representation of the magnetic depletion protocol. First, unsorted bone marrow cells are labeled with the biotin-conjugated rat anti-mouse antibody cocktail. Cells are then incubated with anti-rat Ig coated magnetic beads and subsequently subjected to the magnetic depletion using a strong magnet. The magnet will retain the labeled magnetic Lin+ fraction against the tube walls, while the unlabeled non-magnetic Lin- negative fraction will be collected in a new tube. (B) Lineage committed cells can be identified using fluorescent conjugated streptavidin. Typical analysis of the lineage expression in cells prior to magnetic depletion (total bone marrow) and after magnetic depletion (Lin- Fraction) N = 21. Please click here to view a larger version of this figure.
to:
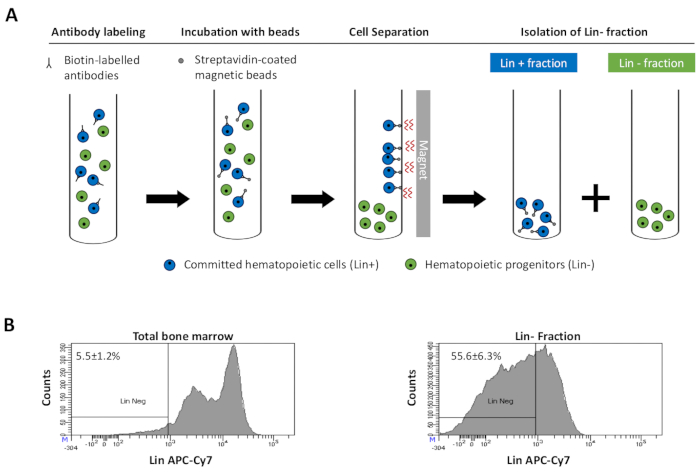
Figure 2: Magnetic depletion of lineage committed (Lin) cells. (A) Schematic representation of the magnetic depletion protocol. First, unsorted bone marrow cells are labeled with the biotin-conjugated rat anti-mouse antibody cocktail. Cells are then incubated with anti-rat Ig coated magnetic beads and subsequently subjected to the magnetic depletion using a strong magnet. The magnet will retain the labeled magnetic Lin+ fraction against the tube walls, while the unlabeled non-magnetic Lin- negative fraction will be collected in a new tube. (B) Lineage committed cells can be identified using fluorescent conjugated streptavidin. Typical analysis of the lineage expression in cells prior to magnetic depletion (total bone marrow) and after magnetic depletion (Lin- Fraction) N = 21. Please click here to view a larger version of this figure.



